新型冠状病毒肺炎(COVID-19)简称“新冠肺炎”,是指2019新型冠状病毒感染导致的肺炎。患者主要临床表现为发热、乏力,呼吸道症状以干咳为主,并逐渐出现呼吸困难,严重者表现为急性呼吸窘迫综合征(ARDS)、脓毒症休克、难以纠正的代谢性酸中毒和出凝血功能障碍。目前随着病毒毒力变化和我国对疫情防控的调整,社会暂时走出了疫情阴霾。但少数重症新冠肺炎患者病情危重,甚至导致死亡。因此,考虑变异株可能出现,未来依然需要对疫情保持警惕。不断探索提高重症新冠肺炎患者生存率及逆转危及患者生命并发症的治疗方法,是最终战胜新冠病毒强有力的“武器”。肿瘤资讯特邀重庆医科大学附属第一医院郭述良教授,对重症新冠肺炎细胞因子风暴和相关治疗方案分享专业见解。
重庆医科大学附属第一医院呼吸与危重症医学科(首批国家临床重点专科)主任
中华医学会结核病学分会副主任委员
中国医师协会呼吸医师分会常务委员
意大利佛罗伦萨大学,德国海德堡大学胸科医院客座教授
擅长复杂疑难呼吸疾病的经气道、经肺血管等精准介入诊疗和呼吸危重症救治。主持国家科技重大专项、国家自然科学基金项目4项,发表论文232篇(其中SCI 84篇,最高单篇IF 33.8),主编、副主编全国高等医药院校教材5部。荣获全国抗击新冠肺炎先进个人、全国五一劳动奖章、国务院政府特殊津贴、2022北京冬奥火炬手、教育部霍英东教育教学奖、中国医师奖、中国优秀呼吸医师奖等荣誉或奖项
PART 1:阻断“细胞因子风暴”,提高危重患者治愈率
细胞因子风暴是由感染、药物或某些疾病引起的免疫系统过度激活,一旦发生可迅速引起单器官或多器官功能衰竭,最终威胁生命。细胞因子风暴在急性呼吸系统综合症(SARS)和中东呼吸系统综合症(MERS)和流感中都是导致患者死亡的重要原因,在本次疫情中,细胞因子风暴也是引起许多患者死亡的重要原因。已有研究表明,细胞因子风暴是新冠患者病情恶化的主要临床特征,体液中多种细胞因子短时间内大量释放,激活免疫系统,导致系统性炎症损伤,是决定新冠肺炎预后的关键因素。
细胞因子主要包括干扰素(IFN)、白细胞介素(IL)、趋化因子、集落刺激因子(CSFs)、肿瘤坏死因子(TNF)等,这些细胞因子由某些免疫细胞分泌,它们有些促进炎症,有些抑制炎症,在正常人体内维持一种平衡状态。促炎因子可以激活和招募其他免疫细胞,免疫细胞可以分泌更多细胞因子,激活和招募更多的免疫细胞,如此形成了一个正反馈循环,当免疫系统因感染、药物、自身免疫性疾病等因素过度激活时,可能会分泌大量促炎因子导致正反馈循环,突破某个阈值而失控过度放大,最终形成细胞因子风暴。有研究发现,COVID-19感染的患者血清中炎症细胞因子显著升高[1],因此,发现新冠病毒感染诱发炎症风暴的关键细胞因子,阻断其信号传导,将大大降低炎症反应对病人肺组织和多器官的损伤,提高危重患者的治愈率。
PART 2:认识“IL-6”,推动有效阻断炎症风暴
白介素家族是一组参与炎症、变应反应、感染、免疫缺陷、肿瘤、纤维化和缺氧疾病的细胞因子[2]。其中IL-6是其基因转录的一种多功能细胞因子,主要由单核细胞、淋巴细胞、巨噬细胞、成纤维细胞、血管内皮细胞、角化细胞甚至一些肿瘤细胞等分泌而成[3]。COVID-19感染后T淋巴细胞和单核细胞产生大量IL-6,其异常和过度分泌可能导致严重的炎症反应,并发挥免疫破坏作用,导致严重肺损伤和功能障碍,因此可能是诱发机体产生细胞因子风暴的重要环节。
有研究发现重症新型冠状病毒肺炎患者的IL-6水平明显高于轻症患者,并认为T细胞亚群和细胞因子是预测轻度到重度转变的基础之一[4],可以将其作为治疗重症患者的靶点。同时,多项荟萃分析表明IL-6升高与COVID-19不良预后有关[5,6]。因此,监测患者体内白介素6的浓度变化,对判断病情有重要价值。《新型冠状病毒肺炎诊疗方案(试行第十版)》和《新型冠状病毒肺炎重型、危重型病例诊疗方案(试行第二版)》都已明确将“外周血炎症标志物如IL6、CRP、铁蛋白等进行性上升”作为轻型新冠肺炎患者恶化为重型或危重型的早期预警指标。
因此,靶向IL-6的抑制剂可抑制IL-6的产生和提高抗炎因子表达水平,阻断细胞因子风暴,是防治新冠肺炎的潜在药物。一项迄今最大规模的重症新型冠状病毒感染者长期生存率和生存质量的研究发布了对4869名重症患者的180天随访结果,结果发现与对照组相比,IL-6受体拮抗剂提高重症患者6个月生存率的概率大于99.9%[7]。
注射用司妥昔单抗是一种抗IL-6单克隆抗体,对IL-6具有高亲和力,可阻断IL-6与可溶性及膜结合IL-6受体(IL-6R)的结合,抑制其与gp130形成六聚体信号传导复合物[8],因此有望为提高新冠肺炎患者生存带来希望的曙光!
本文介绍了Gritti G团队发表的一篇题为IL-6 signalling pathway inactivation with siltuximab in patients with COVID-19 respiratory failure: an observational cohort study的文章[9],旨在评价司妥昔单抗治疗新冠肺炎的疗效及死亡率。
研究设计
该研究为一项观察性研究,纳入了定量逆转录PCR检测确诊为SARS-CoV-2肺部感染、符合ARDS柏林标准影像学表现、需要有创机械通气/无创通气/持续气道正压通气支持的患者。排除标准为:1. 未经治疗控制的活动性细菌或病毒性肺部感染患者;2. 接受其他抗白细胞介素治疗的患者。研究将患者分为接受司妥昔单抗治疗组和最佳支持治疗组。采用倾向性评分匹配方法减少两组患者之间基线协变量的差异。研究的主要终点是比较司妥昔单抗治疗的COVID-19患者与匹配对照组患者的死亡率。
研究结果
IL-6抑制剂让生存率提高成为可能
该研究共纳入30例患者接受司妥昔单抗治疗,188例对照组患者仅接受支持性治疗,最终纳入60例患者分析死亡率。应用倾向得分匹配法在模型中确定了以下基线协变量,将接受司妥昔单抗治疗的30例患者与30例对照组患者的临床基线特征变量进行匹配:年龄、从入院到开始通气支持的时间、CPAP/NIV或IMV通气、PaO2/FiO2、体重指数、共病(高血压、心血管疾病、脑血管疾病)以及伴随用药(抗血小板治疗和血管紧张素转换酶[ACE]抑制剂)等。
表1. 匹配对照组和司妥昔单抗治疗组的患者基线和疾病特征

根据生存分析结果,司妥昔单抗治疗的患者死亡率明显低于匹配的对照组患者(HR=0.462,95% CI 0.221–0.965); p=0.0399)(图1)。
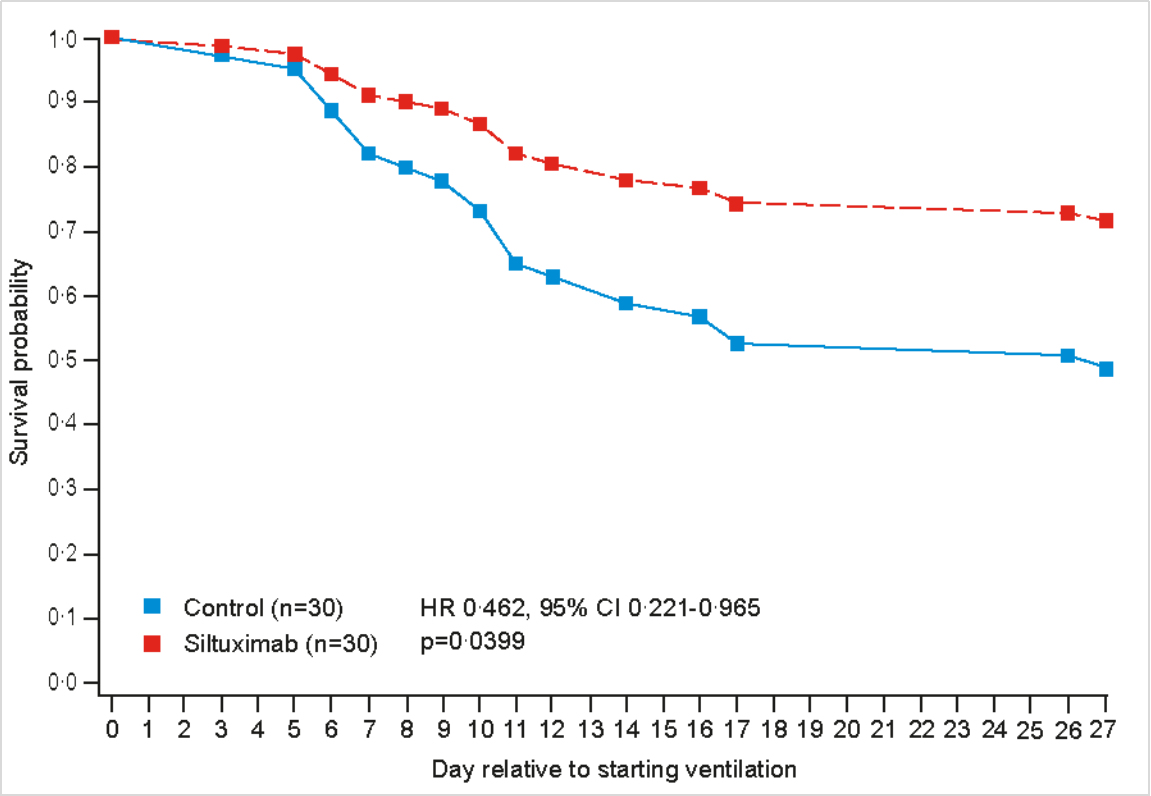
图1. 从开始呼吸机支持到因任何原因死亡,接受司妥昔单抗治疗患者与对照患者生存率
安全有效,IL-6抑制剂助力新冠重症治疗
安全性方面,接受司妥昔单抗治疗的患者中未出现其他新发药物相关不良事件,大多数不良事件为3级或以下(表2)。接受司妥昔单抗治疗的患者中有10例患者发生死亡:8例死于呼吸衰竭,1例死于多器官功能衰竭,1例死于感染性休克。在匹配的对照队列中有16例患者发生死亡。司妥昔治疗治疗的患者中发生一例3级脑血管不良事件,共有13例接受司妥昔单抗治疗的患者发生感染:2例为4级,其余11例为2级或3级。AST和ALT升高均为3级,并在研究结束时恢复正常。
表2. 接受司妥昔单抗治疗的患者的不良事件
小结
世界卫生组织(WHO)更新的2022年《COVID-19药物治疗动态指南》[10]强烈建议重型或危重型COVID-19患者系统性使用糖皮质激素,联用IL-6受体阻断剂或巴瑞替尼。司妥昔单抗是一种抗IL-6的人-鼠嵌合免疫球蛋白 G1κ(IgG1κ)型单抗,具有对靶点亲和力强、不易被IL-6R竞争的作用特点。本项研究表明,司妥昔单抗治疗可以降低重症新冠肺炎患者的死亡率。COVID-19呼吸衰竭患者可能获益于司妥昔单抗治疗,从而减少死亡率及细胞因子驱动的高炎症反应。然而,这些研究结果仍需在随机对照的临床试验中进行验证,目前关于司妥昔单抗治疗COVID-19的多项临床研究正在进行中,期待司妥昔单抗能够成为重症新冠肺炎患者新的治疗选择,给患者和家人带来更有力的保护!
[1] Zumla A, Hui DS, Azhar EI, et al. Reducing mortality from 2019-nCoV: host-directed therapies should be an option. Lancet. 2020 Feb 22;395(10224):e35-e36. doi: 10.1016/S0140-6736(20)30305-6.
[2] Yuan SM, Yan SL, Wu N. Unusual aspects of cardiac myxoma. Anatol J Cardiol. 2017 Mar;17(3):241-247.doi:10.14744/AnatolJCardiol.2017.7557.
[3] Ataie-Kachoie P, Pourgholami MH, Richardson DR, Morris DL. Gene of the month: Interleukin 6 (IL-6). J Clin Pathol. 2014 Nov;67(11):932-7. doi: 10.1136/jclinpath-2014-202493.
[4] Wan SX, Yi QJ, Fan SB, et al. Characteristics of lymphocyte subsets and cytokines in peripheral blood of 123 hospitalized patients with 2019 novel coronavirus pneumonia (NCP) [J/OL]. MedRxiv, 2020[2020-02-24]. doi: 10.1101/2020.02.10.20021832
[5] Coomes EA, Haghbayan H. Interleukin-6 in Covid-19: A systematic review and meta-analysis. Rev Med Virol. 2020 Nov;30(6):1-9. doi: 10.1002/rmv.2141. Epub 2020 Aug 26.
[6] Qin R, He L, Yang Z, et al. Identification of Parameters Representative of Immune Dysfunction in Patients with Severe and Fatal COVID-19 Infection: a Systematic Review and Meta-analysis. Clin Rev Allergy Immunol. 2022 Jan 18:1–33. doi: 10.1007/s12016-021-08908-8.
[7] Writing Committee for the REMAP-CAP Investigators, Higgins AM, Berry LR, et al. Long-term (180-Day) Outcomes in Critically Ill Patients With COVID-19 in the REMAP-CAP Randomized Clinical Trial. JAMA. 2022. doi:10.1001/jama.2022.23257.
[8] Villaescusa L, Zaragozá F, Gayo-Abeleira I, Zaragozá C. A New Approach to the Management of COVID-19. Antagonists of IL-6: Siltuximab. Adv Ther. 2022 Mar;39(3):1126-1148. doi: 10.1007/s12325-022-02042-3.
[9] Gritti G, Raimondi F, Bottazzi B, et al. Siltuximab downregulates interleukin-8 and pentraxin 3 to improve ventilatory status and survival in severe COVID-19. Leukemia. 2021 Sep;35(9):2710-2714. doi: 10.1038/s41375-021-01299-x.
[10] Lamontagne F, Agarwal A, Rochwerg B, et al. A living WHO guideline on drugs for covid-19. BMJ. 2020 Sep 4;370:m3379. doi: 10.1136/bmj.m3379. Update in: BMJ. 2020 Nov 19;371:m4475. Update in: BMJ. 2021 Mar 31;372:n860. Update in: BMJ. 2021 Jul 6;374:n1703. Update in: BMJ. 2021 Sep 23;374:n2219. Erratum in: BMJ. 2022 Apr 25;377:o1045. PMID: 32887691.
排版编辑:guangli











 苏公网安备32059002004080号
苏公网安备32059002004080号


