
中国抗癌协会国际医疗与交流分会, 中国医师协会肿瘤医师分会乳腺癌学组. 人表皮生长因子受体2低表达乳腺癌临床诊疗共识(2022版)[J]. 中华肿瘤杂志, 2022, 44(12):1288-1295.
DOI: 10.3760/cma.j.cn112152-20220914-00623
近年来,人表皮生长因子受体2(HER-2)低表达乳腺癌的治疗成为乳腺癌诊疗的热点问题。随着抗体药物偶联物在HER-2低表达乳腺癌患者疗效的确立,HER-2低表达或成为乳腺癌新的靶向治疗亚型。规范诊疗是保证相关疗效的前提,为了更好地规范HER-2低表达乳腺癌临床合理诊疗,中国抗癌协会国际医疗与交流分会和中国医师协会肿瘤医师分会乳腺癌学组参考国内外最新临床研究以及近年来发表的重要参考文献,结合中国病理科医师和肿瘤科医师的临床经验,经专家组讨论后形成HER-2低表达乳腺癌临床诊疗共识,以期加深临床肿瘤医师对HER-2低表达乳腺癌的认识,推进临床决策的精准化,达到延长患者生存时间和提高生活质量的最终目标。
【关键词】乳腺肿瘤;人表皮生长因子受体2;低表达;抗体偶联药物
2020年全世界约有新发恶性肿瘤1930万例,其中新发女性乳腺癌约230万例(11.7%),乳腺癌成为最常见的恶性肿瘤。乳腺癌也是中国女性中发病率最高的恶性肿瘤,预计2022年约有新发乳腺癌429105例,死亡124002例,且乳腺癌的发病率与死亡率将持续升高。乳腺癌的治疗决策通常基于传统的组织病理结果,临床上乳腺癌主要分为4种预后不同的亚型:Luminal A型、Luminal B型、人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)阳性型和三阴型乳腺癌(triple-negative breast cancer, TNBC)。HER-2是乳腺癌重要的驱动基因和预后指标,也是抗HER-2药物治疗的主要疗效预测指标。在HER-2阳性乳腺癌中,ERBB2基因扩增导致HER-2过度表达,未经抗HER-2治疗的患者,肿瘤侵袭性更强,患者预后更差。目前,针对HER-2的多种靶向药物已经显著改善了早期及晚期HER-2阳性乳腺癌的临床预后。而在乳腺癌中,约45%~55%呈现HER-2低表达状态,即免疫组化(immunohistochemistry, IHC)1+,或IHC 2+且原位杂交(in situ hybridization, ISH)HER-2基因无扩增。随着抗体药物偶联物(antibody-drug conjugate, ADC)在HER-2低表达乳腺癌患者中疗效的确立,新型ADC已然成为HER-2低表达晚期乳腺癌患者新的治疗选择。
HER-2低表达乳腺癌的检测和判定
2018版美国临床肿瘤协会/美国病理学家协会检测指南以及2019版中国乳腺癌HER-2检测指南对IHC染色要求以及IHC和ISH结果判读进行了规范。在本共识中,HER-2 IHC 3+或HER-2 IHC 2+/ISH+定义为HER-2阳性,IHC 1+或IHC 2+/ISH-定义为HER-2低表达,IHC 0定义为HER-2阴性(图1)。
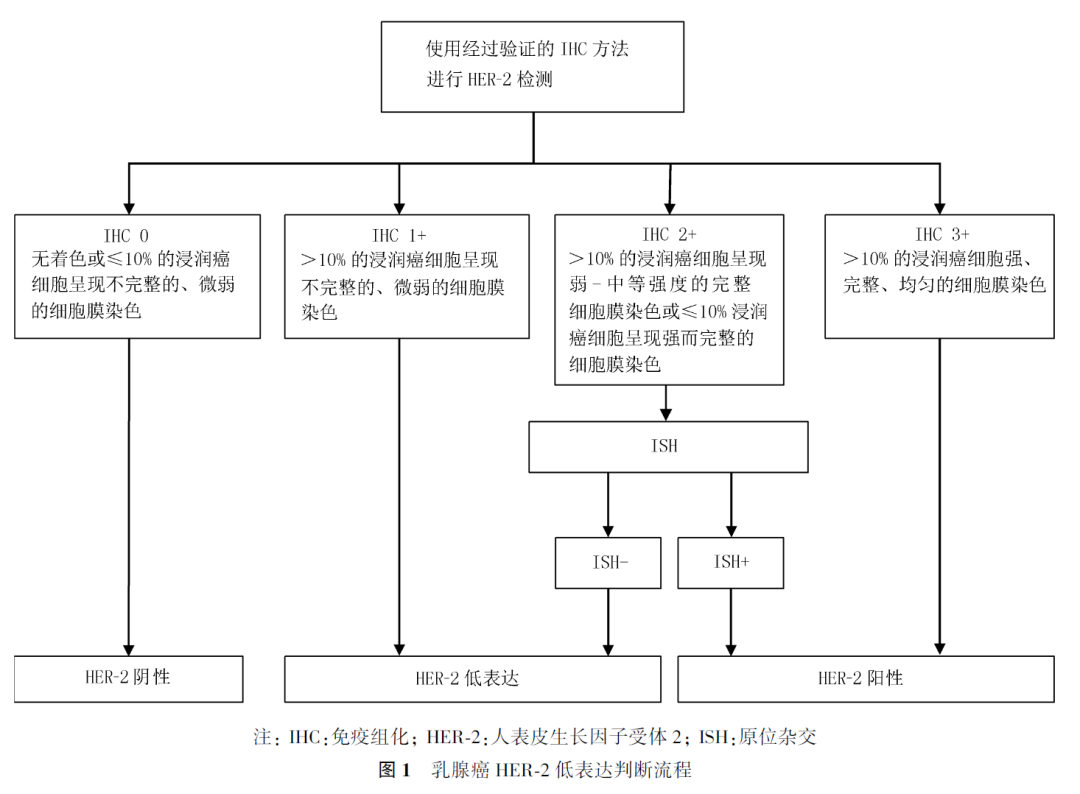
专家意见 1
目前HER-2低表达定义为HER-2 IHC 1+或IHC 2+/ISH-。
专家意见 2
对于既往判断为HER-2 IHC 0的患者,如患者有潜在治疗可能,可考虑重新判读、检测或活检,以明确HER-2状态。
HER-2低表达乳腺癌的临床意义及预后
流行病学数据显示,在HER-2低表达乳腺癌中根据激素受体(hormone receptor, HR)状态进行分层,其中80%为Luminal型,15%~20%为TNBC。HER-2低表达肿瘤通常不存在HER-2基因的扩增,但转化研究显示,HER-2低表达肿瘤可能与HER-2 IHC 0肿瘤在基因表达上存在差异,提示HER-2低表达乳腺癌可能具有独特的分子特征。目前对于HER-2低表达的预后价值尚存争议。多项回顾性分析也对HER-2低表达患者的预后进行了研究,但结果并不一致,提示HER-2低表达尚不能作为一个独立的预后因素。随着新型抗HER-2 ADC药物对HER-2低表达患者展现出的获益,其治疗人群从HER-2阳性进一步拓展为HER-2低表达乳腺癌,因此HER-2低表达有望成为新的乳腺癌治疗类型,但尚不认为HER-2低表达乳腺癌为新的病理分子亚型。
专家意见 3
HER-2低表达已成为晚期乳腺癌中可预测临床疗效的药物选择指标,用于指导临床药物选择。
HER-2低表达晚期乳腺癌的治疗
新一代抗HER-2 ADC药物在HER-2低表达患者中有明确疗效,为HER-2低表达患者提供了更多选择。ADC是一类通过连接子将细胞毒性药物连接到单克隆抗体的靶向生物制剂,旨在将靶向治疗的选择性和细胞毒性药物结合在一起,发挥抗肿瘤活性。ADC由3个主要部分组成:高特异性和亲和力的抗体(载体)、高效的小分子细胞毒药物(有效载荷)和稳定的连接子。目前HER-2低表达乳腺癌领域正在进行的Ⅲ期临床研究见表1。
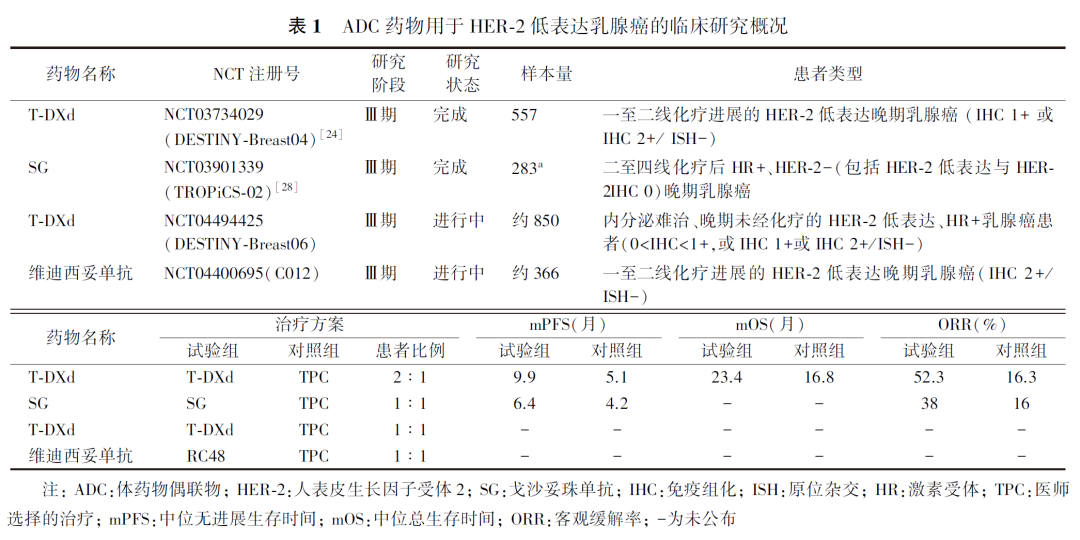
T-DXd是新一代ADC药物,在临床前研究中表现出对于HER-2低表达肿瘤的潜在治疗作用。DESTINY-Breast04研究为首个在HER-2低表达人群中验证T-DXd疗效的Ⅲ期临床试验,该研究纳入了557例既往接受过一线或二线化疗的HER-2低表达不可切除和(或)转移性乳腺癌患者,随机分配到T-DXd组或医师选择的化疗组(如卡培他滨、艾立布林、吉西他滨、紫杉醇或白蛋白-紫杉醇),结果显示,无论患者HR和IHC状态如何,T-DXd治疗组均有获益,全人群中位无进展生存时间(medium progress-free survival, mPFS)分别为9.9和5.1个月,中位总生存时间(medium overall survival, mOS)分别为23.4和16.9个月(HR=0.64)。基于该研究的结果,美国食品药品监督管理局(Food and Drug Administration, FDA)批准T-DXd用于治疗既往在转移阶段接受过至少一线化疗的或在辅助化疗期间或完成辅助化疗之后6个月内复发的不可切除或转移性HER-2低表达(IHC1+或IHC 2+/ISH-)乳腺癌患者。
此外,抗HER-2 ADC维迪西妥单抗(RC48)的Ⅰ期临床研究也展示出对HER-2低表达人群的应用前景。目前正在HER-2 IHC 2+/ISH-晚期乳腺癌患者中进行HER-2低表达晚期乳腺癌的Ⅲ期临床研究,期待研究结果的揭晓和更多的研究数据。由于HER-2低表达相关研究入组的患者均为晚期乳腺癌且接受标准治疗失败的患者,因此HER-2低表达晚期患者的初始治疗仍需按照不同分子分型选择相应的治疗方案。在初始治疗失败后,应基于循证医学证据进行后续治疗方案选择。
专家意见 4
依据T-DXd在HER-2低表达晚期乳腺癌中的确切疗效,其可作为HER-2低表达患者的推荐治疗之一。HER-2低表达患者的初始治疗仍应基于分子分型进行治疗方案的选择。
1. HER-2低表达HR+晚期乳腺癌患者的治疗选择:HR+乳腺癌中,HER-2低表达患者约占55%~65%。HER-2低表达HR+晚期乳腺癌患者一线治疗首选内分泌联合CDK4/6抑制剂。若一线未使用CDK4/6抑制剂,则二线优选内分泌治疗联合CDK4/6抑制剂方案。CDK4/6抑制剂联合内分泌治疗失败后,目前尚无标准治疗方案,通常基于患者的既往治疗方案、肿瘤负荷和生物标志物选择后线治疗方案。二线及后线治疗可考虑内分泌治疗±靶向治疗,如内分泌联合哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)抑制剂依维莫司、组蛋白去乙酰化酶(histone deacetylase, HDAC)抑制剂西达本胺、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)抑制剂阿培利司等;BRCA1/2胚系致病性或疑似致病性突变的患者,可以选择多聚ADP核糖聚合酶(poly ADP-ribose polymerase, PARP)抑制剂奥拉帕利等,或参加临床试验,但目前已报道的内分泌治疗±靶向治疗的研究并未进行HER-2低表达的分层分析。
DESTINY-Breast04研究中,纳入了既往接受过一至二线化疗的HER-2低表达HR+内分泌难治性晚期乳腺癌患者,T-DXd相较于化疗PFS和OS获得显著延长(mPFS为10.1和5.4个月,mOS为23.9和17.5个月),因此,T-DXd为HER-2低表达HR+内分泌难治性晚期乳腺癌患者的推荐治疗方案(图2)。
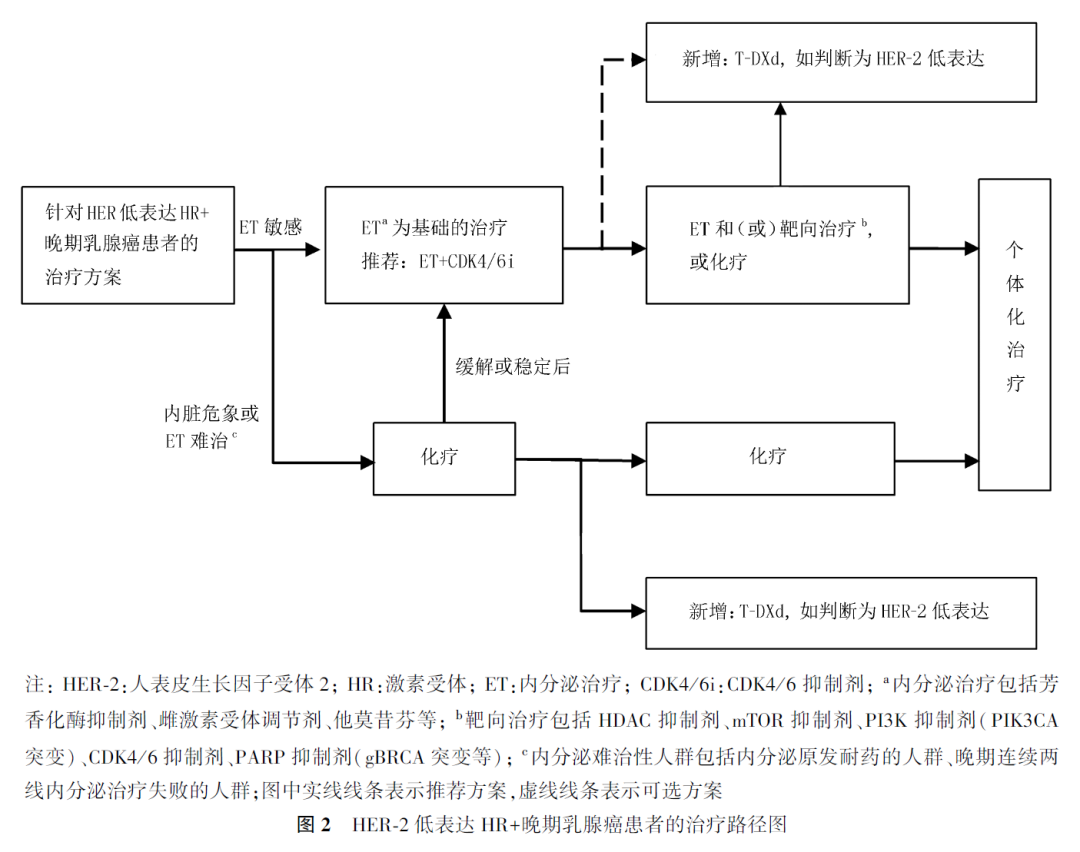
内分泌难治性的定义尚存争议,基于共识组专家投票得出的一致性建议,以下患者考虑作为内分泌难治性的人群:(1)内分泌原发耐药的人群(术后辅助内分泌治疗2年内出现复发转移,或转移性乳腺癌内分泌治疗6个月内出现疾病进展);(2)晚期连续两线内分泌治疗失败的人群(通常亦提示内分泌耐药)。
专家意见 5
对于HER-2低表达HR+不伴内脏危象的晚期乳腺癌患者,一线CDK4/6抑制剂联合内分泌治疗进展后,应基于患者的既往治疗、肿瘤负荷和生物标志物等选择后线治疗方案。
专家意见 6
对于HER-2低表达HR+的内分泌难治性(经内分泌治疗失败或不适合内分泌治疗)且至少接受过1种化疗后的晚期乳腺癌患者,优选T-DXd治疗。
2. HER-2低表达HR-晚期乳腺癌患者的治疗选择:HR-乳腺癌中,HER-2低表达患者约占35%。目前HER-2低表达HR-晚期乳腺癌的治疗可参照TNBC治疗,以化疗为主。对于既往蒽环类新辅助或辅助治疗失败的患者,一线推荐以紫杉类为基础的单药或联合方案,其他可选的药物包括卡培他滨、长春瑞滨、吉西他滨、依托泊苷等,BRCA突变患者可使用铂类或PARP抑制剂治疗。KEYNOTE-355研究中,帕博利珠单抗联合化疗较单纯化疗显著改善了程序性死亡受体配体1(programmed cell death-ligand 1, PD-L1)阳性[综合阳性评分(combined positive score, CPS)≥10分]患者的PFS和OS。因此,对于PD-L1 CPS≥10分的TNBC患者,免疫检查点抑制剂联合化疗可作为推荐的一线方案。
ASCENT研究提示,在既往二线及以上治疗进展的晚期TNBC患者中,戈沙妥珠单抗(sacituzumab govitecan-hzi, SG)对比单药化疗可显著延长PFS和OS。因此,靶向TROP-2 的ADC药物在晚期TNBC后线治疗中可作为推荐方案之一。
对于HER-2低表达HR-患者,DESTINY-Breast04研究亚组分析显示,T-DXd在PFS和OS上均有获益(mPFS为8.5和2.9个月,mOS为18.2和8.3个月),因此,T-DXd可作为一线治疗进展后的推荐方案之一(图3)。
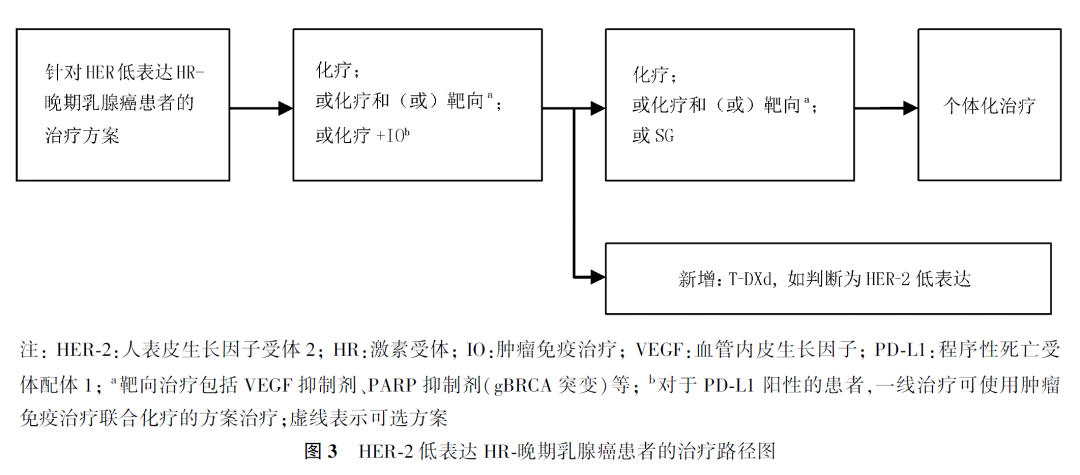
专家意见 7
HER-2低表达HR-晚期乳腺癌的治疗目前参照TNBC治疗,包括化疗、免疫治疗、靶向治疗及SG治疗等。对于一线治疗失败的患者,T-DXd可作为新的推荐方案之一。
总结与展望
由于现阶段HER-2低表达乳腺癌的诊疗数据仍然有限,本共识专家组选取了HER-2低表达临床较为关注的争议问题,结合当前的证据,通过专家组投票的方式获得一致性的临床推荐,为广大临床医师在HER-2低表达临床诊疗中的决策提供支持。
目前HER-2低表达下限的判定仍存在争议。DAISY研究结果提示,T-DXd对部分HER-2 IHC 0患者具有一定疗效,最佳客观缓解率为29.7%,因此IHC 0人群将进一步分为HER-2超低表达(0<IHC<1+)和HER-2 0表达。同时,正在进行的Ⅲ期DESTINIT-Breast06研究拟探索T-DXd在HER-2低表达和超低表达、HR+晚期乳腺癌患者(内分泌难治且尚未接受化疗)中的疗效和安全性,这将为HER-2超低表达乳腺癌的提供更多诊疗数据。
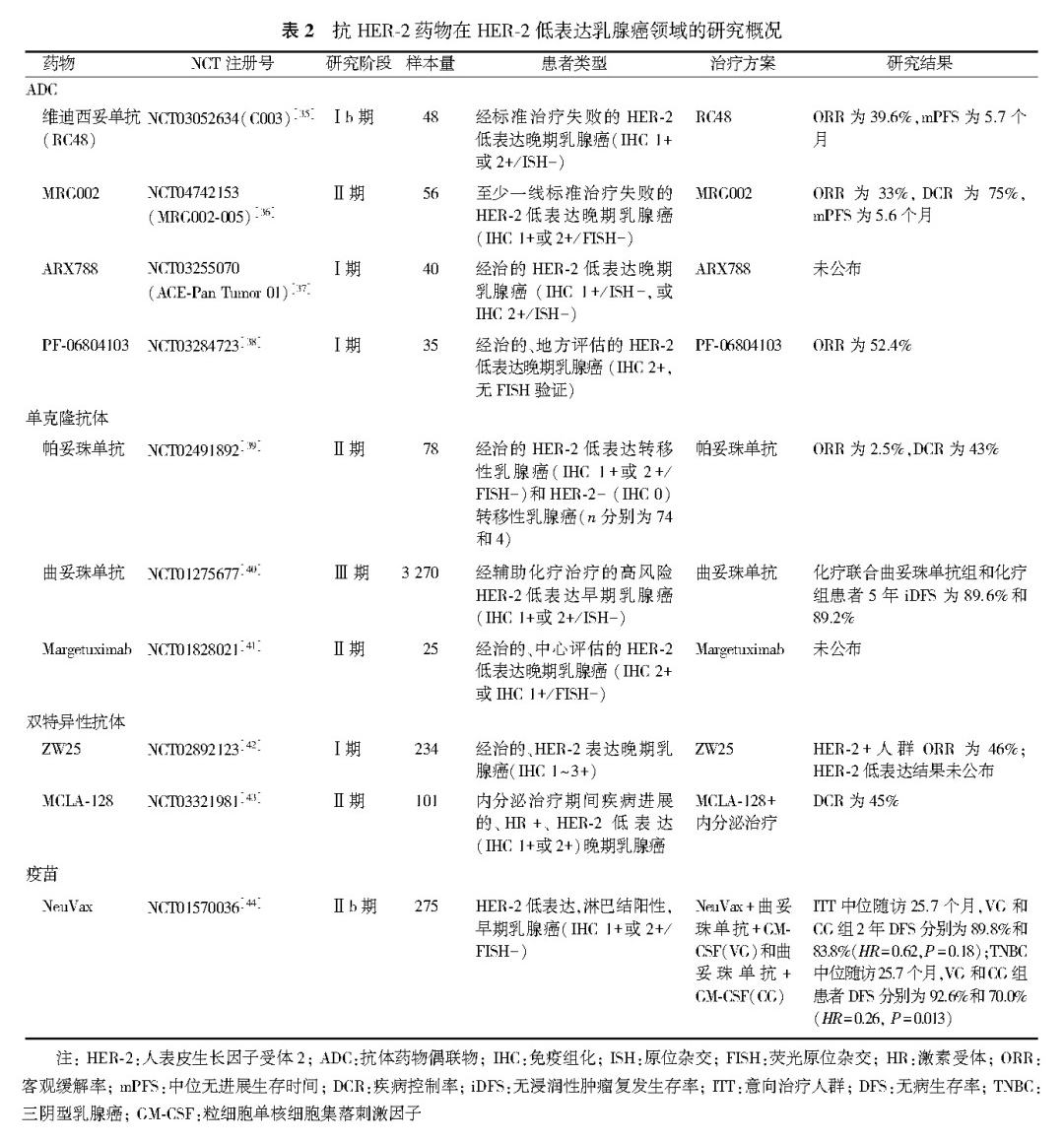
近期报道的TROPiCS-02研究显示,在既往内分泌、CDK4/6抑制剂及二至四线化疗失败后的HR+HER-2-晚期乳腺癌患者中,与医师选择的治疗相比,SG可显著延长患者PFS和OS;亚组分析显示,SG改善HER-2低表达和HER-2 IHC 0亚组患者的疗效结局与意向治疗人群一致。其他抗HER-2药物(包括ADC、单克隆抗体、疫苗、双抗等)也陆续在HER-2低表达领域进行尝试(表2)。期待这些药物为HER-2低表达乳腺癌患者带来更多的治疗选择。
本文为提前在线版本,如有不一致之处,以正式发表版本为准。出版日为每月23日,网站和数据库更新有时间差,欢迎正式出版后下载原文:
1. 机构用户IP:中华医学期刊全文数据库(http://www.yiigle.com/)右上角IP登录,正常检索/查看/下载即可
2. 个人帐号:绑定中华医学期刊机构用户后,直接登录本刊官网(http://www.chinjoncol.com/)检索/查看/下载全文(通过万方、知网检索也将跳转至本刊官网)
3. 年卡或单期购买用户:详询中华医学期刊网会员服务
4. 纸质版期刊订阅:中国邮政网上营业厅(https://11185.cn/)检索“中华肿瘤杂志”在线订购,或到全国各地邮局订阅,邮发代号2-47。需提前预定。

免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


