近年来,随着新药或新治疗方案不断涌现,淋巴瘤的远期生存得到明显的提高。为了使淋巴瘤专科医生及时、快速和高效地掌握淋巴瘤领域最关键的新进展,【肿瘤资讯】特邀中山大学附属肿瘤医院黄慧强教授淋巴瘤团队重磅推出【黄慧强 | 淋巴瘤】专栏,欢迎订阅。每月1期,慧强教授与您不见不散!

中山大学附属肿瘤医院大内科副主任
现任中国老年健康协会淋巴瘤专业委员会主任委员
中国CSCO抗淋巴瘤联盟副主席
中国抗癌协会淋巴瘤专业委员会常委
中国抗癌协会淋巴瘤专业委员会青年委员会主委
广东省抗癌协会血液肿瘤专业委员会主任委员
CSCO甲状腺癌专家组组长
NO.1《柳叶刀·肿瘤学》(Lancet Oncology)Polatuzumab vedotin联合免疫化疗治疗初诊弥漫性大B细胞淋巴瘤的一项开放性非随机1b-2期临床研究
Herve Tilly,et al. (Centre Henri Becquerel, University of Rouen, Rouen, France)
背景
Polatuzumab vedotin是一种靶向B细胞受体中的CD79b的抗体-药物偶联物,已被证实在复发性或难治性弥漫性大B细胞淋巴瘤中作为单药或与利妥昔单抗联合均具有抗肿瘤活性。在本研究中,我们对Polatuzumab vedotin联合利妥昔单抗或奥比妥单抗和环磷酰胺、阿霉素和泼尼松(CHP)用于初诊的弥漫性大B细胞淋巴瘤的安全性和初步活性进行评估。
方法
研究人员在美国和法国的11个医疗中心开展一开放性的非随机研究,包括1b期剂量递增实验和2期扩增实验,招募年满18岁的B细胞非霍奇金淋巴瘤患者。1b期剂量递增实验为“3+3”设计,意在确定推荐的2期剂量。2期扩展实验评估推荐剂量的Polatuzumab vedotin用于新确诊的弥漫性大B细胞淋巴瘤患者的疗效和安全性。患者予以Polatuzumab vedotin+R-CHP(利妥昔单抗、环磷酰胺、阿霉素和泼尼松)或Polatuzumab vedotin+G(奥比妥单抗)-CHP。1b期Polatuzumab vedotin剂量为1.0-2.4mg/kg,前两个疗程的第2天和随后每疗程的第1天给药,21天一疗程,持续治疗6或8个疗程。主要评估指标是安全性和耐受性,并明确Polatuzumab vedotin的最大耐受剂量。
结果
2013年12月4日至2016年7月26日,共招募了85位患者,其中82位被纳入安全性和疗效评估人群,1b期25人,2期57人。在R-CHP队列,2期推荐剂量为1.8mg/kg(未尝试过更高剂量)。66位新确诊的弥漫性大B细胞淋巴瘤患者接受2期推荐剂量的Polatuzumab vedotin治疗(45位在R-CHP队列,21位在G-CHP队列)。对于这66位患者,最常见的3级及以上副反应为中性粒细胞减少(20例[30%])、发热性中性粒细胞减少(12[18%])和血小板减少(6[9%])。在70位接受2期推荐剂量的Polatuzumab vedotin治疗的患者中,发生外周神经病变的有19位(27%)1级,8例(11%)2级,2例(3%)3级。随访期间,4位患者死亡:2例与治疗相关(1例房颤并发症、1例感染性休克),2例为病程进展。截止2017年12月29日,采用2期推荐剂量Polatuzumab vedotin治疗的既往未治疗过的患者中位随访时间达到21.5个月(IQR 16.7-24.3)。59位(89%)患者获得总体缓解(51位[77%]为完全缓解,8例[12%]为部分缓解)。
结论
Polatuzumab vedotin与R-CHP或G-CHP联合治疗弥漫性大B细胞淋巴瘤的安全性较高,而且初步疗效较好,有望进行3期试验进一步评估。
Lancet Oncol 2019. doi:10.1016/S1470-2045(19)30091-9. Epub 2019 May 14.
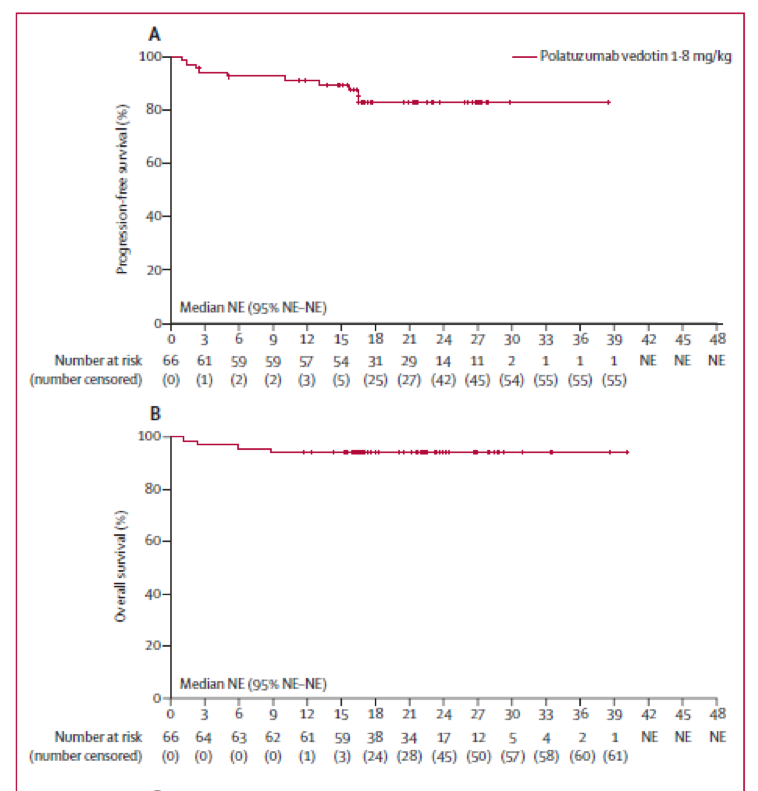
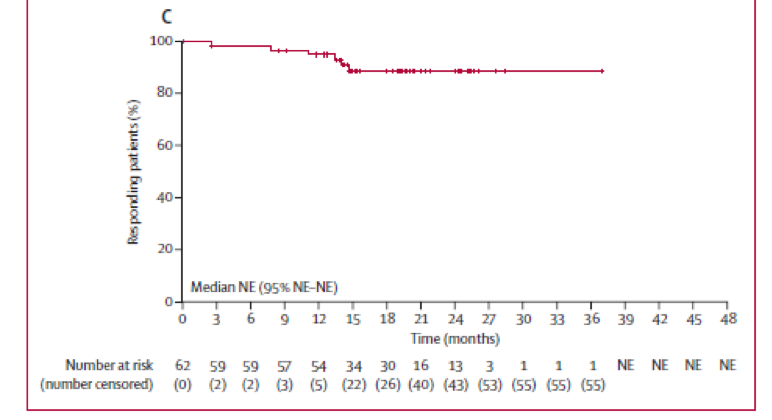
图 Polatuzumab vedotin(1.8mg/Kg)联合免疫化疗(R-CHP或G-CHP)治疗初诊弥漫性大B细胞淋巴瘤的无进展生存(A),总生存(B)及缓解持续时间(C)
NO.2《临床肿瘤学杂志》(Journal of Clinical Oncology)AUGMENT Ⅲ期临床研究:来那度胺联合利妥昔单抗对比安慰剂+利妥昔单抗治疗复发/难治惰性淋巴瘤
John P. Leonard et al. (Weill Cornell Medicine and New York Presbyterian Hospital)
目的
惰性非霍奇金淋巴瘤患者往往对一线免疫化疗反应较好。对于复发患者,普遍采用利妥昔单抗单药治疗。数据显示免疫调节剂来那度胺能提高利妥昔单抗的活性。
方法
本研究为多中心、随机、Ⅲ期临床研究,使用来那度胺联合利妥昔单抗对比安慰剂+利妥昔单抗,治疗复发和/或难治滤泡型淋巴瘤或边缘区淋巴瘤。患者接受12个周期来那度胺或安慰剂,并于第1周期每周一次、第2-5周期第一天接受利妥昔单抗治疗。主要研究终点为每次独立影像学评估的无进展生存率。
结果
总计358例患者被随机分配至来那度胺+利妥昔单抗组(n = 178)或安慰剂+利妥昔单抗组(n = 180)。来那度胺+利妥昔单抗组发生感染(63% v 49%)、中性粒细胞减少(58% v 23%)和皮肤不良反应(32% v 12%)更常见,3或4级中性粒细胞减少(50% v 13%)和白细胞减少(7% v 2%)比例更高,其他3或4级不良事件的组间差异均未超过5%。对比安慰剂+利妥昔单抗组,来那度胺+利妥昔单抗组的无进展生存显著提高(HR, 0.46; 95% CI, 0.34-0.62; P<0.001),中位无进展生存期分别为39.4个月(95% CI, 22.9-未达)和14.1个月(95% CI, 11.4-16.7)。
结论
来那度胺明显提高了利妥昔单抗治疗复发/难治惰性淋巴瘤的疗效,安全性可控。
J Clin Oncol. 2019 May 10;37(14):1188-1199. doi: 10.1200/JCO.19.00010. Epub 2019 Mar 21.
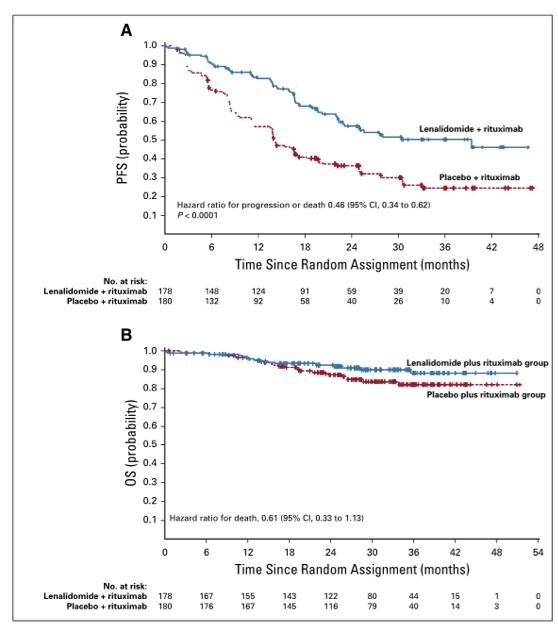
图2 无进展生存(A)、总生存(B)对比
表3 治疗相关不良事件

(张宇辰翻译 刘盼盼审校)
NO.3《临床肿瘤学杂志》(Journal of Clinical Oncology)CheckMate 205 II期临床研究:Nivolumab治疗初治进展期经典型霍奇金淋巴瘤的安全性和疗效评价研究
Ramchandren et al. (University of Tennessee and Hospital Duran i Reynals, Barcelona, Spain.)
目的
Nivolumab是一种抗PD-1的单克隆抗体,已在复发/难治性经典霍奇金淋巴瘤(cHL)中表现出普遍和持久的疗效。我们报告来自CheckMate 205实验的队列D的研究结果,该试验评估了nivolumab单药治疗,序贯nivolumab联合多柔比星,长春碱和达卡巴嗪(N-AVD)用于新诊断的cHL。
方法
患有未治疗的晚期(定义为III至IV和具有不利风险因素的IIB)的18岁及以上的cHL患者纳入该多中心,非比较性II期试验的队列D研究。入组患者接受nivolumab单药治疗4疗程,序贯12疗程N-AVD,每2周为1疗程,nivolumab以240mg静脉内给药。主要研究终点是安全性。疗效终点包括客观反应率(ORR)和修正的无进展生存期(mPFS)。mPFS定义为疾病进展/复发,死亡或至下一次治疗的时间。在可评估患者的霍奇金Reed-Sternberg细胞中评价染色体9p24.1改变和PD-L1表达。
结果
共招募和治疗了51名患者。在诊断时,49%的患者的国际预后评分为3或更高。总体而言,59%经历了3至4级治疗相关的不良事件。10%的患者报告了与治疗相关的发热性中性粒细胞减少症。内分泌免疫介导的不良事件均为1级至2级,不需要高剂量皮质类固醇;所有非内分泌免疫介导的不良事件均得到解决(最常见的是皮疹:5.9%)。在治疗结束时,每个独立放射学审查委员会的客观反应率(95%CI)为84%(71%至93%);67%(52%至79%)的患者达到完全缓解,5名患者(10%)未做评价并被视为无响应者。最低随访时间为9.4个月,9个月的无进展生存率为92%。在霍奇金Reed-Sternberg细胞中具有较高水平的PD-L1表达的患者对后续的N-AVD治疗具有更有利的有效率(P =0.041)。
结论
Nivolumab序贯N-AVD治疗初治晚期cHL疗效令人鼓舞,安全性好。
J Clin Oncol 37. DOI: 10.1200/JCO.19.00315. Epub 2019 May 21.
图1 (A)每个独立放射学审查委员会(IRC)和研究者在2007年底评价患者在单药治疗,两次联合循环后,治疗结束时的客观反应率(ORR)。 患者总数为51.(B)在治疗结束时,患者中每个IRC的靶病变。
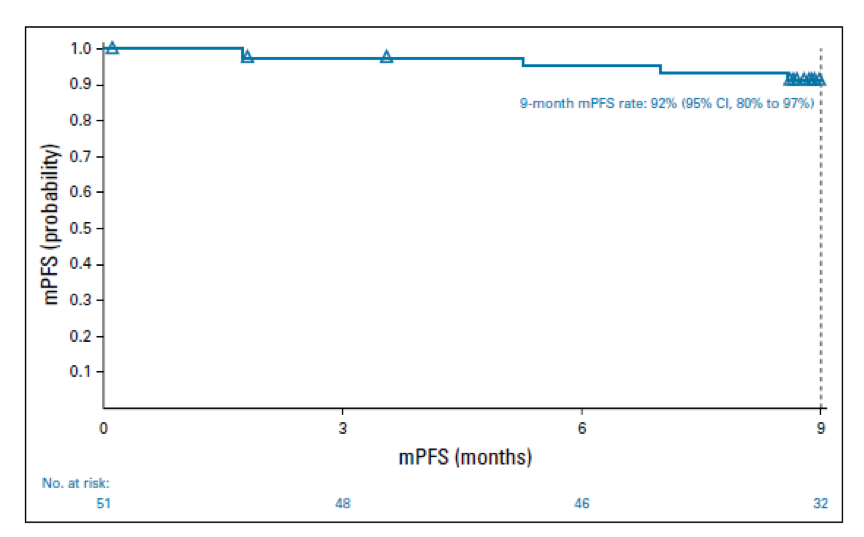
图2 mPFS/独立放射学评论委员会。 mPFS定义为疾病进展,死亡,或下一个治疗的时间,无论对治疗是否应答。
NO.4.《临床肿瘤学杂志》(Journal of Clinical Oncology)Duvelisib (IPI-145)治疗难治性惰性非霍奇金淋巴瘤:DYNAMO II期临床研究的结果
Ian W. Flinn et al (Sarah Cannon Research Institute, Nashville,TN,USA)
目的
惰性非霍奇金淋巴瘤(iNHL)在很大程度上仍然是不可治愈的,对标准治疗耐药的难治性患者往往需要多线治疗。 Duvelisib已经被美国食品和药物管理局(FDA)批准用于使用过2种及以上系统治疗的复发/难治性(RR)慢性淋巴细胞白血病或小淋巴细胞淋巴瘤(SLL),以及RR滤泡性淋巴瘤(FL)。Duvelisib是首个口服的磷酸肌醇3激酶-δ,-γ抑制剂,基于它在复发难治非霍奇金淋巴瘤的I期临床研究中表现出来的生物活性,本研究旨在评估duvelisib单药应用于rituximab耐药或放化疗无效的iNHL的安全性和有效性。
研究对象及研究方法
入组标准为具有可评价病灶,且对rituximab(单药或联合用药)及放/化疗治疗无效的iNHL患者(FL,SLL或边缘区B细胞淋巴瘤)。 所有患者均给予每天两次口服duvelisib 25 mg治疗,28天一疗程,直到出现病程进展、不可耐受的毒性或死亡。 主要研究终点是使用修订的国际工作组恶性淋巴瘤标准评估的ORR(客观缓解率)。
结果
该开放、全球多中心II期临床试验选入了129名患者(中位年龄65岁;中位治疗方案数为3),ORR为47.3%(SLL,67.9%; FL,42.2%; MZL,38.9%)。 中位缓解持续时间(DOR)为10个月,中位无进展生存期(PFS)为9.5个月。 最常见的治疗相关不良事件(TEAE)是腹泻(48.8%),恶心(29.5%),中性粒细胞减少(28.7%),疲劳(27.9%)和咳嗽(27.1%)。88.4%的患者出现至少3级或更高的TEAE,其中最常见的TEAEs是中性粒细胞减少症(24.8%),腹泻(14.7%),贫血(14.7%)和血小板减少症(11.6%)。
结论
DYNAMO研究结果显示,对于多次治疗且rituximab+放/化疗均无效的iNHL患者,口服duvelisib单药治疗有效和安全性可控,结果与先前的观察结果一致。 对于老年患者及需要更多治疗方法的患者,Duvelisib提供了一个新的口服治疗选择。
J Clin Oncol. 2019 April 10, 37:912-922. Doi:10. 1200/JCO.18.00915. Epub 2019 Feb 11
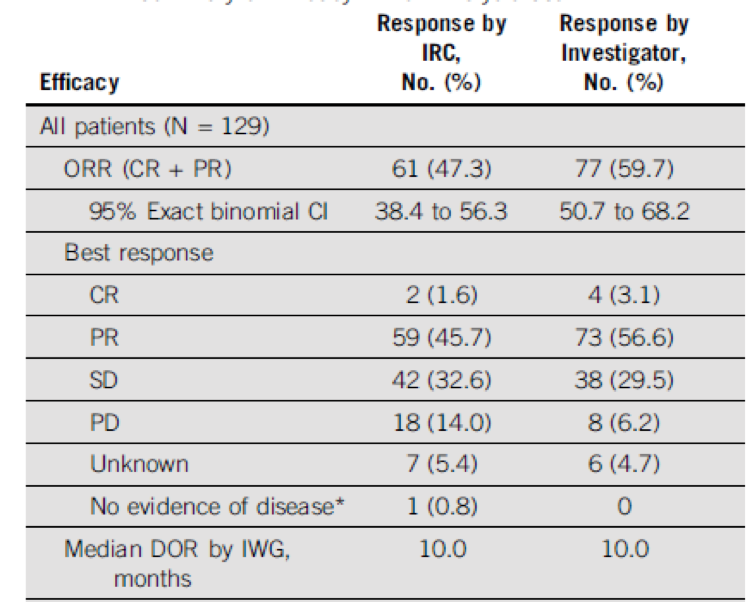
图2 整体有效率
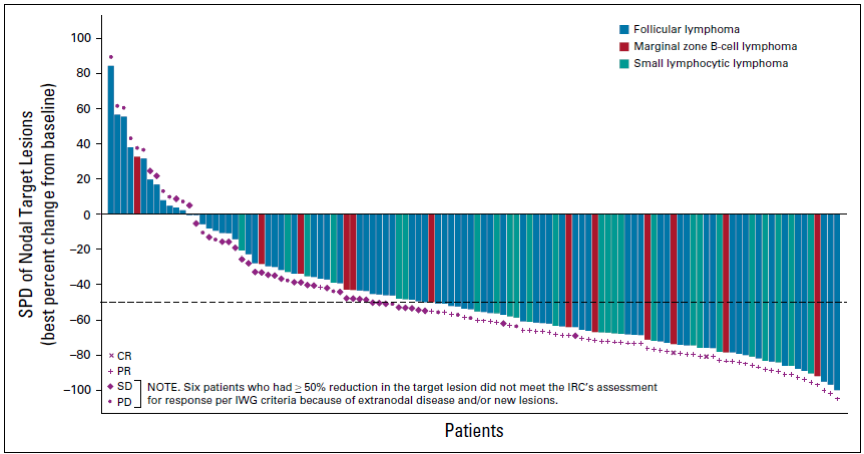
图3 瀑布图
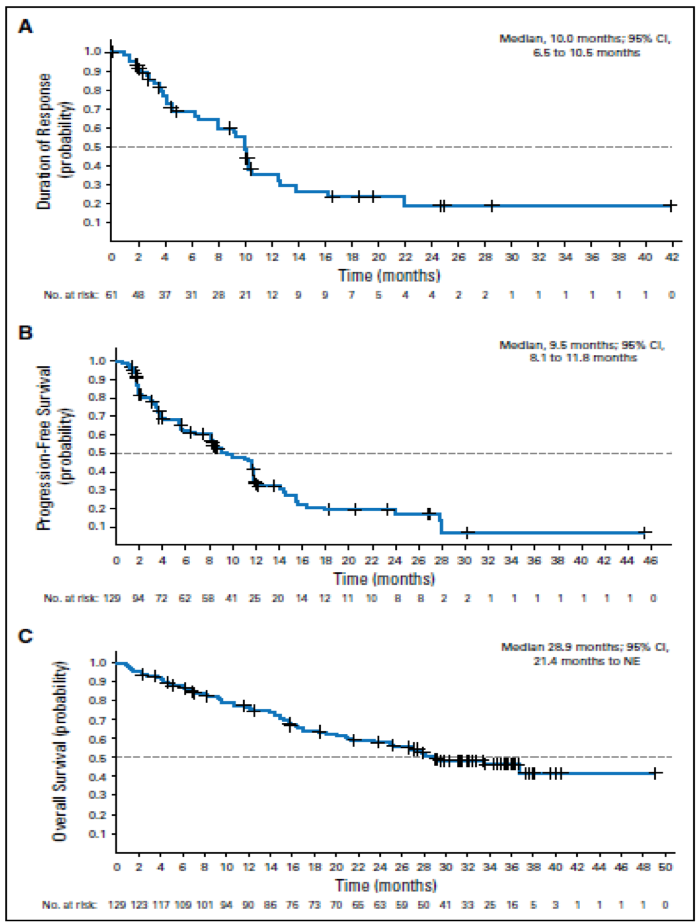
图4 DOR、PFS和OS情况
NO.5. 《临床肿瘤学杂志》(Journal of Clinical Oncology)伊布替尼联合R-CHOP方案在弥漫性大B细胞淋巴瘤non-GCB亚型中的随机、III期临床研究
Anas Younes et al. (Memorial Sloan Kettering Cancer Center, New York, NY)
目的
伊布替尼在弥漫性大B细胞淋巴瘤(DLBCL)non-GCB亚型中显示出不错的疗效。本项双盲III期临床研究旨在评估伊布替尼和利妥昔单抗联合环磷酰胺、阿霉素、长春新碱和泼尼松(R-CHOP)在初治DLBCL non-GCB亚型中的疗效。
患者和方法
患者按照1:1的比例被随机分为伊布替尼(560毫克/天,口服)加R-CHOP组,或安慰剂加R-CHOP组。主要终点是意向性治疗人群以及ABC亚型患者的无事件生存率(EFS)。次要研究终点包括无进展生存(PFS),整体生存(OS)和安全性。
结果
共有838例患者随机分配到伊布替尼+RCHOP组(n=419)或安慰剂+R-CHOP组(n=419)。中位年龄为62.0岁;75.9%的可评估患者为ABC亚型。两组患者基线特征无明显差异。伊布替尼+R-CHOP并没有提高ITT(HR,0.934)或ABC(HR,0.949)患者中的EFS。一项早先的研究表明,年龄与治疗之间存在着显著的相互作用。在60岁以下的患者中,伊布替尼联合R-CHOP改善了EFS(HR,0.579),PFS(HR,0.556)和OS(HR,0.330),并仅轻微地增加了严重不良事件发生率(35.7% v 28.6%),但接受至少6个R-CHOP周期的患者在治疗组间的比例相似(92.9% v 93.0%)。在60岁或60岁以上的患者中,伊布替尼加R-CHOP组EFS、PFS和OS更差,加重了不良事件发生率(63.4% v 38.2%),并且接受至少6个周期R-CHOP的患者的比例减少(73.7% v 88.8%)。
结论
本研究未达到ITT或ABC人群的主要终点。然而,年龄60岁以下的患者中,伊布替尼加上R-CHOP改善了EFS、PFS和OS,并具有可控的安全性。在年龄在60岁或以上的患者中,伊鲁替尼+R-CHOP增加了毒性,导致了R-CHOP方案的耐受变差以及预后不良。有必要开展进一步的研究。
J Clin Oncol. 2019 May 20;37(15):1285-1295. doi:10.1200/JCO.18.02403. Epub 2019 Mar 22
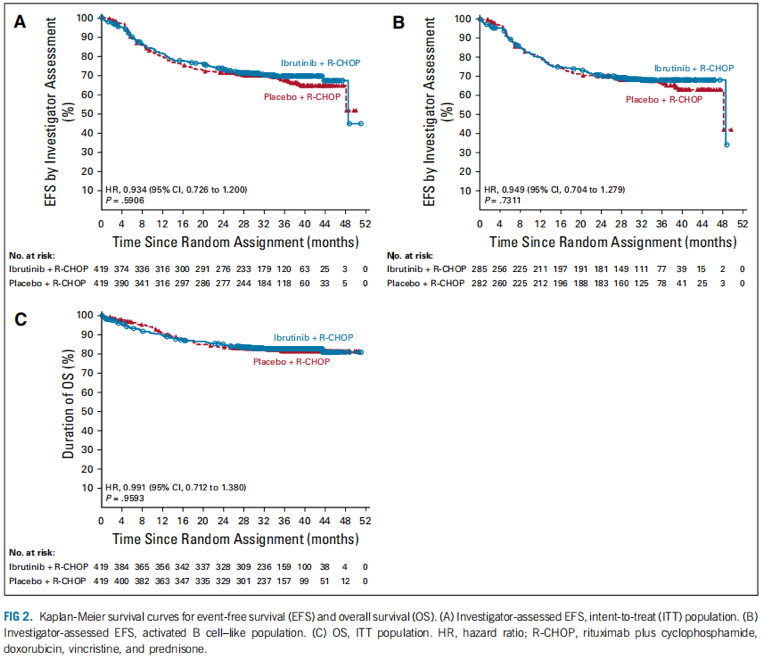
图2 无事件生存率(EFS)和总体生存率(OS)的K-M生存曲线。(A)研究者评估EFS,意图治疗(ITT)人群。(B)研究者评估EFS,ABC亚型人群。(C)OS、ITT人群。HR,危险比;R-CHOP,利妥昔单抗+环磷酰胺,阿霉素,长春新碱和强的松。
NO.6《血液》(Blood)伊布替尼对比奥法木单抗的Ⅲ期临床研究RESONATE™的远期随访结果
John C. Byrd et al. (The Ohio State University Comprehensive Cancer Center)
摘要
伊布替尼是一种每日口服一次的Bruton’s酪氨酸激酶抑制剂,极大提升了慢性淋巴细胞性白血病(CLL)患者的预后。Ⅲ期临床研究RESONATETM对比了伊布替尼单药和奥法木单抗单药治疗高危、复发CLL患者的疗效,为伊布替尼在美国和欧洲的批准提供了支持。本研究分析了RESONATE研究人群的远期随访结果,观察到持续存在的更优无进展生存(PFS)(HR 0.133; 95% CI, 0.099-0.178),总生存获益继续存在(HR 0.591; 95% CI, 0.378-0.926),但与奥法木单抗组患者交叉至伊布替尼组前观察到的幅度有所减小(HR 0.426; 95% CI, 0.220-0.823)。值得注意的是,患者对伊布替尼的总有效率随时间推移而增加,对91%的患者有效。伊布替尼组的PFS获益与基线风险因素无关,但对比先前接受过<2线治疗的患者,接受过≥2线治疗的患者PFS较短,存在TP53或SF3B1基因突变也表现出更短PFS的趋势。伊布替尼组的中位PFS为41个月,其中46%的患者仍在治疗中,中位PFS为44个月。3级及以上不良事件发生率随时间推移总体下降,仅导致小部分患者因此终止治疗。伊布替尼组中有27%的患者因疾病进展终止治疗。本研究结果为伊布替尼治疗复发/难治CLL的疗效持续性和安全性提供了支持数据,当研究中某种治疗方案已明确表现出更好获益时,研究规定应允许患者交叉至该组。临床研究编号NCT01578707。
Blood. 2019 May 9;133(19):2031-2042. doi: 10.1182/blood-2018-08-870238. Epub 2019 Mar 6.
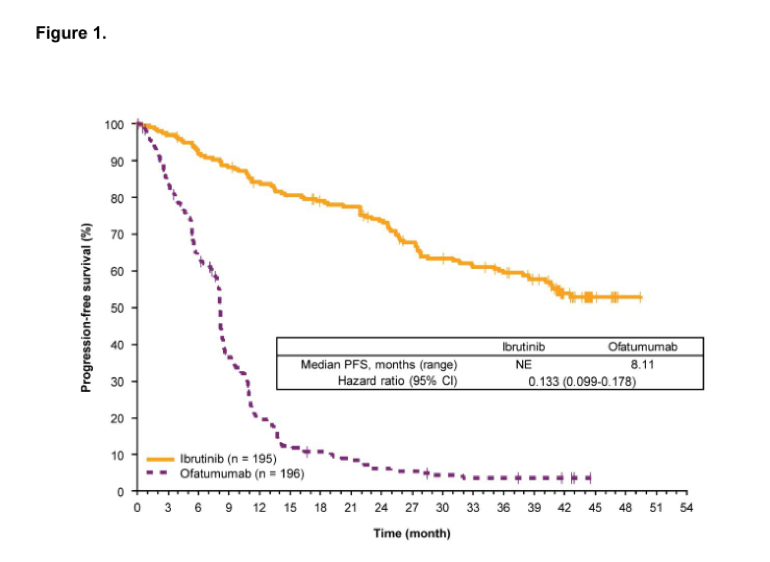
图1 无进展生存对比
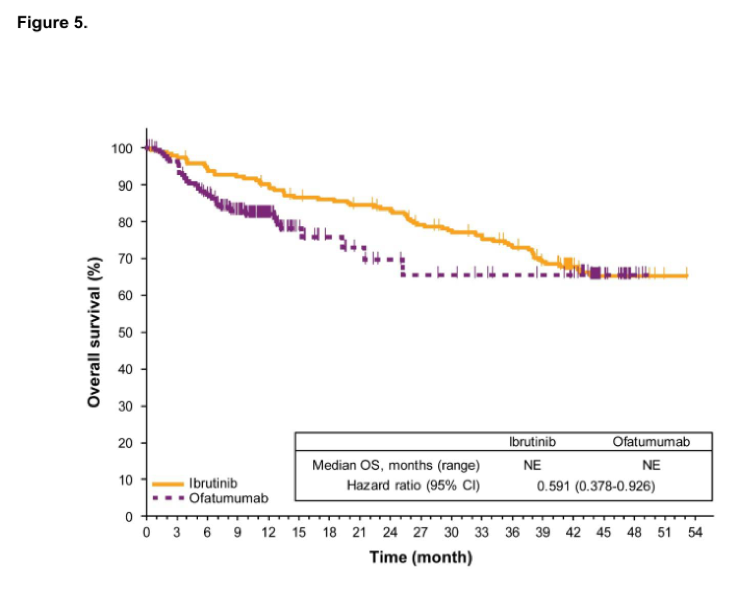
图5 总生存对比
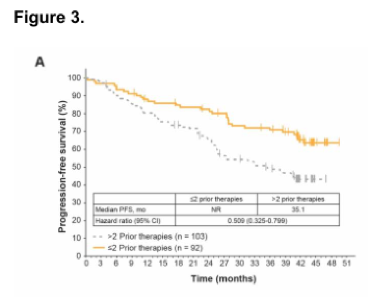
图3A PFS对比:≥2线先前治疗 vs <2线
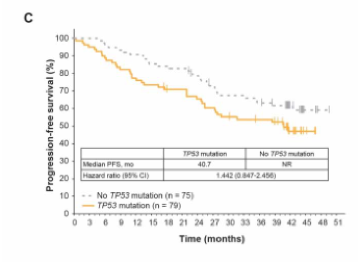
图C PFS对比:TP53基因突变情况
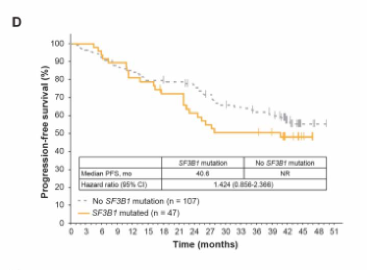
图D PFS对比:SF3B1基因突变情况
NO.7《Eur J Nucl Med Mol Imaging杂志》中期PET对弥漫性大B细胞淋巴瘤的预测价值:一项系统综述和荟萃分析
目的
弥漫性大B细胞淋巴瘤(DLBCL)是非霍奇金淋巴瘤的一种最常见的亚型。大多数复发发生在诊断后的前2年内。利用18F-FDG PET进行早期疗效评估或可尽早调整治疗方案,从而防止无效治疗和不必要的副作用。本文目的在于评价视觉评估的中期18F-FDG PET在一线免疫化疗治疗的DLBCL患者中无进展生存(PFS)或无事件生存(EFS)的预测价值。
方法
在Pubmed、Embase和Cochrane Library进行了检索以用于系统回顾和meta分析,时间截止至2017年7月11日。根据中期PET结果没有治疗适应的调查定性中期PET疗效评估的前瞻性和回顾性研究都被纳入。主要终点是两年PFS或EFS。预后和诊断措施分别利用合并风险比和分层sROC曲线来进行提取和分析。采用meta回归研究协变量效应。
结果
包含2255例患者的18项研究中合并危险比为3.13(95%可信区间为2.52– 3.89),95%预测区间为1.68-5.83。在对2366例患者进行的19项研究中,对于缓慢进展的阴性预测值超过80%(64-95),但敏感性(33-87)、特异性(49-94)和阳性预测值(20-74)分布较宽。
结论
本研究表明中期18F-FDG PET对DLBCL患者有预测价值。然而由于缺乏完整资料和样本量小而影响亚组分析。部分临床试验结果不够令人满意,因此,在临床建立一种成功的风险分层方法之前,仍需进一步提高中期PETCT阳性预测值水平。
Eur J Nucl Med Mol Imaging. 2019 Jan;46(1):65-79. doi: 10.1007/s00259-018-4103-3. Epub 2018 Aug 23
表3 研究结果,预后和诊断信息
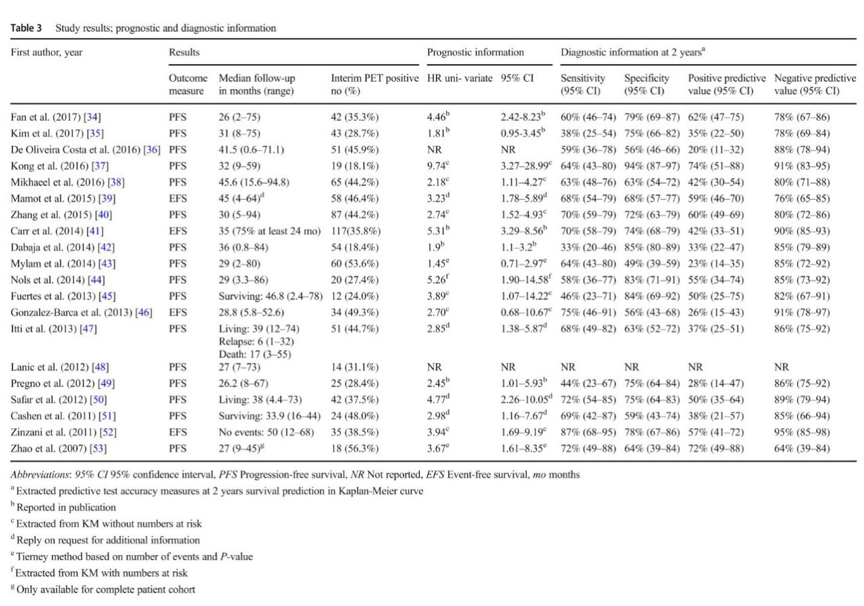
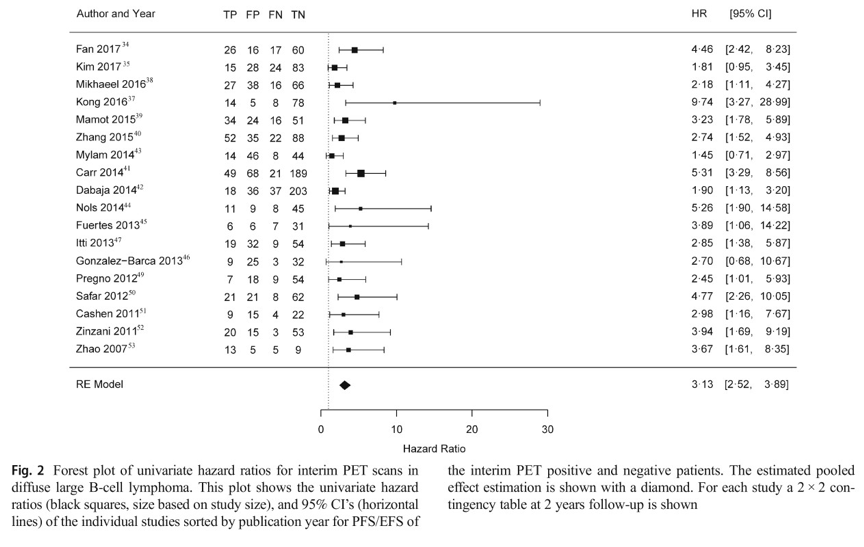
图2 单变量风险比森林图
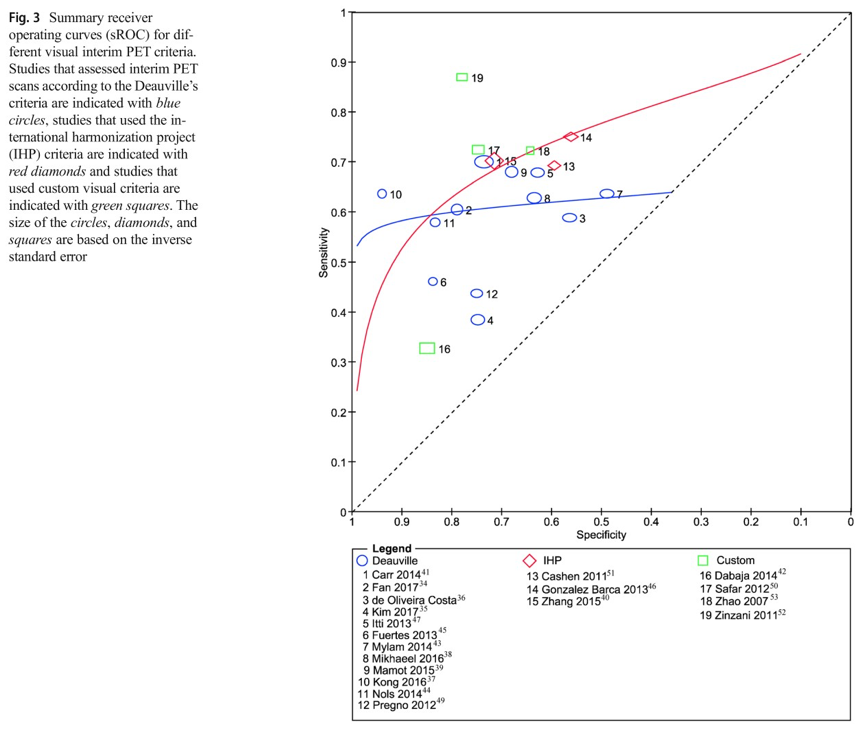
图3 sROC曲线
鸣谢:特别感谢刘盼盼教授的鼎力支持!














 苏公网安备32059002004080号
苏公网安备32059002004080号


