随着精准医学理念和技术的不断推进,肿瘤异质性的概念不断深入人心,很大程度上解释了肿瘤治疗过程中的“耐药”现象。外科手术作为大部分肿瘤综合治疗中的重要一环,以切除癌灶,治疗疾病为目的。尽管也存在相关手术并发症,但无“手术耐药”即“耐刀”一说。目前正统观点认为一旦手术适应证明确,无手术禁忌时,外科手术刀必将“无往不利”。但不管是临床观察还是基础研究均发现“部分患者”在术后早期即出现癌症复发转移。就因果逻辑,让临床医生和患者都在思考手术是不是也是把双刃剑,在治愈大部分患者的同时,促进了特定人群肿瘤的复发和转移。基于此“荷论”对“外科手术是否促进肿瘤转移?”这一问题进行了讨论。本文对会议内容做一概述,同时结合作者的一点思考,尝试对这一问题的焦点与共识做一小结。

浙江大学医学院附属邵逸夫医院肿瘤外科 副主任医师
耶鲁大学与浙江大学联合培养肿瘤学博士,耶鲁大学博士后,剑桥大学附属阿登布鲁克医院访问学者,伦敦圣乔治大学附属医院访问学者
临床方面严格按照循证原则,擅长乳腺,甲状腺,胃肠道肿瘤等常见实体瘤的个体化精准治疗。包括乳腺良恶性肿瘤微创活检,保乳根治术,改良根治术,前哨淋巴结活检,各种乳房重建术,以及乳腺癌综合诊治,甲状腺良恶性疾病的微创治疗。基础研究方面主要围绕乳腺癌内分泌耐药机制及逆转策略,乳腺癌癌前病变开展转化医学研究。
浙江省卫生高层次人才培养对象(医坛新秀)( 2020年),浙江大学郑树医学精英奖学金获得者( 2019年),浙江大学医学院附属邵逸夫医院优青培育人才项目( 2018年),首届中国临床肿瘤学会(CSCO)“35 under 35”青年潜力肿瘤医生称号获得者( 2017年)。
主持和主参与国家自然科学基金课题5项,科技部支撑项目1项及浙江省自然基金项目多项。已发表SCI论文30余篇,包括PNAS, Nature Communications, Nucleic Acids Research,Journal of Hematology & Oncology, Oncogene, EMBO Molecular Medicine等国际知名杂志,被他人引用次数超1700次, H-Index 17 。


尽管限于伦理原因,临床上无法直接对比手术和不手术两组癌症患者的预后情况(根治性手术),但基础研究领域完全可以“脑洞大开”地开展此类研究。2018年Robert Weinberg教授团队的研究结果再次将人们的目光重新拉回到“外科手术是否促进肿瘤转移?”这个从外科手术诞生伊始,一直困扰外科医生的问题上。Robert Weinberg教授的研究结果发现外科手术所导致的系统反应能诱发乳腺癌远处转移(处于免疫监控下的冬眠肿瘤细胞的生长)。

若“外科手术促进肿瘤转移”这一命题确实成立,对外科医生而言无疑是一个悲伤的故事。回顾或长或短的外科职业生涯,大部分医生在临床中都会碰到部分患者接受手术治疗后,短期内即出现肿瘤报复性生长转移的例子。更令人悲伤的事实是,这样的例子并不罕见!如上个世纪即有此类临床现象的零星报道。由于当代科研机制和医疗体制的问题,这样的临床结果很难在主流期刊杂志和媒体发表。

Robert Weinberg教授的上述结果发表后引起业内大讨论。具有代表性的意见是来自著名的纪念斯隆凯瑟琳癌症中心的Julie Grisham教授的观点。他认为早在19世纪(外科手术用于乳腺癌治疗之前),来自英国伦敦的观察研究已明确告诉我们,乳腺癌患确诊后若不接受手术治疗,会几个月或几年后,最终因为癌症死亡。Julie Grisham教授外科手术仍然是乳腺癌治疗的基石,是预防转移的最重要的方法。
但是随着放疗和系统治疗的迅猛发展,化疗,靶向治疗,内分泌治疗等药物层出不穷。当时不接受手术的乳腺癌患者,匹配现有的综合治疗措施,结果又会如何?
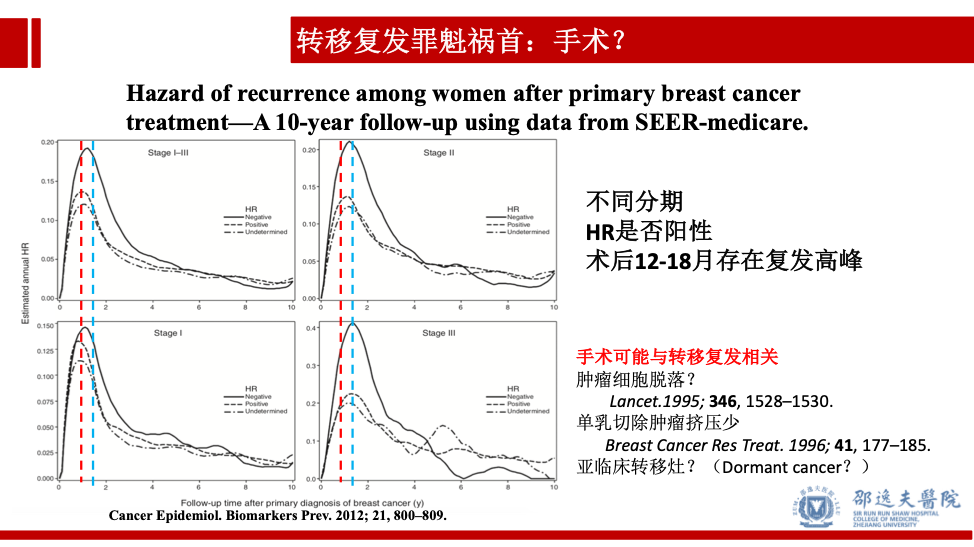
乳腺癌根治性手术的数据来看,基于SEERdata的真实世界研究结果(患者术后接受辅助化疗和内分泌治疗等系统治疗)发现不同肿瘤分期,分子分型的乳腺癌患者,在术后12-18月之间存在一个复发高峰。从时间逻辑上提示,乳腺癌术后的复发转移可能与手术之间存在密切关系。此外还有多个研究提示手术可能导致肿瘤细胞脱落,亚临床病灶的存在等证据提示手术可能可能与肿瘤转移复发相关。
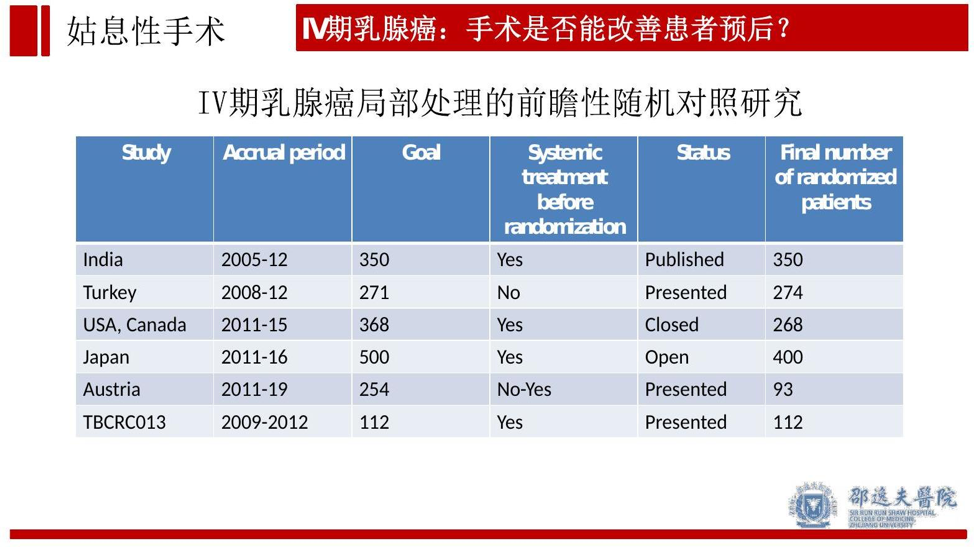
接下来我们再回顾外科手术在手术前即存在远处转移的IV期乳腺癌中的作用。尽管既往多个回顾性研究提示手术能改善IV期乳腺癌的预后,但随机对照研究结果不仅相同,部分研究结果提示手术并不能改善患者预后。可能原因与手术前是否接受系统治疗,全身转移灶瘤负荷,转移灶部位,分子分型等相关。
需要指出的是IV期乳腺癌并不是研究手术是否促进肿瘤转移的最佳临床模型。但至少可以从手术和系统治疗联合的综合效应分析(印度TATA研究和土耳其的MF07-01),在系统治疗不足的情况下(TATA研究),手术不改善患者预后。而在充分系统治疗前提下,手术可改善患者预后(MF07-01研究)。从侧面说明,强劲的系统治疗能使IV期乳腺癌患者从手术中获益,手术并不改善系统治疗不足患者的预后。

就理论而言,外科手术治疗肿瘤过程中,不管是对肿瘤局部还是全身的影响均有可能促进肿瘤转移。外科医生在手术过程中,尽量动作轻柔,减少肿瘤触碰,先结扎静脉再结扎动脉,整块精准切除等无瘤操作原则均是为了减少术中肿瘤细胞的播散和种植。除手术本身以外,同时因手术而伴随的麻醉,输血,药物,心理因素等导致全身免疫状态抑制均在理论上存在促进肿瘤转移的风险。
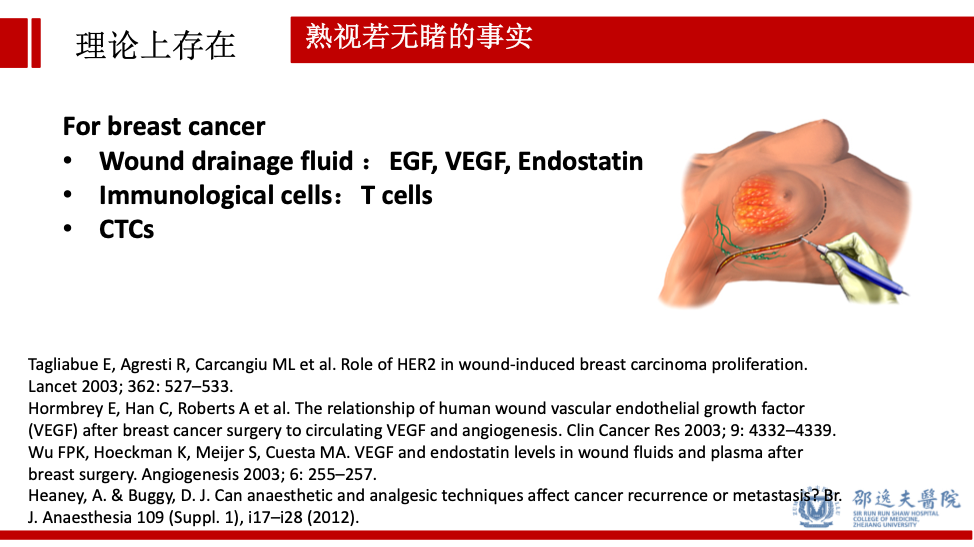
实际上在乳腺癌领域,已有诸多研究证实,在术后的引流液中可检测到多种促进肿瘤生长的生长因子,如EGF,VEGF,Endostatin等。手术前后,患者全身的免疫状态确实会出现短暂的抑制状态。此外,通过检测手术前后患者外周血中的循环肿瘤细胞(CTC),研究者还发现手术可导致患者外周血中循环肿瘤细胞的增加。这些研究尽管没有直接证实手术会促进肿瘤转移,但从侧面提示手术可在某种程度上“营造”肿瘤复发转移的环境。
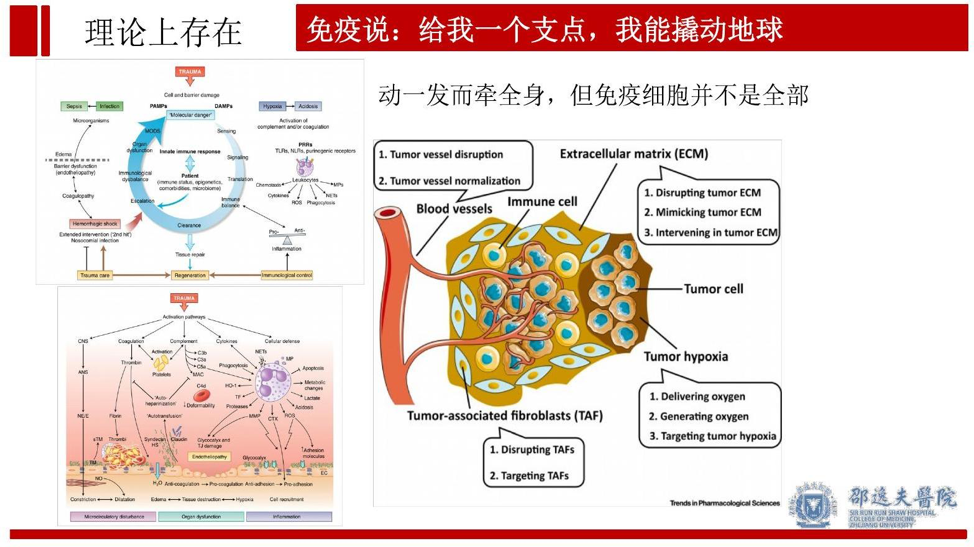
众所周知,免疫治疗在肿瘤综合中极具潜力,靶向免疫有望成为肿瘤治疗的重要一环。本次会议中,我们聚焦了免疫功能在术后转移中的作用,特别是微环境中的免疫细胞在肿瘤转移中的影响。但从肿瘤转移灶形成和生长的微环境角度看,似乎单纯考虑免疫细胞还不够。尽管免疫细胞在肿瘤微环境中作用巨大,但我们不能一叶障目不见泰山,忽略了肿瘤微环境中其他成分的作用。
此外,肿瘤细胞本身作为肿瘤是否复发的主体更加不容忽视。手术是否促进肿瘤转移的命题,更加精确的应该是外科手术是否促进肿瘤细胞的生长更加确切。

在人类与肿瘤斗争的历史长河中,不断有学者提出手术促进肿瘤的学说。早在上个世纪初,研究者已经观察到肿瘤稳态现象,提出营养剥夺和免疫抑制导致手术促进转移的理论。到上世纪中叶,提出了肿瘤冬眠和外科手术导致生长因子释放的理论。到1975-1985年间研究者证实了外科手术导致促生长因子释放理论,逐步放弃了免疫抑制理论。上世纪末又提出了血管生成促进冬眠肿瘤细胞的生长的理论。到本世纪初进一步发现单个处于冬眠状态的肿瘤细胞。综上所述,处于冬眠状态的肿瘤细胞在外科手术促进肿瘤复发转移中具有重要作用,但是外科手术通过何种机制“唤醒”冬眠肿瘤细胞,如何避免或抑制“唤醒”仍待进一步探索。
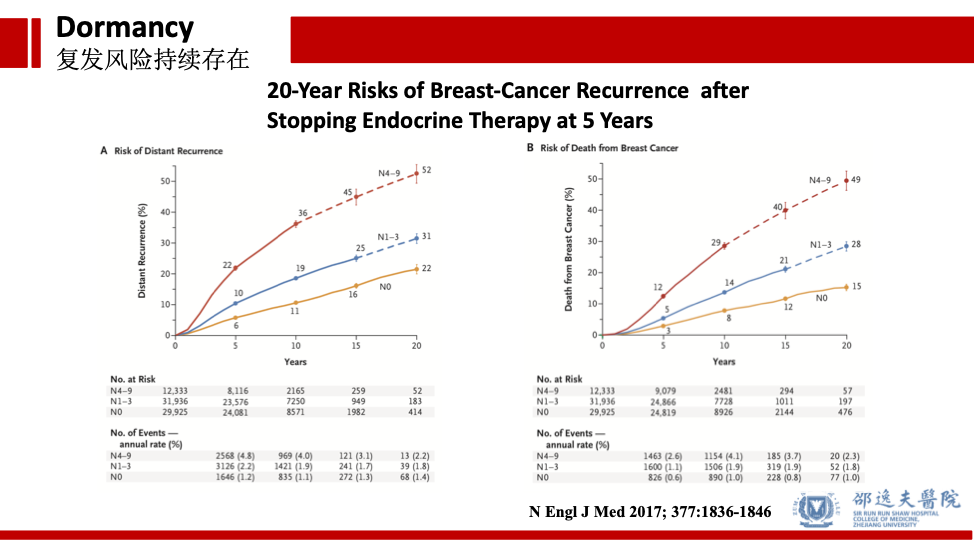
真实世界的研究同样发现,乳腺癌Luminal型乳腺癌患者接受综合治疗后,在随访期间,仍然存在复发转移风险,且这种风险持续存在。这些研究结果也提示完成综合治疗后,现有的检测手段无法检测到处于冬眠状态的肿瘤细胞。在适应条件(比如手术),此类冬眠状态的细胞可被“唤醒”,不断生长,最终被临床诊断而确诊复发转移。
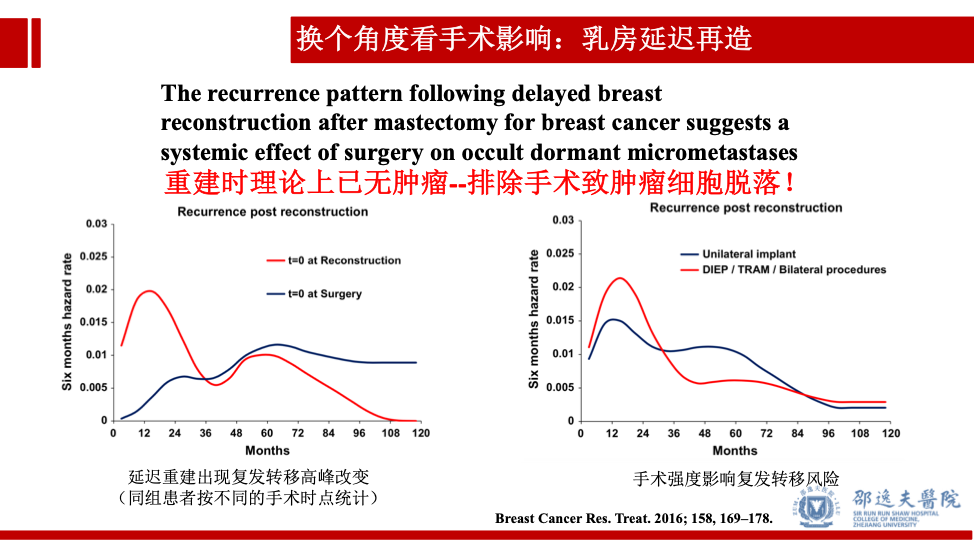
乳腺癌术后延迟重建的患者复发转移情况同样符合上述理论。理论上重建时患者全身已经处于“无瘤”状态(临床检测未发现复发转移灶存在),而重建手术后观察到术后复发转移的高峰,同时手术大小(范围)也影响术后短期内的复发转移。上述证据提示:尽管总体而言乳房重建手术并不影响总体患者的长期预后,但手术及相关因素似乎与部分患者术后短期内的复发转移高峰相关。
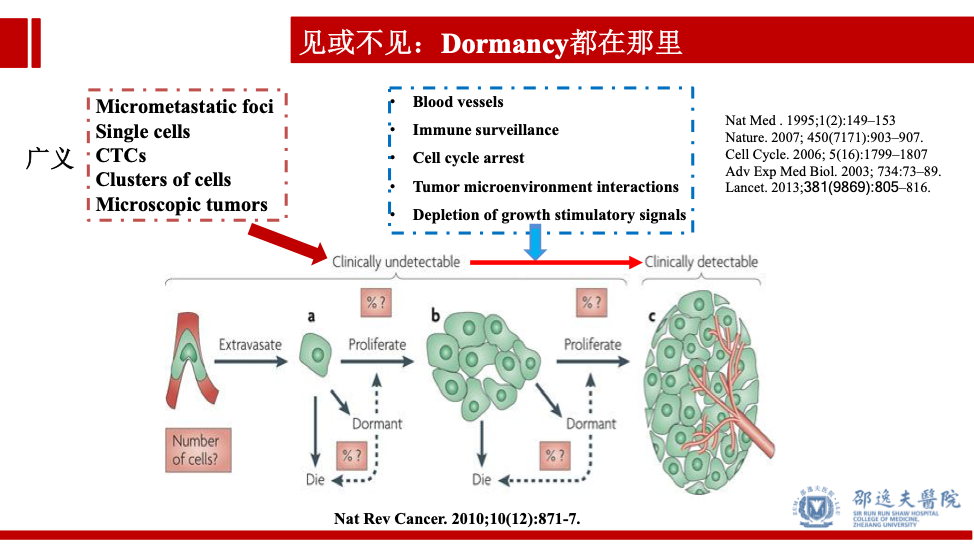
因此外科手术促进肿瘤复发转移的根本原因可能是患者接受手术时即存在现有临床检测手段无法发现的“亚临床转移灶”(包括微转移病灶,单个肿瘤细胞,循环肿瘤细胞,成簇肿瘤细胞等)。这些病灶我们可将此类细胞归类为处于冬眠状态的肿瘤细胞,在适宜条件下,经历“九九八十一难”(血管生成受限,免疫监测,细胞周期阻抑,肿瘤微环境改变,生长因子剥夺),最终形成临床可检测的肿瘤---复发转移。
大量研究已经证实手术联合系统治疗对比单纯手术的确可以改善患者预后,理论上系统治疗杀灭了部分外科手术无法根除的亚临床病灶(包括循环肿瘤细胞)。而外科手术在此类亚临床病灶前无计可施,从理论上甚至有促进此类细胞增殖生长的作用。
那么是不是在术前通过术前系统治疗,杀灭此类细胞可减少术后复发转移风险呢? 多个乳腺癌新辅助化疗的随机对照临床研究,试图在术前杀灭此类肿瘤细胞。理想很丰满,结果很骨感!对比术后给予辅助化疗组,新辅助化疗未改变患者的长期预后。我们认为其可能解释的原因是:术前新辅助化疗可杀部分亚临床病灶(包括循环肿瘤细胞),但处于冬眠状态的肿瘤细胞可能对现有的系统治疗耐药,成功躲避了系统治疗的杀伤。
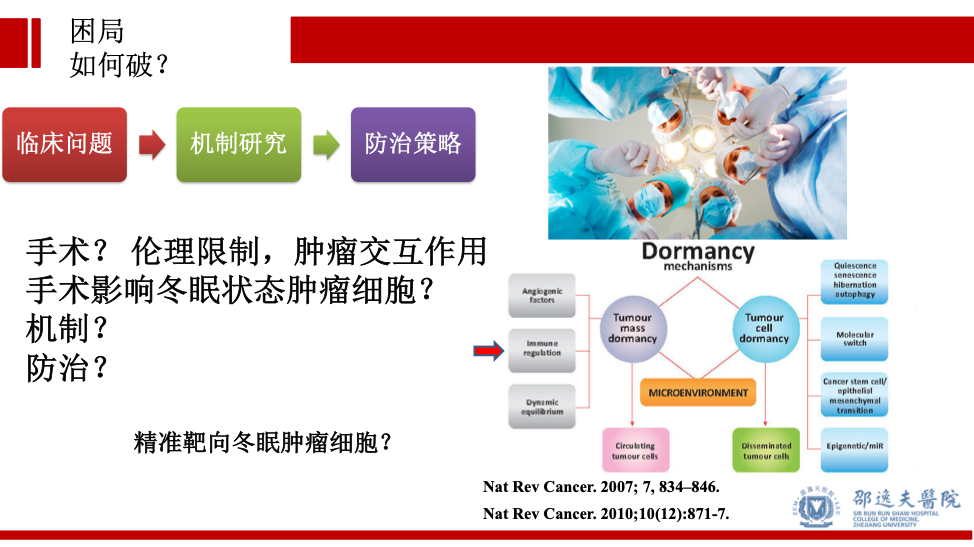
由于伦理限制,目前医疗情况下不可能直接对比根治性手术与不手术对于可手术乳腺癌患者的预后影响。同时由于肿瘤原发灶本身通过释放多种信号,对亚临床病灶的维持具有重要作用(反之亦然),即外科对转移灶切除与亚临床病灶之间存在交互作用,无法通过简单临床试验阐述外科手术是否促进肿瘤转移这个命题。基于目前的研究现状,我们需要更加深入的研究冬眠状态的肿瘤细胞,以及外科手术所致的局部和全身效应对此类肿瘤细胞的影响。当然最根本的策略是研发新的药物精准靶向冬眠肿瘤细胞,斩草除根!
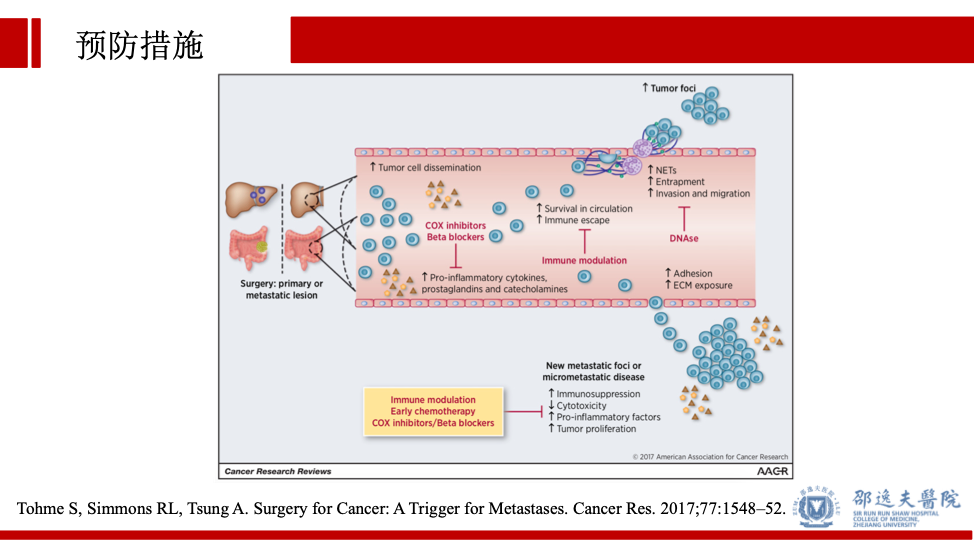 此外,研究也提示我们可以通过免疫调节,尽早化疗,COX抑制剂,β受体阻滞剂等措施避免手术所致的肿瘤细胞转移。
此外,研究也提示我们可以通过免疫调节,尽早化疗,COX抑制剂,β受体阻滞剂等措施避免手术所致的肿瘤细胞转移。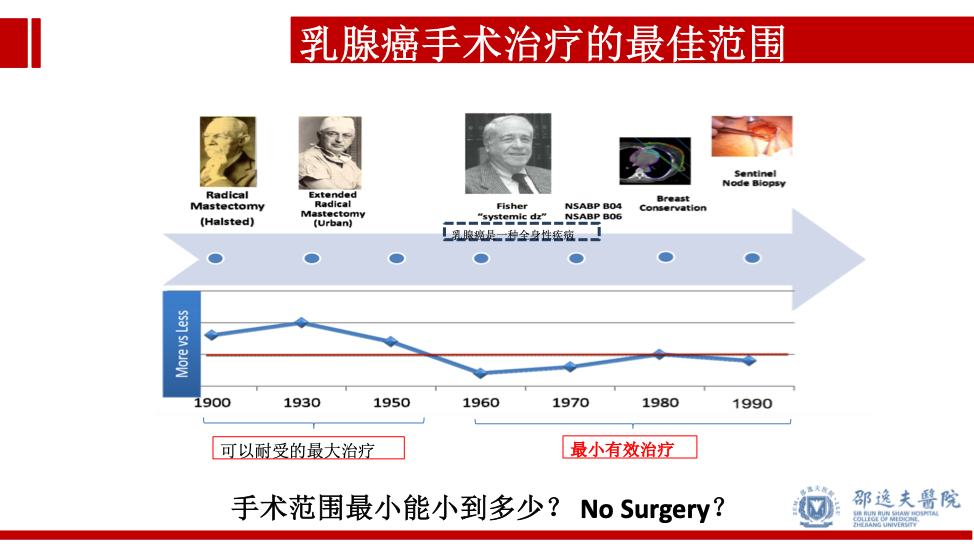
既然手术无法“洗脱”促进肿瘤复发转移的潜在“罪名”,我们再从乳腺癌手术方式的发展历程角度思考手术在乳腺癌综合诊治中的作用。从最初的扩大根治到改良根治,再到保乳手术,以及前哨淋巴结活检代替腋窝淋巴结清扫。总体看乳腺癌外科治疗,从“可以耐受的最大治疗”慢慢向“最小有效治疗”过渡,我们的手术似乎越做越小(乳腺重建不在此讨论范畴)。我们需要思考的是手术范围最小能小到多少?从穷尽法的逻辑而言,最终乳腺癌是不是需要外科手术治疗?
但是,从另一个角度看,Fisher教授的关于肿瘤属于系统性疾病的理论并非适合所有乳腺癌患者。Fisher教授认为肿瘤属于系统性疾病,患者预后取决于其生物学特性,与局部治疗范围无关。临床上部分早期患者,仅仅接受局部手术治疗,无需系统治疗,即可获得治愈。对这部分患者可能在手术时肿瘤局限(不存在亚临床病灶),从理论上无需担忧手术促进肿瘤复发转移。
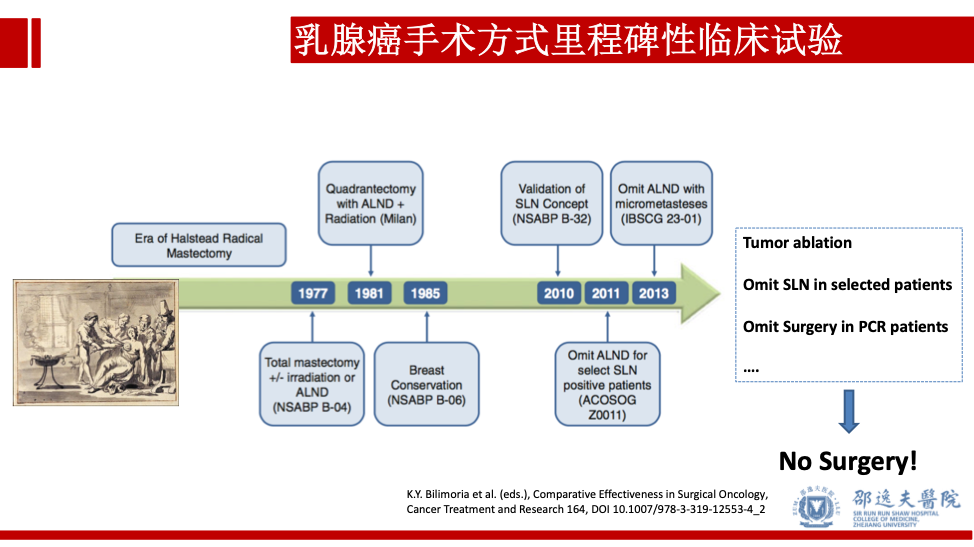
当然所有的临床实践必须遵循高级别临床试验的结果。目前乳腺癌外科手术策略都是基于前人不屑努力的研究成果。从“巨创”到“有创”,再到“微创”。随着肿瘤射频消融技术,前哨淋巴结豁免,新辅助治疗达到病理完全缓解(PCR)患者豁免手术,我们希望患者在获得最佳预后的前提下,接受最小的创伤,最终达到“无创”的境界。
未来可期,真正意义上的外科手术在不久的将来可能真的只剩下诊断的价值,但这必须寄希望于强劲的精准靶向系统治疗方案。同时我们也必须考虑通过系统治疗完全杀灭肿瘤,必然也会带来或多或少的毒副反应。到时,也许我们提供给乳腺癌患者的治疗方案是:单纯系统治疗(毒副反应较大),综合方案微创手术联合系统治疗(毒副反应较轻)。

结语
对于任何临床问题的讨论,我们必须立足当下,同时展望未来。在现有乳腺癌综合治疗框架中外科手术仍然不可或缺。外科手术是否促进肿瘤转移的这个命题,更多地是提醒我们通过包括手术在内的综合治疗达到乳腺癌患者的真正“根治”(杀灭现有临床检测水平可发现的病灶和目前尚无法检测的亚临床病灶)。
结合本文所述的研究结果,至少我们可以从以下几方面进行努力:
1. 临床检测技术:更早的发现肿瘤(分子标志物,检测技术),及时治疗。发现亚临床病灶,对部分现有指南规定术后无需辅助系统治疗的患者,精准加强系统治疗。
2. 亚临床病灶的治疗:在有效检测出亚临床病灶的前提下,探索研究其耐受现有系统治疗的机制,开发新的靶向此类亚临床病灶的治疗策略,特别是冬眠肿瘤细胞。
3. 围手术期处理:以手术为中心(无瘤操作),兼顾手术前后(减少围手术期肿瘤细胞脱落播散及冬眠细胞的“唤醒”)。
4. 手术的选择:在现有的医疗条件,根据当前的指南规定开展手术。随着医学逐步推进,手术适应症将会不断调整,部分患者仅接受强劲的系统治疗即可。
尽管Fisher教授关于肿瘤属于系统性疾病的理论广为流传。但不可否认部分乳腺癌可通过单纯局部手术治疗即可治愈,无需系统治疗,而获得长期无病生存。因此手术在乳腺癌综合治疗中的作用无法抹杀。如何细分患者,制定个体化疗综合治疗方案(有选择的手术)是关键。












 苏公网安备32059002004080号
苏公网安备32059002004080号


