【35 under 35】风采展示第二轮已经开始啦!本轮正经名叫“病例实战分析”,不正经名叫“互相伤害”,哈哈哈~100位入围选手每人提交一个有意思的病例,并就病例提出一个问题,形成一个病例库!然后100位入围选手从病例库中任意选择一个非自己提供的病例进行解读并回答问题!最后,我们将呈现病例+别人的点评+病例提供者自己的点评,同步展示!
 100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!
100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!
患者病情简介
• 患者女性,58岁,因“右乳癌术后22月余,发现右胸壁肿块1月余”入院。
• 22月余前因右乳肿块(右乳12点靠近乳头后方)行Core针穿刺提示右乳浸润癌,于外院行右乳癌改良根治术,术后病理:右乳浸润性导管癌(肿块大小:2.2*1.4cm),组织学分级:II级,伴高级别导管内癌,血管可见癌栓,乳头、皮肤及基底切缘均阴性,腋窝35枚LN 1枚见癌转移;免疫组化:ER(+)90%、PR(+,2%)、P53(灶+)、p21(+)、Ki-67(+)20%、CerbB-2(-)、E-Cad(+++)、CD34血管(+)、D2-40淋巴管(+)。 术后行EC方案化疗6次(表柔比星 75mg/m2 + 环磷酰胺 800 mg/m2),18月前完成末次化疗。未行放疗。化疗期间有月经,化疗结束后托瑞米芬 60mg 每日一次内分泌治疗维持,定期复查。
• 1月前复查时胸部CT提示:右第二前肋软骨后缘胸膜面下结节。
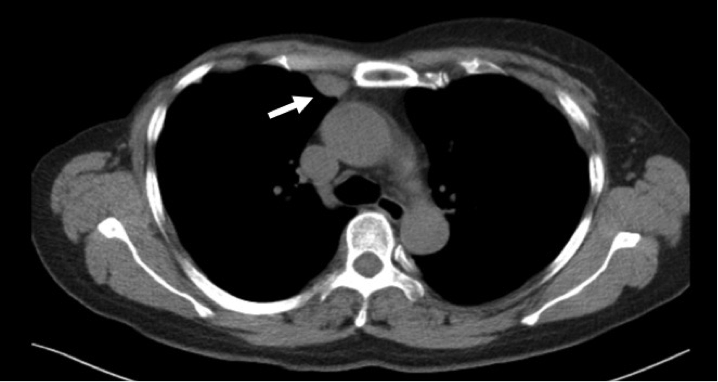
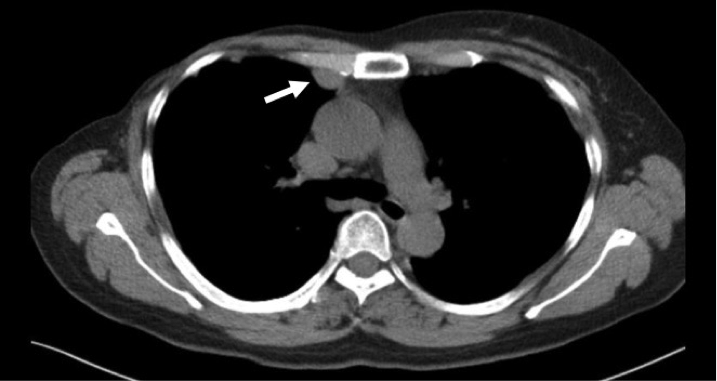
• 既往史/家族史/婚育史/个人史均无特殊。
• 入院诊断:右乳癌术后 (pT2N1Mx Luminal B型)
右胸壁肿块性质待查 乳腺癌转移首先考虑?
诊治经过
• 入院后行B超引导下右胸壁肿块穿刺,病理:(右侧胸壁穿刺)低分化腺癌,结合免疫组化及病史考虑乳腺来源;免疫组化:ER(>95%+)、PR(-)、Her-2(1+)、Ki-67(25%+)。
• 完善全身评估,除右侧胸壁肿块外,未见其他部位转移。
PET-CT示:右乳癌切除术后,局部未见明显肿块及FDG摄取增高影,右侧内乳血管旁一枚肿大淋巴结,FDG摄取增高,考虑转移癌,全身其余部位未见FDG摄取增高影。
• 排除手术禁忌症,行内乳区淋巴结清扫术,术后恢复良好。
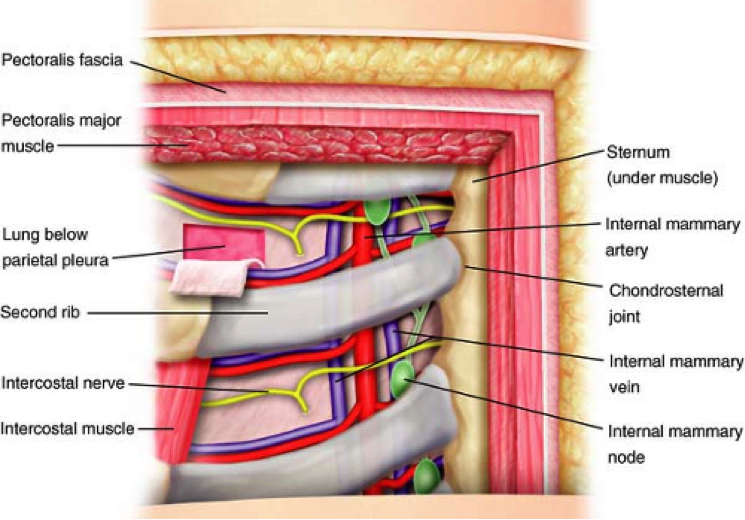
内乳区淋巴结沿着内乳动静脉排列
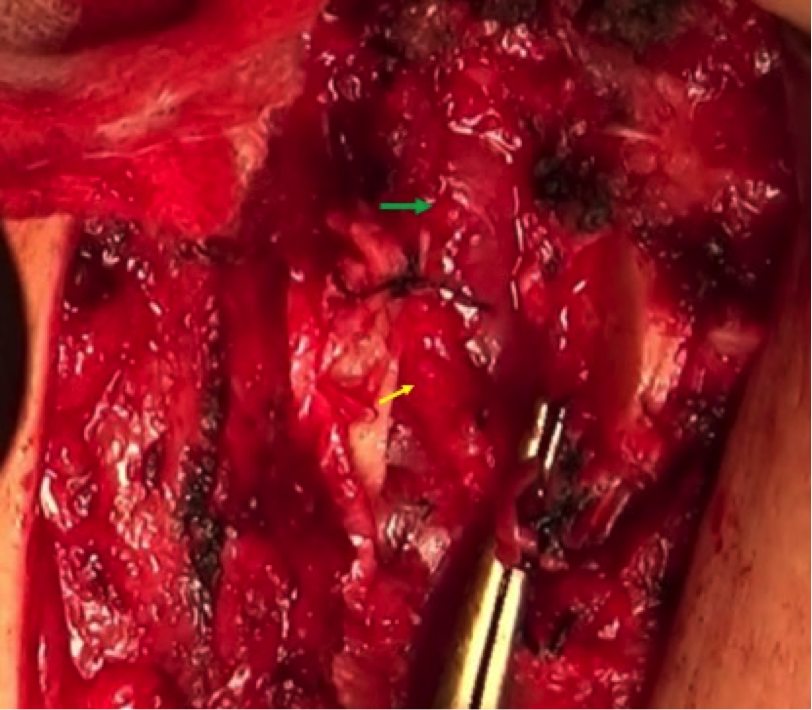
切开第2、3肋软骨,黄色箭头:内乳血管;绿色箭头:肿大淋巴结
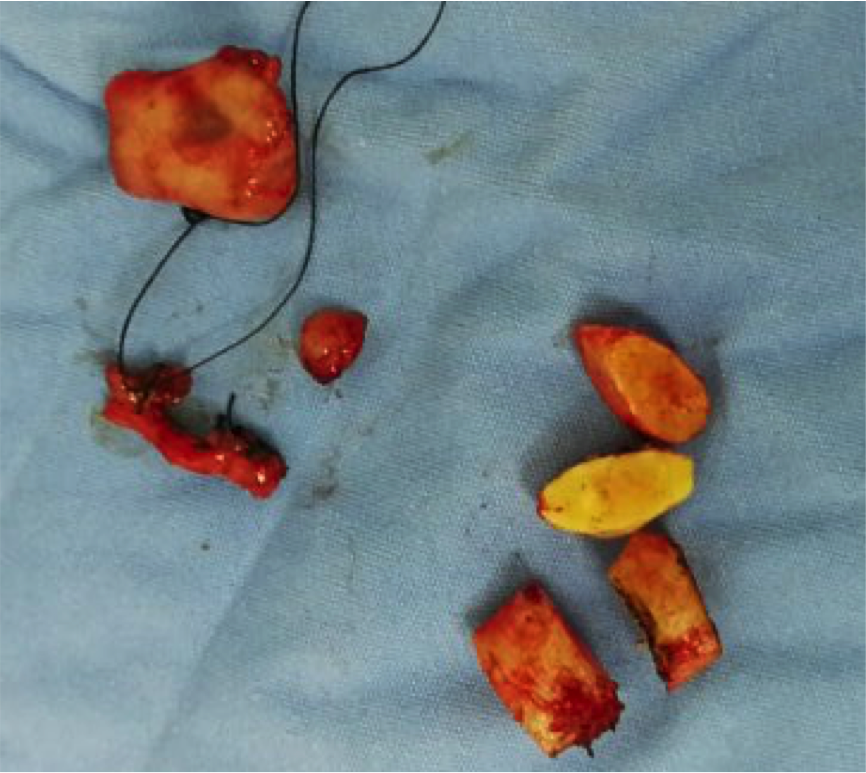 手术标本
手术标本
• 术后病理:右侧内乳淋巴结转移性癌,结合病史及免疫组化考虑为乳腺来源,免疫组化:GATA-3(+)、GCDFP-15(-)、Mammaglobin(-)、CK7(-)、Ki-67(30%+)、Her-2/乳腺(0)、ER(99%+)、PR(-)。
问题:请对该患者诊治过程进行评论,并提供后续治疗方案?
此病例共有2位入围选手点评,分别为35-李广亮、51-石薇;病例提供作者为:28-周济春。详情如下:
点评医生简介:35-李广亮
 点评内容分享:
点评内容分享:
本例中,患者术后21月即出现右侧内乳淋巴结转移,DFS不到2年。术后辅助治疗不规范是早期出现复发转移的重要原因。该患者术后病理分期为pT2N1M0,ⅡB期;分子分型为Luminal B型(Her-2阴性)。根据中国抗癌协会乳腺癌诊治指南与规范(2015版) [1],该患者术后复发风险的分组为中度(淋巴结1枚阳性,未见HER-2基因过度表达和扩增且ER和PR表达),具有术后辅助全身治疗的指证,且应包括辅助化疗及辅助内分泌治疗。
关于辅助化疗方案,目前蒽环类和紫杉类依然是最基本的药物选择。早期乳腺癌临床试验协作组(EBCTCG)的荟萃分析发现,4周期AC方案和6周期CMF方案等效;累积剂量比4周期AC更高的含蒽环类的化疗方案(比如CAF或CEF)的疗效均优于6周期CMF,显著降低复发和死亡风险;紫杉类联合蒽环类可进一步减少乳腺癌死亡率,蒽环类序贯紫杉类化疗方案减少乳腺癌死亡率1/3[2]。对于淋巴结数目1-3个的患者,含紫杉类的方案优于不含紫杉类的方案。CALGB 9344研究表明:对于淋巴结阳性的患者在AC的基础上,加用紫杉醇能使复发率和死亡率分别降低17%和18%[3]。BCIRG 001研究表明:与FAC方案相比,T(多西他赛)AC方案显著提高了淋巴结1-3枚阳性乳腺癌患者的10年DFS和OS[4]。PACS01研究发现3周期FEC 100序贯3周期的多西他赛(100mg/m2)相比6周期的FEC 100具有更高的5年DFS和OS[5]。辅助化疗的剂量强度也是制约其效果的重要因素,有研究表明化疗药物的剂量强度(RDI)低于85%会显著降低乳腺癌患者的DFS和OS[6]。NCCN指南(2017.V2)[7]对于激素受体阳性、Her-2阴性的乳腺癌术后辅助化疗推荐的首选方案包括剂量密集型AC(多柔比星 60mg/㎡,环磷酰胺600mg/㎡)×4序贯T(紫杉醇,每2周(175mg/㎡)×4或每周(80mg/㎡)×12),TC(多西他赛 75 mg/㎡,环磷酰胺600mg/㎡)×4;可选方案包括EC(表柔比星 100mg/㎡,环磷酰胺830mg/㎡)×8等。
本例中,患者术后病理分期为pT2N1M0,ⅡB期;分子分型为Luminal B型(Her-2阴性)。辅助化疗采用蒽环类与紫杉类联合或序贯的方案,效果更好。实际上该患者采用了6×EC(表柔比星 75mg/m2 + 环磷酰胺 800 mg/m2)的化疗方案,没有联合紫杉类;而且表柔比星(RDI=65%)及环磷酰胺(RDI=84%)的剂量强度均明显不足,化疗的周期数也不足,对辅助化疗的效果有较大的影响。
关于辅助内分泌治疗的选择,该患者化疗结束时仍未绝经,年龄56岁,治疗开始时选用托瑞米芬是可以的。
关于术后辅助放疗,NCCN指南(2017.V2)[7]中对于1~3枚淋巴结阳性的乳腺癌患者强烈建议对胸壁+锁骨上下区域,内乳淋巴结以及及腋窝床任何有风险的部位进行放疗。该患者虽然只有1枚阳性淋巴结,但肿瘤为pT2,且具有脉管癌栓等高危因素,可以考虑行术后辅助放疗。
--------------------------------------
点评医生简介:51-石薇
 点评内容分享:
点评内容分享:
该患者,女,58岁,右乳癌改良根治术后近2年发现右侧内乳淋巴结癌转移。该患者术后病理:右乳浸润性导管癌(肿块大小:2.2×1.4cm),组织学分级:II级,伴高级别导管内癌,血管可见癌栓,切缘均阴性,淋巴结1/35见癌转移。术后分期为pT2N1Mx,Luminal B型(Her-2阴性)。术后行EC方案化疗6次,未行放疗,化疗结束后托瑞米芬内分泌治疗维持。回顾该患者的治疗过程,再次提示行包括内乳淋巴结引流区在内的改良根治术后放疗(PMRT)在一部分患者身上的必要性 ,如何更好地找出这部分患者至关重要。
首先,让我们来看一下,根据现有共识,该患者是否应该行PMRT?
ASCO在2016年发布了最新的PMRT的指南[1],俞晓立教授先前也对该指南进行了解读[2]。该患者为pT2的肿瘤,腋窝淋巴结清扫1/35见癌转移。ASCO 2016年的指南对pT3肿瘤,≥4枚淋巴结阳性的患者推荐行PMRT;而对于类似该例患者的pT1-2的肿瘤,1-3枚淋巴结阳性的情况,现有共识是PMRT能够降低乳腺癌复发率及死亡率,但是对于其中一些低危的患者,医生和患者需权衡获益及风险,以决定是否需要行PMRT[1]。尽管有很多模型来预测局部区域复发及PMRT的可能获益,目前还没有统一确切的标准来界定其中哪些患者可以省略放疗。普遍认为年龄大,预期寿命短,Luminal A型,pT1肿瘤,病理分级I-II级,脉管无侵犯,1枚LN阳性,肿瘤位于外侧等属于低危的特征。该患者虽然只有1/35淋巴结见癌转移,但是为pT2的肿瘤,且具有脉管癌栓等高危因素,是可以考虑行PMRT的。
需要指出的是,支持PMRT能够降低pT1-2的肿瘤,1-3枚淋巴结阳性的患者的乳腺癌复发率及死亡率的最有影响的研究之一是早期乳腺协作组(EBCTCG)在2014年发表的乳腺癌根治术后患者荟萃分析。指南也指出该荟萃分析纳入的文献很多来自80和90年代,随着全身治疗及手术技术的进展,最近研究报道的局部复发率有了明显的下降[3-6] ,或提示在现今的条件下PMRT的获益可能进一步减小。目前正在进行SUPREMO研究的完成及其结果的报道或有助于确定在现有的技术条件下,哪些患者更适应行PMRT [7]。
其次,如行PMRT,对于该患者是否应该照射内乳淋巴结引流区?
俞晓立教授先前对内乳淋巴结引流区(IMN)的放疗争议和进展进行过论述[8],对于IMN放疗的决策制定需要考虑患者的复发风险,对于原发肿瘤位于中央区/内侧区同时伴有腋下淋巴结阳性的患者,建议考虑IMN的放疗。该患者肿块位于右乳12点乳头后方,腋窝淋巴结清扫1/35见癌转移,推荐PMRT的范围除了包括胸壁,锁骨上而外,还应该包括内乳淋巴结引流区[1]。这个结论主要基于EBCTCG荟萃分析[9], 加拿大的研究[10],丹麦的研究[11]以及EORTC的研究[12]。
后续治疗方案?
患者出现内乳淋巴结复发以后行内乳区淋巴结清扫术,术后病理提示右侧内乳淋巴结转移性癌, 结合病史及免疫组化考虑为乳腺来源,仍然为Luminal B型(Her-2阴性)。现在的观点认为,对于局部区域孤立性复发的患者,还是应该采取相对积极的治疗策略。该患者未行PMRT,可以考虑补充行预防性全胸壁和锁骨上区放疗,DT:50Gy/25Fx。全身治疗方面,复发病灶术后病理显示仍然为Luminal B型(Her-2阴性),但由于先前内分泌治疗不到2年出现内乳淋巴结转移,可以考虑换药再继续内分泌治疗。若后续疾病再次复发进展,需重新活检,再根据病变部位,累及范围,分子分型,病人一般状况等制定后续治疗方案。
下面简单回顾一下未接受过PMRT的乳腺癌改良根治术后的局部区域孤立性复发病例的治疗相关的研究,报道的复发病例以胸壁及锁骨上,腋下淋巴结引流区为主,单纯内乳复发的病例较少,专门针对内乳复发的研究也有限[13, 14]。研究显示,先手术切除复发病灶再行放疗,相比于单纯手术或单纯放疗等方案能够获得更好的局部控制[15]。多数研究提示,复发病灶切除术后行预防性全胸壁加区域淋巴结引流区≥46Gy-50Gy的放疗(有或无局部加量),相比于累积区域放疗,可以提高局控率及生存率 [16-20]。与常规分割相比,加速超分割未能提高局控率[21]。有研究提示同期放化疗[22, 23]以及辅助化疗[24, 25]能够提高疗效。综上,笔者认为,对于先前没有接受过PMRT的改良根治术后局部区域孤立性复发的患者,可以考虑手术切除复发病灶后行全胸壁加区域淋巴结引流区的放疗,完全切除者行常规分割预防照射,剂量≥46Gy-50Gy,切除后有残留者,残留部位放疗剂量≥60Gy。复发病灶不能手术者,可以考虑先行同步放化疗后再根据病灶退缩情况决定后续治疗方案。全身化疗对于激素受体阴性的患者价值更大。当然,还期待更多内乳淋巴结孤立性复发的病例研究和更多高级别的证据。
特别鸣谢:俞晓立教授
--------------------------------------
病例提供作者简介:28-周济春
 病例提供作者自评:
病例提供作者自评:
此例中老年乳腺癌患者,在2015年8月接受右乳癌改良根治术,术后病理分期IIB期(pT2N1M0),分子分型为Luminal B HER2阴性型,术后行辅助化疗及内分泌治疗,未行辅助放疗。内分泌维持治疗期间出现孤立性内乳区淋巴结复发。现结合2015年和2017年NCCN指南对该患者内乳淋巴结复发前(包括辅助化疗,放疗,内分泌治疗)及复发后(孤立性内乳淋巴结复发后治疗)治疗方案进行评论。
复发前
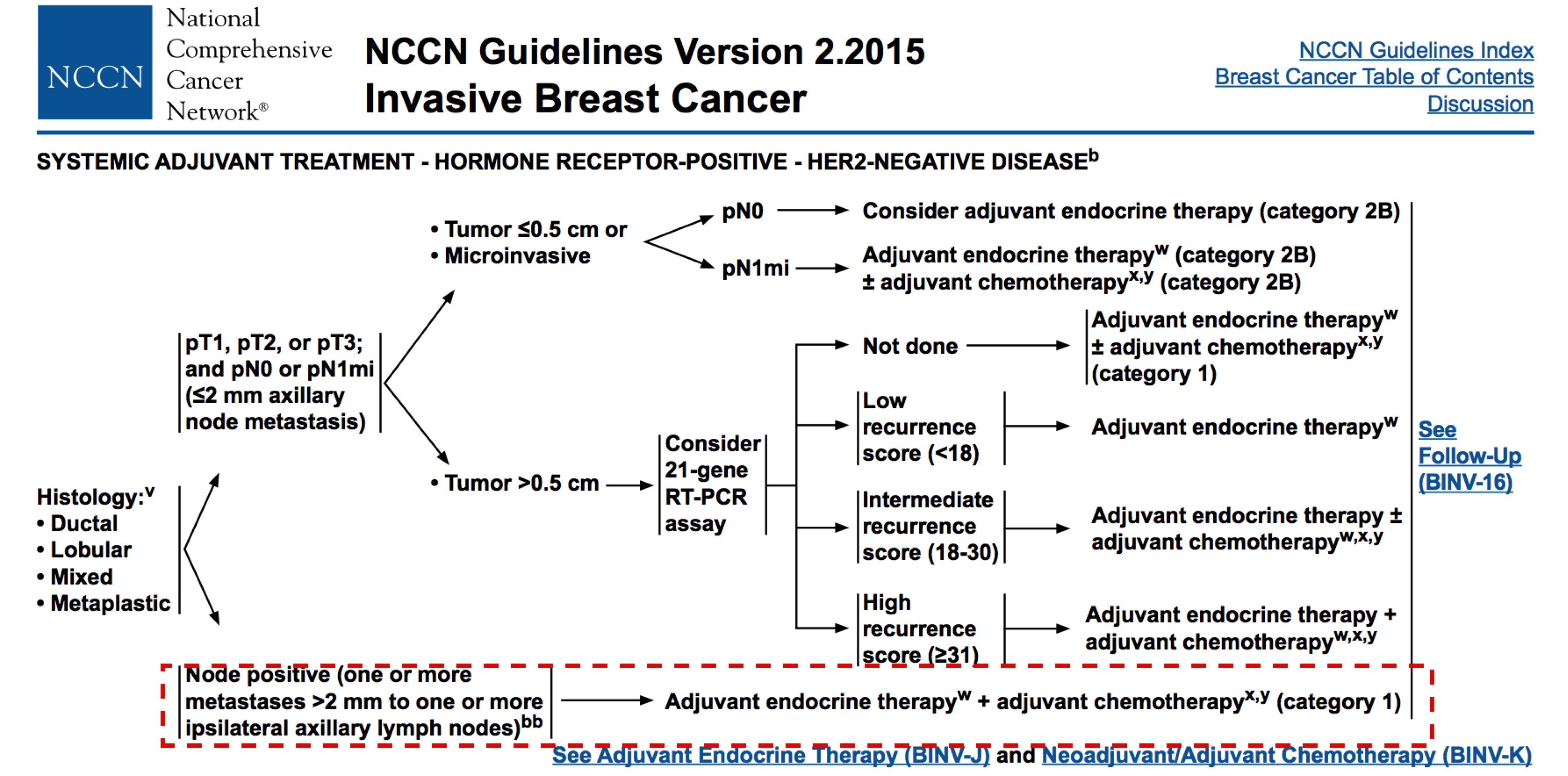 2015NCCN指南推荐HR阳性HER2阴性乳腺癌伴淋巴结转移时系统治疗
2015NCCN指南推荐HR阳性HER2阴性乳腺癌伴淋巴结转移时系统治疗
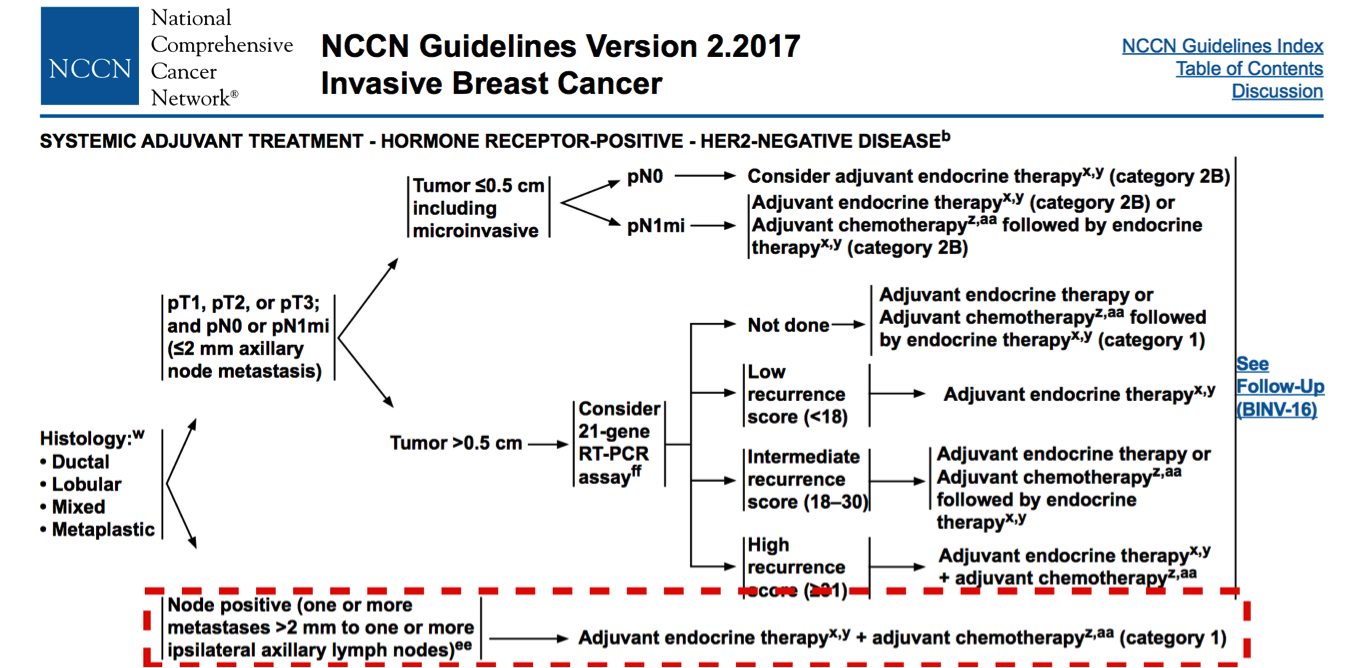
2017NCCN指南推荐HR阳性HER2阴性乳腺癌伴淋巴结转移时系统治疗


2015NCCN指南推荐HER2阴性乳腺癌术后辅助化疗方案

2017NCCN指南推荐HER2阴性乳腺癌术后辅助化疗方案
辅助化疗:该患者辅助化疗方案选择6周期AC方案,并非现有指南推荐的化疗方案。在GALBG40101试验提示6周期AC方案并没有较4周期AC方案改善患者的DFS和OS,但相关毒副反应明显增加[1]。而US Oncology Research Trial (USOR 9735)试验提示4周期的TC方案要优于4周期的AC方案: DFS (81% TC v 75% AC; P=.033; HR, 0.74; 95% CI 0.56 to 0.98) , OS (87% TC v 82% AC; P =.032; HR, 0.69; 95% CI, 0.50 to 0.97)[2]。综合上述两个临床试验,同时结合患者临床病理特点属于中危的情况,该患者在2015术后辅助化疗方案选择6周期AC方案存在一定不足,基于当时的指南可选择 6周期FEC或FAC方案,至少应该选择4周期的TC方案。
 2015NCCN指南I/IIA/IIB期及IIIA期(T3N1M0)乳腺癌的局部区域放疗选择
2015NCCN指南I/IIA/IIB期及IIIA期(T3N1M0)乳腺癌的局部区域放疗选择

2017NCCN指南I/IIA/IIB期及IIIA期(T3N1M0)乳腺癌的局部区域放疗选择
辅助放疗:该患者2015年乳腺癌改良根治术后,病理提示1枚淋巴结转移(N1),2017NCCN指南强烈推荐行包括胸壁及区域淋巴结区(腋窝区,锁骨上下及内乳区)的放射治疗。特别是随着MA.20试验[3]和EORTC 22922/10925试验[4]结果的发布,从2016年起NCCN指南对于存在淋巴结转移的乳腺癌患者强烈推荐行包括胸壁及区域淋巴结区(腋窝区,锁骨上下及内乳区)的放射治疗。MA.20研究纳入的患者为接受保乳手术后,结果提示区域淋巴结放射治疗能改善DFS[3]。而EORTC 22922/10925试验同时纳入接受保乳手术(76.1%)和改良根治术患者(23.9%)提示增加区域淋巴结放射可改善DFS,同时改善OS[4]。该患者在2015年结束化疗后,由于内乳区是否照射在当时仍属于2b类证据,可以不进行相应照射。但未根据2015年NCCN指南进行胸壁,腋窝及锁骨上下区的照射属于治疗不足。

2015NCCN指南辅助内分泌治疗推荐意见

2017NCCN指南辅助内分泌治疗推荐意见
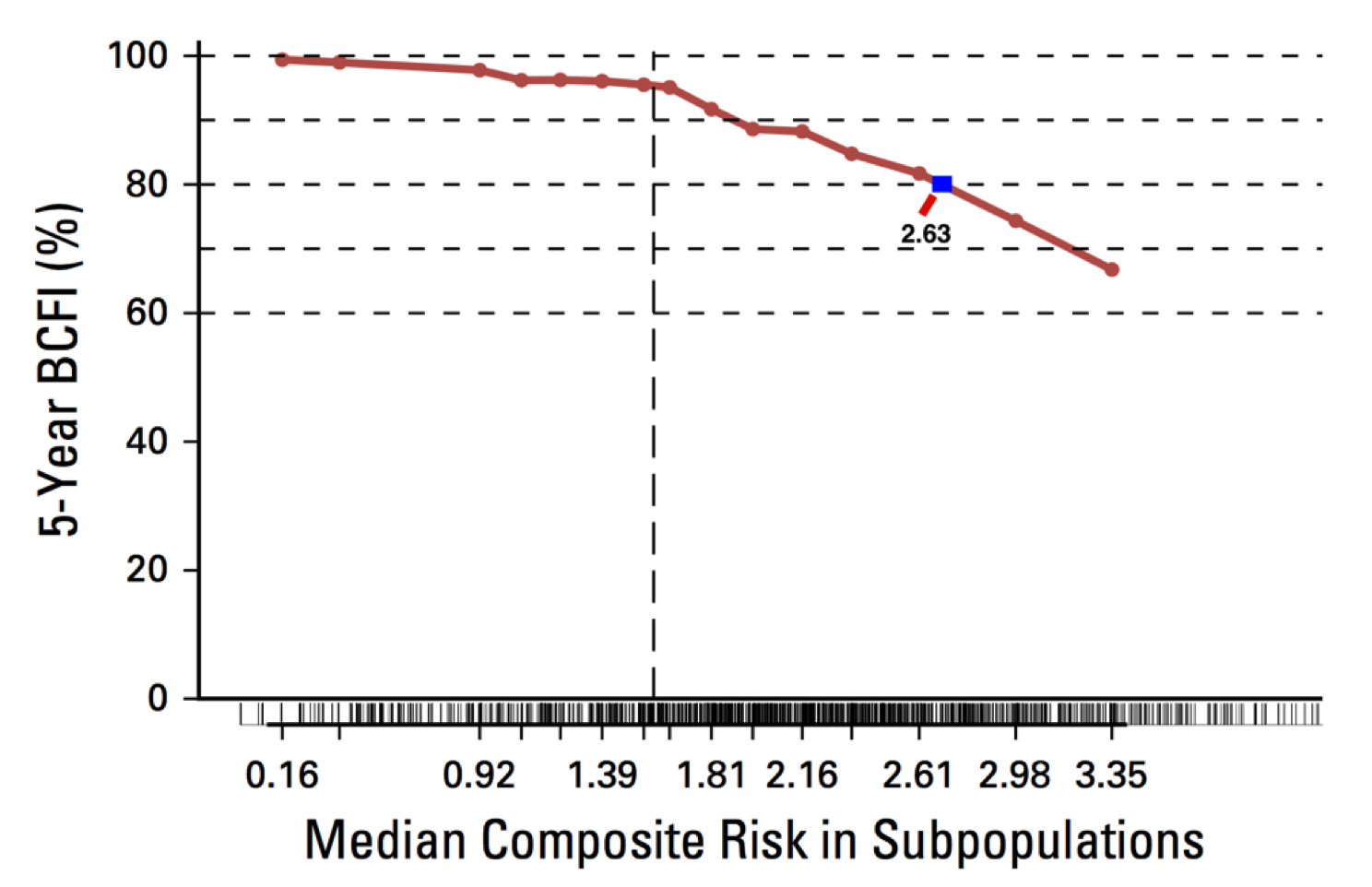 STEEP分析评估绝经前患者复发复合风险
STEEP分析评估绝经前患者复发复合风险
辅助内分泌治疗:该患者化疗结束时仍有月经,属于绝经前阶段,2015年NCCN推荐此类患者接受他莫昔芬或联合卵巢功能抑制(2b类证据),该患者当时接受托瑞米芬治疗是妥当的。2017年NCCN指南对此类患者的辅助内分泌治疗相比2015年指南有较大变化。基于SOFT和TEXT队列研究结果,STEEP分析[5]可判断患者的复发风险,决定是否进行卵巢功能抑制(OFS)。结合患者临床病理特征进行分析,该患者复发风险评分超过1.59,5年无乳腺癌间期(BCFI)年复发风险近20%,属于中高危人群,可能能从联合OFS中获益,因此现有最佳证据推荐此类患者接受AI+OFS方案的内分泌治疗。

2017NCCN乳腺癌局部区域复发治疗原则
复发后
孤立性内乳区淋巴结复发:患者辅助内分泌维持治疗期间,胸部CT扫描发现同侧内乳区淋巴结肿大, 全身复查未见其余部位复发转移灶,经Core针穿刺病理确认及与2015年术后病理对比,考虑同侧孤立内乳区淋巴结复发。尽管NCCN指南推荐孤立性内乳区淋巴结复发可仅接受放射治疗,但目前并无相关的高级别证据。特别是该患者既往未接受过术后辅助放疗,辅助内分泌维持治疗期间出现孤立性内乳区淋巴结复发。另外从放疗角度考虑,患者复发淋巴结较大(直径超过2cm),常规放射治疗难以达到根治效果,且随着放射剂量的提高极有可能出现患者无法耐受的毒副反应,将相关风险与患者及家属充分沟通后,行内乳区淋巴结清扫。
进一步治疗方案:
1)术后辅助放射治疗:内乳区根治性照射,同时包含胸壁+其他淋巴结引流区域照射;

Luminal型复发或转移乳腺癌的治疗方案

复发或转移性乳腺癌内分泌治疗方案选择
2)内分泌治疗:考虑SERM原发耐药(辅助治疗期间2年内复发),可选方案较多[6]。由于患者目前已58岁,但结合其化疗期间仍有月经的情况,仍需测定患者激素水平方可判断是否绝经。若已属于绝经状态,结合全身情况可(无内脏危象),可选AI类药物或SERD类药物Fulvestrant。具体根据患者耐受性和经济情况决定。
3)补充化疗: 目前对于局部区域复发后,已行手术切除的患者是否需要行化疗,目前缺少高质量的临床试验。 CALOR试验[7]提示术后进行辅助化疗可以改善孤立性局部区域复发患者的DFS和OS,但亚组分析提示这种获益主要见于ER阴性的患者,ER阳性的患者并不能从中获益。另外该研究中涉及孤立性区域淋巴结复发的患者较少[7]。考虑该患者辅助治疗阶段存在化疗不足(6周期AC 方案),另外患者对对SERM原发耐药,对后续其他内分泌治疗耐药的风险较大, 故推荐采用4周期紫杉类单药化疗方案。

内分泌维持治疗进展后续方案
4)定期复查,检测复发转移;
1. Shulman LN, Cirrincione CT, Berry DA, Becker HP, Perez EA, O’Regan R, Martino S, Atkins JN, Mayer E, Schneider CJ, Kimmick G, Norton L, Muss H, Winer EP, Hudis C: Six cycles of doxorubicin and cyclophosphamide or paclitaxel are not superior to four cycles as adjuvant chemotherapy for breast cancer in women with zero to three positive axillary nodes: Cancer and leukemia group B 40101. Journal of Clinical Oncology 2012, 30:4071–4076.
2. Jones S, Holmes FA, O’Shaughnessy J, Blum JL, Vukelja SJ, Mclntyre KJ, Pippen JE, Bordelon JH, Kirby RL, Sandbach J, Hyman WJ, Richards DA, Mennel RG, Boehm KA, Meyer WG, Asmar L, Mackey D, Riedel S, Muss H, Savin MA: Docetaxel with cyclophosphamide is associated with an overall survival benefit compared with doxorubicin and cyclophosphamide: 7-year follow-up of us oncology research trial 9735. Journal of Clinical Oncology 2009, 27:1177–1183.
3. Whelan TJ, Olivotto IA, Parulekar WR, Ackerman I, Chua BH, Nabid A, Vallis KA, White JR, Rousseau P, Fortin A, Pierce LJ, Manchul L, Chafe S, Nolan MC, Craighead P, Bowen J, McCready DR, Pritchard KI, Gelmon K, Murray Y, Chapman J-AW, Chen BE, Levine MN, MA.20 Study Investigators: Regional Nodal Irradiation in Early-Stage Breast Cancer. The New England journal of medicine 2015, 373:307–16.
4. Poortmans PM, Collette S, Kirkove C, Van Limbergen E, Budach V, Struikmans H, Collette L, Fourquet A, Maingon P, Valli M, De Winter K, Marnitz S, Barillot I, Scandolaro L, Vonk E, Rodenhuis C, Marsiglia H, Weidner N, van Tienhoven G, Glanzmann C, Kuten A, Arriagada R, Bartelink H, Van den Bogaert W: Internal Mammary and Medial Supraclavicular Irradiation in Breast Cancer. New England Journal of Medicine 2015, 373:317–327.
5. Regan MM, Francis PA, Pagani O, Fleming GF, Walley BA, Viale G, Colleoni M, Láng I, Gómez HL, Tondini C, Pinotti G, Price KN, Coates AS, Goldhirsch A, Gelber RD: Absolute Benefit of Adjuvant Endocrine Therapies for Premenopausal Women With Hormone Receptor–Positive, Human Epidermal Growth Factor Receptor 2–Negative Early Breast Cancer: TEXT and SOFT Trials. Journal of Clinical Oncology 2016, 34:2221–2231.
6. Rugo HS, Rumble RB, Macrae E, Barton DL, Connolly HK, Dickler MN, Fallowfield L, Fowble B, Ingle JN, Jahanzeb M, Johnston SRD, Korde LA, Khatcheressian JL, Mehta RS, Muss HB, Burstein HJ: Endocrine Therapy for Hormone Receptor-Positive Metastatic Breast Cancer: American Society of Clinical Oncology Guideline. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2016.
7. Aebi S, Gelber S, Anderson SJ, Láng I, Robidoux A, Martín M, Nortier JWR, Paterson AHG, Rimawi MF, Cañada JMB, Thürlimann B, Murray E, Mamounas EP, Geyer CE, Price KN, Coates AS, Gelber RD, Rastogi P, Wolmark N, Wapnir IL, CALOR investigators: Chemotherapy for isolated locoregional recurrence of breast cancer (CALOR): a randomised trial. The Lancet Oncology 2014, 15:156–63.
以上为【35 under 35】的观点,您怎么看?欢迎广大肿瘤医生在下方留言发表您的观点!
以上所有点评参考文献略。














 苏公网安备32059002004080号
苏公网安备32059002004080号


