在4月23日举行的【齐肿内科大查房】系列线上直播学术会议中,来自山东大学齐鲁医院肿瘤内科的王健教授,汇总了近期发表于国际顶级期刊的结直肠癌诊疗重磅进展,进行了系统的梳理与解读。本篇聚焦于靶向治疗,深度剖析KRAS G12C等靶点在CRC靶向治疗方面的最新进展。【肿瘤资讯】特此整理,以飨读者。
专家介绍
山东大学与瑞典卡罗林斯卡学院联合培养博士
山东免疫学会肿瘤分子标记物与靶向治疗专委会青年作组常委兼秘书长
山东省医师协会神经内分泌肿瘤专业委员会秘书
山东省医师协会肿瘤科医师分会委员
山东省抗癌协会姑息治疗分会委员
山东省抗癌协会肿瘤临床协作分会委员
山东省临床肿瘤学会临床研究专家委员会委员
山东省临床肿瘤学会转化医学委员会委员
山东省临床肿瘤学会青年理事会委员
承担国家青年自然科学基金1项
在Cancer research等SCI期刊发表多篇文章
靶向治疗篇
2024年1月发表于Nature Medicine的一项关于Divarasib联合西妥昔单抗治疗KRAS G12C突变晚期结直肠癌的1b期试验[1],总计29例患者入组(既往重度经治)。在入组前未接受KRAS G12C抑制剂治疗的24例患者,其中23例接受Divarasib(400mg)联合西妥昔单抗治疗。数据收集截止至2023年4月1日,主要终点为安全性,次要终点是抗肿瘤活性。24例患者中,1例达完全缓解(CR),15例达部分缓解(PR),8例达疾病稳定(SD),客观缓解率(ORR)为62.5%,中位无进展生存(PFS)为8.1个月。所有患者均经历了至少一次治疗相关不良事件(TRAE)(图1),其中大多数事件为1~2级(91.6%)。最常见的TRAEs包括皮疹(96.6%)、腹泻(82.8%)、恶心(72.4%)和呕吐(48.3%)。总体来讲,安全可控。该研究证明了在一定程度上Divarasib联合西妥昔单抗可以克服KRAS G12C抑制剂单药耐药的情况。
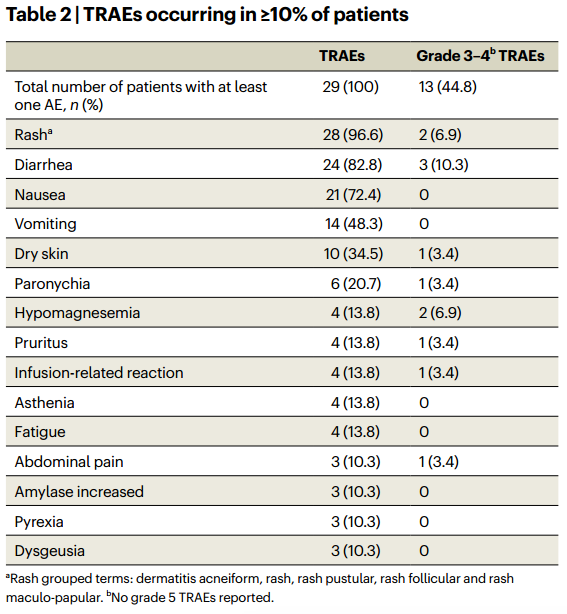 图1 Divarasib联合西妥昔单抗治疗KRAS G12C突变结直肠癌相关TRAEs
图1 Divarasib联合西妥昔单抗治疗KRAS G12C突变结直肠癌相关TRAEs
与前文类似,CodeBreak101的一项子研究于2024年1月见刊Nature Medicine[2],该1b期试验总计纳入48例KRAS G12C突变经治结直肠癌患者进行Sotorasib联合帕尼单抗治疗,8例入组剂量递增队列,40例入组剂量扩展队列。主要终点是安全性和耐受性。次要终点包括疗效和药代动力学。TRAE发生率为94%(45例),≥3级TRAE发生率为27%(13例)。在剂量扩大队列中,确认的客观缓解率为30.0%,中位PFS为5.7个月,中位总生存(OS)为15.2个月(图2)。常见的基因组突变包括APC(84%)、TP53(74%)、SMAD4(33%)、PIK3CA(28%)和EGFR(26%)。研究证明Sotorasib+帕尼单抗在化疗难治性KRAS G12C突变的转移性结直肠癌中显示出可接受的安全性和有希望的疗效[2]。
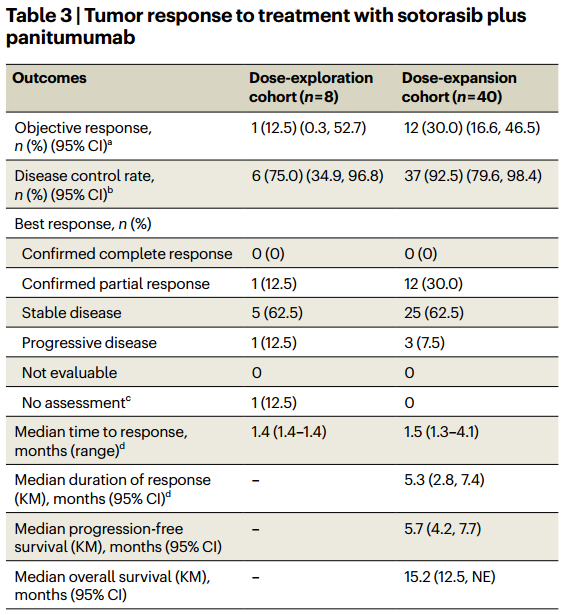 图2 Sotorasib联合帕尼单抗治疗化疗难治性KRAS G12C突变型结直肠癌疗效
图2 Sotorasib联合帕尼单抗治疗化疗难治性KRAS G12C突变型结直肠癌疗效
2024年1月发表于British Journal of Cancer的一项研究则是对晚期结直肠癌患者二线治疗中BRAF或KRAS G12C突变的动态特征进行了探讨[3]。本项研究的数据库总计包含1160名患者,其中49%的病例(n=566)检测到RAS/BRAF突变。KRAS、NRAS和BRAF基因突变频率分别为42%、3%和3%。KRAS突变中以KRAS G12D、G12V、G12C最为常见(分别占总数的8%、7%和3%)。在整个队列中,中位OS为13.6个月,中位PFS为6.6个月。按突变状态细分:携带KRAS G12C和BRAF V600E突变的患者的中位OS分别为10.6 和8.5个月(图3),中位PFS分别为4.8个月和3.8个月。相比之下,野生型肿瘤患者的中位PFS为6.7 , 中位OS为15.8个月。KRAS/BRAF突变状态影响不同的临床特征和对二线治疗方案的不同反应,从而在研究结果中表现出动态效应。
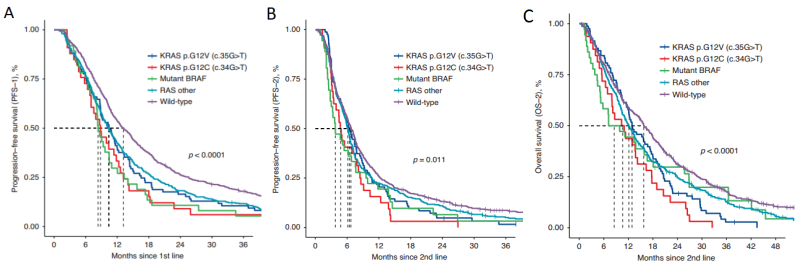 图3 一线(A)和二线治疗(B,C)的无进展生存期和总生存期Kaplan-Meier图。
图3 一线(A)和二线治疗(B,C)的无进展生存期和总生存期Kaplan-Meier图。
2024年4月15日发表于Clinical Cancer Research的一篇研究主要描述了RAS/BRAF共突变和ERBB2拷贝数调节结直肠癌HER2异质性和对HER2靶向治疗的反应[4]。研究结果显示,ERBB2扩增在左半CRC中富集。20%的ERBB2扩增CRC同时存在RAS/RAF突变。RAS/RAF野生型CRC通常具有克隆性ERBB2扩增,但RAS/RAF突变型CRC中ERBB2扩增水平更低且在肿瘤内和病灶间具有更高的异质性(图4)。这些不同的基因组模式导致了患者对HER2靶向治疗的反应和耐药模式不同。ERBB2扩增合并RAS/BRAF突变的CRC对曲妥珠单抗的联合治疗(如曲妥珠单抗+图卡替尼)耐药,但在体外和小鼠模型中对DS-8201仍保持敏感性。DS-8201还在高水平ERBB2扩增合并RAS/RAF共突变的CRC病例中显示出临床疗效。
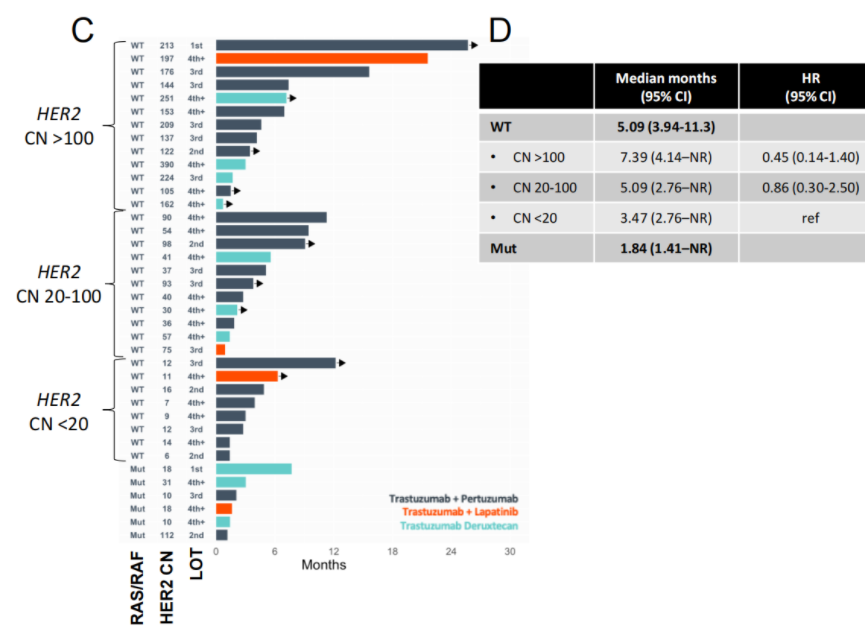
图4 抗HER2治疗至停药时间(TTD)结果汇总
在靶向治疗方面另有一项基于Ⅲ期PARADIGM试验的探索性分析于2024年3月发表在Nature Medicine[5]上,旨在评估ctDNA基因改变与疗效结果之间的关系,重点关注与EGFR抑制剂耐药相关的基因改变。本项研究总计纳入802例患者,在伴有左侧原发肿瘤的RAS野生型mCRC患者中,一线帕尼单抗+mFOLFOX6治疗比贝伐珠单抗+mFOLFOX6治疗的总生存期更长。与贝伐单抗+mFOLFOX6相比,帕尼单抗+mFOLFOX6在负向超选(血浆ctDNA对所有预先指定的基因改变呈阴性,包括BRAF V600E、KRAS、PTEN、EGFR ECD外显子1-16和NRAS的突变、HER2和MET的扩增以及RET、NRTK1和ALK的基因融合)的患者中延长了总生存期(图5,总体人群中位OS:40.7个月 vs 34.4个月),但在伴有上述基因突变的患者中,帕尼单抗组与贝伐单抗组相比没有明显差异(HR=1.13,19.2个月vs 22.2个月),在左半原发肿瘤和右半原发肿瘤中也观察到了类似的结果。因此利用ctDNA进行负向超选或可指导mCRC患者的最佳治疗选择。
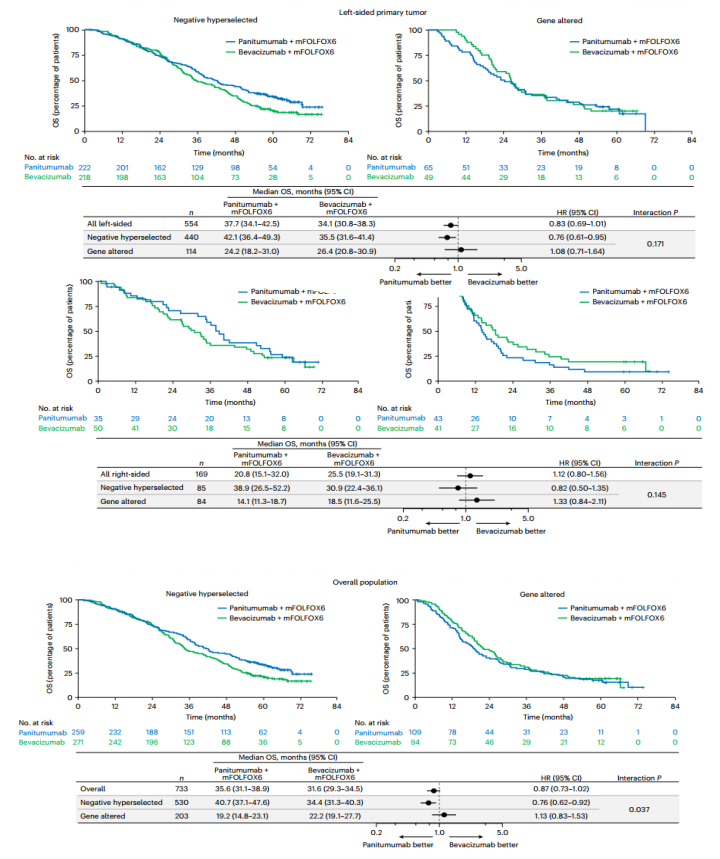
图5 负向超选的OS结果
众所周知,转移性结直肠癌(mCRC)的KRAS突变一直被用作EGFR单抗治疗选择的预测性生物标志物。这项于2024年2月发表在British Journal of Cancer上的研究进行了ARCAD数据库中随机试验的个体患者数据汇总分析[6]。来自8项研究的5675名患者被纳入,所有患者均具有已知的mCRC KRAS状态。KRAS野生型(WT)组EGFR单抗的OS和PFS获益(图6)。在氟尿嘧啶治疗的患者中PFS获益,而含卡培他滨治疗的患者无PFS获益。侧偏性也与EGFR单抗疗效相互作用,生存获益仅限于疾病位于左侧的患者。PFS获益因年龄而异,70岁以下患者获益更大。在KRAS、NRAS或BRAF基因突变的患者中,生存获益并未得到证实。可见KRAS WT mCRC患者从EGFR单抗为基础的治疗中获益与以下几个因素相关:原发肿瘤位置、左半、年轻患者(年龄≤70岁)、无NRAS或BRAF突变。此外观察到联合含氟尿嘧啶为基础的方案中有生存获益。
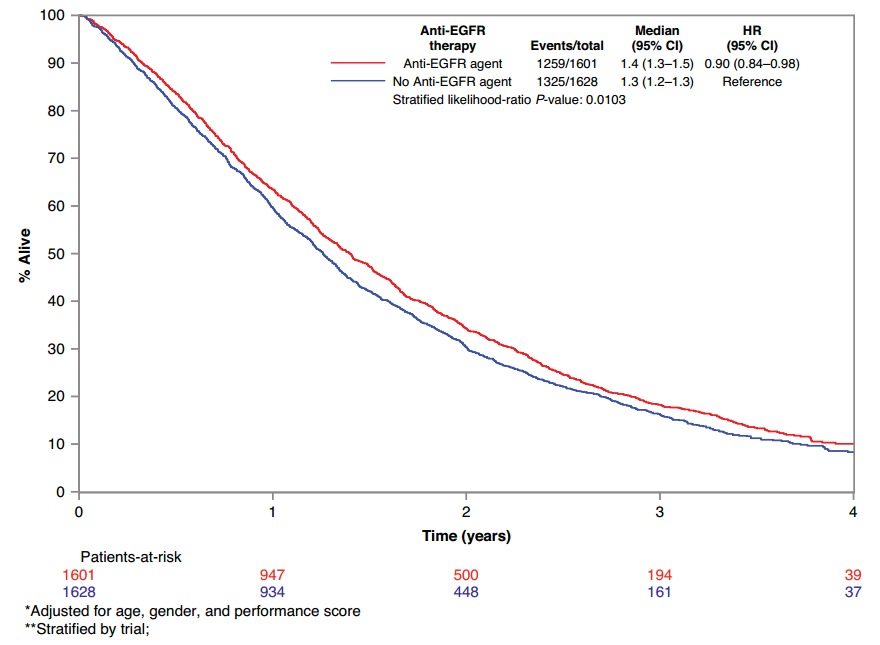
图6 KRAS WT亚组的生存 OS曲线
另有一项III期ERMES研究发表于Journal of Clinical Oncology上,主要探讨了氟尿嘧啶、亚叶酸钙和伊立替康(FOLFIRI)加西妥昔单抗对比西妥昔单抗作为一线治疗RAS和BRAF野生型转移性结直肠癌后的维持治疗的疗效[7]。在这项多中心、开放标签、III期试验中,未经治疗的RAS/BRAF wt mCRC患者被随机1:1分组,A组接受FOLFIRI/西妥昔单抗(FOLFIRI/Cet)治疗8周期,然后继续FOLFIRI/Cet维持治疗,直至疾病进展(A组)B组接受FOLFIRI/Cet进行8个周期,然后单独进行Cet维持治疗,直至疾病进展(B组)。主要终点是改良的符合方案 (mPP)人群的无进展生存期(非劣效)以及安全性。总计606例患者被随机分配,300例分配到A组,306例分配到B组。中位随访时间为22.3个月,在mPP人群中,A组与B组的PFS分别为12.2个月和10个月,OS分别为30.7个月和35.7个月(图7)。ERMES研究未能证明西妥昔单抗单药维持治疗的非劣效性。尽管单药维持治疗具有更有利的安全性特征,仍不能推荐所有患者在FOLFIRI联合西妥昔单抗诱导治疗后接受西妥昔单抗单药维持治疗,但在某些病例中单药维持方案可作为另一种选择。
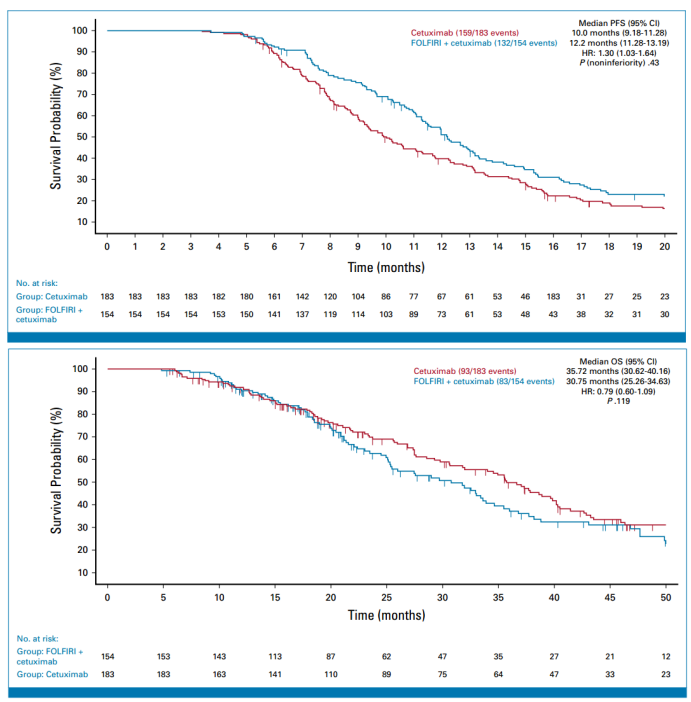
图7 mPP人群的PFS与PS生存曲线
下面这篇系统综述则回顾了抗EGFR再挑战在转移性结直肠癌中的作用,详细描述了从现有数据到未来的发展[8]。这篇综述于2024年3月发表于Cancer Treat Rev上。几项回顾性和II期研究表明,在前期基于抗EGFR的方案失败后,一部分患者仍然可以从进一步的抗EGFR阻断中获益。几项涉及ctDNA分析的转化研究表明,在抗EGFR药物的选择压力下,含有抗EGFR耐药突变的癌症克隆通常在抗EGFR停药后衰减,并可能恢复对这种治疗策略的敏感性。因此,一些回顾性分析和最近的一项前瞻性试验表明ctDNA RAS和BRAF野生型mCRC患者从抗EGFR再挑战中获益最多(图8)。在分子选择的患者中,抗EGFR再挑战策略达到了高达30%的缓解率,无进展生存期超过4个月,总生存期超过1年,与其他标准治疗方案相比,对于重度经治患者是能够显著获益的。与前期治疗相比,抗EGFR再挑战治疗耐受性良好,没有新增的毒性。
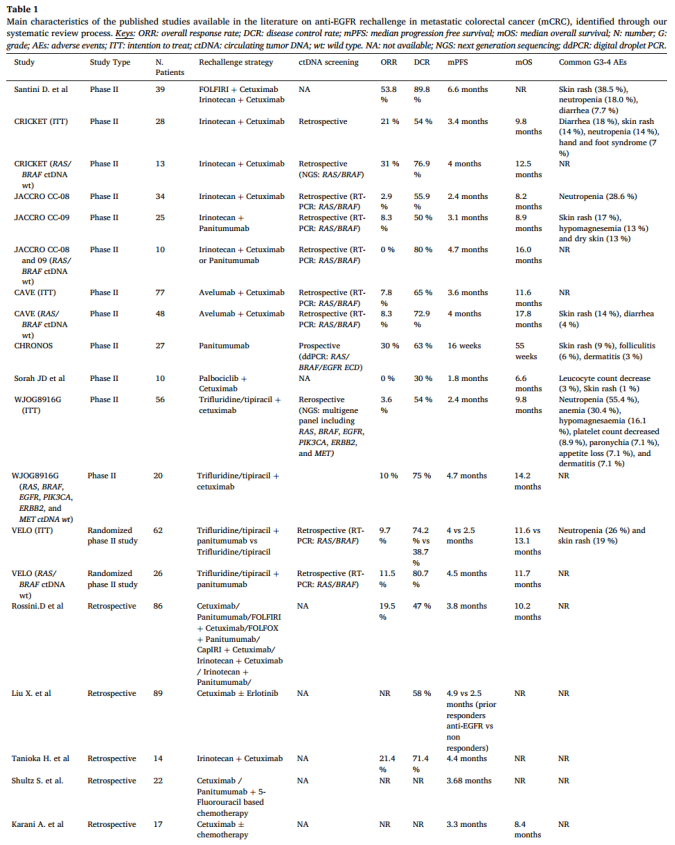
图8 部分mCRC抗EGFR再挑战已发表文献的研究特征
小结
KRAS G12C突变发生于约4%的CRC中,并与不良预后高度相关。许多研究已在进行KRAS G12C抑制剂+抗EGFR单抗双药治疗,整体看来收效良好,双药治疗在一定程度上可以缓解单药KRAS G12C抑制剂治疗带来的耐药问题。双药治疗方案是否一定优于单药治疗目前尚无定论,为使患者获得更高受益,多种治疗方式及药物仍有待深入探索。
对于RAS/BRAF野生型的转移性CRC患者,抗EGFR治疗是治疗全程中非常重要的一环。PARADIGM研究生物标记物分析结果提示ctDNA检测的阴性超选基因可能指导初治mCRC患者选择最佳治疗。而对于重度经治患者,EGFR单抗再挑战的策略应充分根据病人的体力情况、肿瘤负荷、实时基因突变状态、既往治疗史等进行综合判断。
下篇预告:王健教授:免疫治疗篇——结直肠癌近期顶刊研究文献梳理与解读
[1]. Desai J et al., Divarasib plus cetuximab in KRAS G12C-positive colorectal cancer: a phase 1b trial. Nat Med. 2024 Jan;30(1):271-278.
[2]. Kuboki Y et al., Sotorasib with panitumumab in chemotherapy-refractory KRASG12C-mutated colorectal cancer: a phase 1b trial. Nat Med. 2024 Jan;30(1):265-270.
[3]. Contreras-Toledo D et al., Dynamic nature of BRAF or KRAS p.G12C mutations in second-line therapy for advanced colorectal cancer patients: do early and late effects exist? Br J Cancer. 2024 Mar;130(5):777-787.
[4]. Singh H et al., RAS/RAF Comutation and ERBB2 Copy Number Modulates HER2 Heterogeneity and Responsiveness to HER2-directed Therapy in Colorectal Cancer. Clin Cancer Res. 2024 Apr 15;30(8):1669-1684.
[5]. Shitara K et al., Baseline ctDNA gene alterations as a biomarker of survival after panitumumab and chemotherapy in metastatic colorectal cancer. Nat Med. 2024 Mar;30(3):730-739.
[6]. Karapetis CS et al., Fluoropyrimidine type, patient age, tumour sidedness and mutation status as determinants of benefit in patients with metastatic colorectal cancer treated with EGFR monoclonal antibodies: individual patient data pooled analysis of randomised trials from the ARCAD database. Br J Cancer. 2024 May;130(8):1269-1278.
[7]. Pinto C et al., Fluorouracil, Leucovorin, and Irinotecan Plus Cetuximab Versus Cetuximab as Maintenance Therapy in First-Line Therapy for RAS and BRAF Wild-Type Metastatic Colorectal Cancer: Phase III ERMES Study. J Clin Oncol. 2024 Apr 10;42(11):1278-1287.
[8]. Ciardiello D et al. The role of anti-EGFR rechallenge in metastatic colorectal cancer, from available data to future developments: A systematic review. Cancer Treat Rev. 2024 Mar;124:102683.
排版编辑:肿瘤资讯-小编











 苏公网安备32059002004080号
苏公网安备32059002004080号


