
中山大学肿瘤防治中心 血液肿瘤科 副主任医师,硕士生导师
广东省预防医学会血液肿瘤防治专业委员会委员
广东省医疗安全协会血液病分会委员
广东省女医师协会血液分会委员会委员
广州抗癌协会肿瘤化疗专业委员会委员
广州健康管理学会血液病专业委员会委员
HGMWG骨髓瘤工作组成员
广东省慢淋工作组成员
目前主要从事血液肿瘤的精准诊疗及免疫代谢转化研究
近5年以第一/通讯作者(含并列)发表SCI论文20余篇,10分以上3篇,5分以上11篇;累计总影响因子120+,包括Cinical Cancer Rsearch, Leukemia, Cancer, Cancer Immunol Immunother, Therapeutic Advanves in Medical Oncology等杂志
部分研究成果曾获ASH、CSCO会议的口头汇报邀请及摘要展示
主持国自然青年基金、广东省自然科学面上基金、广州市基础与应用基础研究等项目
作为Sub-I参与多项血液肿瘤研究者发起及新药临床研究
多发性骨髓瘤(MM)作为起源于浆细胞的血液恶性肿瘤,至今仍是一种无法治愈的疾病。自20世纪80年代,自体造血干细胞移植(ASCT)技术使得MM患者的生存得以延长1,2。ASCT也被国内外指南确定为适合移植患者的标准治疗。随着新药的引入以及MM治疗模式的改变,MM的治疗疗效得到进一步提高,部分患者的生存时间甚至超过10年3,4。然而,ASCT在新药时代MM治疗中的地位也面临挑战。
仅含一种一代新药方案vs.含一种一代新药诱导+ASCT巩固
——ASCT屹立不倒
目前,一代新药诱导治疗后序贯ASCT的临床研究数据表明,ASCT治疗MM患者的无进展生存(PFS)仍有明显获益。在仅包含一种一代新药来那度胺的方案挑战ASCT获益的临床试验中,意大利的一项III期研究表明:在接受来那度胺联合地塞米松(Rd)诱导治疗的患者中,后续双移植对比美法伦、泼尼松、来那度胺(MPR)治疗6个周期,具有明显的PFS及OS获益。双移植治疗的PFS明显延长(mPFS 43 vs. 22.4个月,HR = 0.44,P < 0.001), OS亦显著改善(4年OS率:81.6% vs. 65.3%,HR = 0.55,P = 0.02)5。在欧洲骨髓瘤工作组的另一项类似III期试验中,患者在接受4个周期的Rd诱导治疗后,被随机分配到6个周期的环磷酰胺、来那度胺和地塞米松(CRd)治疗组或ASCT治疗组。结果同样支持ASCT显著优于CRd(PFS:mPFS 42 vs. 28个月,HR = 0.67,P = 0.014;OS:4年OS率 87% vs. 71%,HR = 0.51,P = 0.028)6。以上结果提示仅包含一种一代新药来那度胺的方案(Rd、MPR、CRd)仍次于目前诱导+ASCT巩固的治疗模式。而在仅包含另一种一代新药硼替佐米诱导方案的EMN02/HOVON95研究中,VCd诱导后,ASCT与VMP的对比结果,同样支持了ASCT治疗组的PFS显著改善(56.7 vs. 41.9个月,HR = 0.73,P = 0.0001),这种改善在高危骨髓瘤中更加明显,甚至对高危骨髓瘤,双次移植可一进步改善患者的PFS。然而,在中位随访60.5个月后,ASCT仅对高危骨髓瘤患者有统计学差异的OS改善,在ITT人群中并未观察到统计学差异的获益(5年OS率: 75.1% vs. 71,6%)7。
RVd方案 vs. RVd方案诱导+ASCT巩固
——+/-ASCT引发争议
目前,两种一代新药的联合RVd方案已成为骨髓瘤一线诱导治疗的优选。那么,两种一代新药联合方案挑战ASCT的战绩又是如何呢?在IFM 2009 III期临床试验中,700名患者被随机分配到3个周期的RVd诱导治疗,序贯ASCT及2个周期的RVd巩固,或8个周期RVd的持续治疗组。两组患者均在后续接受来那度胺维持治疗1年。在中位随访44个月的第二次中期分析中,移植组显示出显著的PFS获益(mPFS:50 vs. 36个月;HR = 0.70;P < 0.001) 8。然而,中位随访89.8个月后,移植组和单纯RVd组仍分别有62.2%和60.2%的患者存活,两组的PFS2及OS并没有观察到任何统计学上的差异9。部分学者认为:这可能是因为RVd治疗组中有76.7%的患者在复发时接受了ASCT,从而导致了OS上的无差异。因此,这引发了早期移植与晚期移植之争。目前认为,在两种一代新药的联合RVd方案治疗中,尽管早期移植可能不会带来OS上的获益,但因其带来的显著PFS延长,以及可避免失去移植机会的风险,仍为大多数适合移植患者的优选。

IFM 2009 更新随访数据:尽管ASCT组仍有明显PFS获益,OS无差异。(图片来源:2022 ASCO)
但随着今年6月DETERMINATION研究的公布,这个OS上无统计学差异的解释又引起争议。DETERMINATION研究可认为是IFM2009的平行确证试验,患者在3个周期的RVd治疗后随机进入ASCT序贯2周期RVd组或5周期单纯RVd组,两组后续均继续接受R 10/15 mg/天维持治疗直至疾病进展或不耐受。在中位随访76个月时,与单纯RVd组对比,移植组的中位PFS明显延长(非移植组 vs 移植组:46.2个月 vs. 67.5个月, HR 1.53;p<0.0001)。但两组(非移植组 vs 移植组)的ORR(95.0% vs 97.5%)、≥VGPR(79.6% vs 82.7%)和≥CR(42.0% vs 46.9%)的比例相似。移植组维持治疗初始的MRD阴性率更高(移植组vs.非移植组:54.4% vs 39.8%),但两组MRD阴性患者的5年PFS率相似(移植组vs.非移植组:53.5% vs 59.2%)。这证明了骨髓瘤一线,早期ASCT的长期PFS获益及维持治疗的临床获益10。然而,移植组明显增高的毒性而OS方面没有获益同样引发了今年ASCO上对移植选择的热烈讨论(2022 ASCO LBA4)。与IFM2009不同的是,DETERMINATION研究中仅有28%的单纯RVd治疗组在复发后接受ASCT治疗,移植治疗至少影响患者3个月的生活质量,ASCT所用的大剂量马法兰同样增加了MDS/AML的风险11。更重要是,随着大量二代PI,IMids、单抗、双抗、CART的问世,早期更有效的诱导治疗(包括4药组合)可带来更深的缓解深度,持续维持可进一步加深缓解,这或许可使患者无需ASCT就达到深度缓解,而弥补与ASCT相差的长期PFS获益?
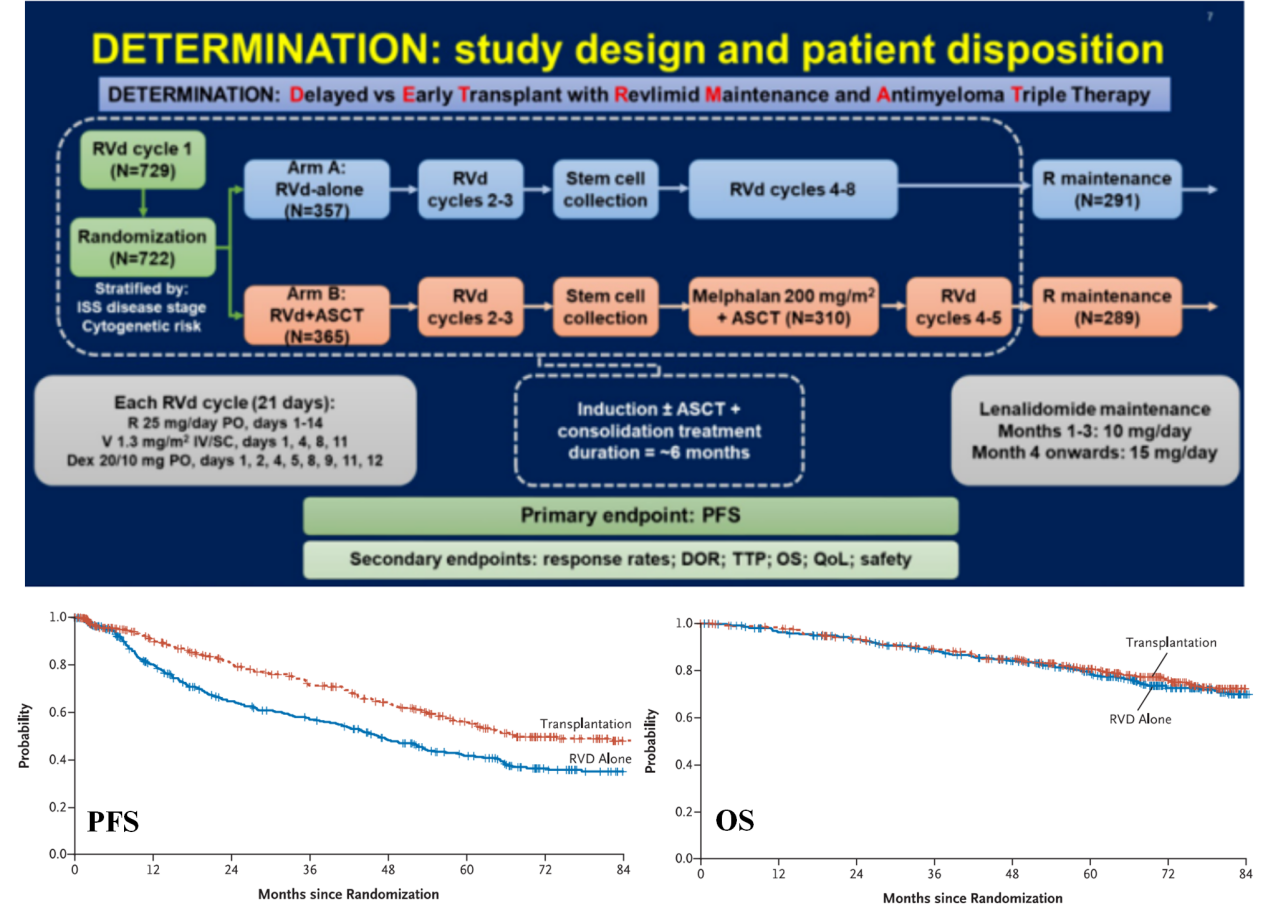
DETERMINATION研究:仅有28%的单纯RVd治疗组在复发后接受ASCT治疗,ASCT治疗组较RVd组仍仅有PFS获益,而无OS延长。(图片来源 2022 ASCO 及N Engl J Med.2022 Jun 5.doi:10.1056/NEJMoa2204925)
二代新药方案 vs. 二代新药方案诱导+ASCT巩固——弱化ASCT未来可期
随着MM治疗靶点的研发,不少二代新药陆续问世,CD38单抗在深度缓解上有更强的优势。然而,在不适合移植的人群中MAIA研究中DRd方案的MRD阴性率为31%12,ALCYONE研究中DVMP方案的MRD阴性率达28%13。而在适合移植的人群中,CASSIOPEIA研究DVTd诱导治疗后的MRD阴性率仅为9%,移植及DVTd巩固后的MRD阴性率可达34%,诱导+移植巩固后继续Dara维持的MRD阴性率为64.2%14。GRAFFIN研究中,DVRd诱导治疗后MRD阴性率为21.2%15,进一步移植及DVRd巩固结束后的MRD阴性率为50%,继续2年DR维持治疗后的MRD阴性率为64.4%16。对于高危骨髓瘤患者,MASTER研究同样提示了ASCT对越高危的患者影响越大,超高危(包含2个及以上高危细胞遗传学异常)患者ASCT前NGS MRD阴性为10%,ASCT后MRD阴性为43%17。UK OPTIMUM/MUKnine研究中,超高危/浆白患者在接受至少6疗程Dara-CVRd诱导后的MRD阴性率为41%,而ASCT100-120天后的MRD阴性率为64%18。尽管目前暂无此类含单抗类新药方案+/-ASCT的头对头探索,这些数据提示包含CD38单抗诱导治疗后仍有通过ASCT进一步加深缓解的空间,但持续治疗也可继续加深缓解,能否通过包含CD38单抗的巩固治疗替代ASCT仍值得探索。在另一项包含二代新药卡非佐米的方案作为诱导治疗的UNITO-MM-01/FORTE研究中,474名患者被随机分配为三组,分别接受以下治疗:(1)4个周期的KRd序贯ASCT及4周期KRd巩固;(2)4个周期的KCd序贯ASCT及4个周期的KCd巩固;(3)12个周期的KRd。结果显示:中位随访50.9个月后,KRd+ASCT组的中位PFS显著长于KRd12疗程组及KCd+ASCT组(mPFS分别为:未达到 vs. 55.3个月, 53个月)19。与KRd12疗程组相比,KRd-ASCT组有显著降低进展或死亡的风险(HR=0.61,p=0.0084) 19,提示目前含一种二代PI卡非佐米的治疗方案中,增加ASCT仍有明显获益。然而,另外两个治疗组的对比,KRd12疗程组和KCd-ASCT组在PFS方面无显著差异,且在获得1年持续MRD阴性的患者中,三组的PFS相似19。这意味着更有效的治疗方案可获得更深的缓解,甚至达到持续MRD阴性,可能会逐渐动摇ASCT本来坚不可摧的地位。目前,部分包含二代新药的四药联合方案,在MRD阴性率方面展示出显著的优势,在GMMG-HD7研究中,Isatuximab联合RVd方案在诱导结束时移植前的MRD阴性率甚至高达50.1%20。而在强强联手的GMMG-CONCEPT研究中,对高危患者使用Isa-KRd诱导治疗期间评估的NGF MRD阴性率亦高达61%21。使我们有足够信心对新药时代通过加深缓解弱化ASCT作用的可能性充满期待。
综上所述,基于目前多项研究中ASCT联合治疗组可带来的明显PFS获益,一线诱导后加上自体移植、巩固的治疗模式仍是适合移植患者,尤其是高危骨髓瘤患者的一类推荐。然而,随着更有效的新一代药物出现以及四药联合诱导方案的推进(如Dara-VRd、Isa-VRd或Dara-KRd、Isa-KRd或后续BCMA-ADC、甚至双抗的治疗前移),这些治疗模式可能带来更深的缓解深度,从而弱化ASCT的意义。而以MRD阴性为导向的评价标准可能为MM人群更精准的个体化治疗提供指引。
1 Brenner, H., Gondos, A. & Pulte, D. Recent major improvement in long-term survival of younger patients with multiple myeloma. Blood 111, 2521-2526, doi:10.1182/blood-2007-08-104984 (2008).
2 Kumar, S. K. et al. Improved survival in multiple myeloma and the impact of novel therapies. Blood 111, 2516-2520, doi:10.1182/blood-2007-10-116129 (2008).
3 Corre, J. et al. Improved survival in multiple myeloma during the 2005-2009 and 2010-2014 periods. Leukemia 35, 3600-3603, doi:10.1038/s41375-021-01250-0 (2021).
4 Nishimura, K. K. et al. Long-term outcomes after autologous stem cell transplantation for multiple myeloma. Blood Adv 4, 422-431, doi:10.1182/bloodadvances.2019000524 (2020).
5 Palumbo, A. et al. Autologous transplantation and maintenance therapy in multiple myeloma. N Engl J Med 371, 895-905, doi:10.1056/NEJMoa1402888 (2014).
6 Gay, F. et al. Chemotherapy plus lenalidomide versus autologous transplantation, followed by lenalidomide plus prednisone versus lenalidomide maintenance, in patients with multiple myeloma: a randomised, multicentre, phase 3 trial. Lancet Oncol 16, 1617-1629, doi:10.1016/S1470-2045(15)00389-7 (2015).
7 Cavo, M. et al. Autologous haematopoietic stem-cell transplantation versus bortezomib-melphalan-prednisone, with or without bortezomib-lenalidomide-dexamethasone consolidation therapy, and lenalidomide maintenance for newly diagnosed multiple myeloma (EMN02/HO95): a multicentre, randomised, open-label, phase 3 study. Lancet Haematol 7, e456-e468, doi:10.1016/S2352-3026(20)30099-5 (2020).
8 Attal, M. et al. Lenalidomide, Bortezomib, and Dexamethasone with Transplantation for Myeloma. N Engl J Med 376, 1311-1320, doi:10.1056/NEJMoa1611750 (2017).
9 Perrot, A. et al. Early Versus Late Autologous Stem Cell Transplant in Newly Diagnosed Multiple Myeloma: Long-Term Follow-up Analysis of the IFM 2009 Trial. Blood 136, 39, doi:https://doi.org/10.1182/blood-2020-134538 (2020).
10 Richardson, P. G. et al. Triplet Therapy, Transplantation, and Maintenance until Progression in Myeloma. N Engl J Med, doi:10.1056/NEJMoa2204925 (2022).
11 Radivoyevitch, T. et al. Risk of acute myeloid leukemia and myelodysplastic syndrome after autotransplants for lymphomas and plasma cell myeloma. Leuk Res 74, 130-136, doi:10.1016/j.leukres.2018.07.016 (2018).
12 Nizar B. et al. Daratumumab Plus Lenalidomide and Dexamethasone (D-Rd) Versus Lenalidomide and Dexamethasone (Rd) in Patients with Newly Diagnosed Multiple Myeloma (NDMM) Ineligible for Transplant: Updated Analysis of Maia. 2019 ASH Annual Meeting. Abstract 1875.
13 Mateos, M. et al. Daratumumab Plus Bortezomib, Melphalan, and Prednisone Versus Bortezomib, Melphalan, and Prednisone in Patients with Transplant-Ineligible Newly Diagnosed Multiple Myeloma: Overall Survival in Alcyone. 2019 ASH Annual Meeting. Abstract Oral 859.
14 Herve A. L, et al. Daratumumab (DARA) with Bortezomib, Thalidomide, and Dexamethasone (VTd) in Transplant-Eligible Patients (Pts) with Newly Diagnosed Multiple Myeloma (NDMM): Analysis of Minimal Residual Disease (MRD) Negativity in Cassiopeia Part 1 and Part 2. 2021 ASH Annual Meeting. Abstract Oral 82.
15 Voorhees, P. M. et al. Daratumumab, lenalidomide, bortezomib, and dexamethasone for transplant-eligible newly diagnosed multiple myeloma: the GRIFFIN trial. Blood 136, 936-945, doi:10.1182/blood.2020005288 (2020).
16 Jacob P. L, et al. Daratumumab (DARA) Plus Lenalidomide, Bortezomib, and Dexamethasone (RVd) in Patients (Pts) with Transplant-Eligible Newly Diagnosed Multiple Myeloma (NDMM): Updated Analysis of Griffin after 24 Months of Maintenance. 2021 ASH Annual Meeting. Abstract Oral 79.
17 Costa, L. J. et al. Daratumumab, Carfilzomib, Lenalidomide, and Dexamethasone With Minimal Residual Disease Response-Adapted Therapy in Newly Diagnosed Multiple Myeloma. J Clin Oncol, JCO2101935, doi:10.1200/JCO.21.01935 (2021).
18 Kaiser, M. F. et al. Daratumumab, Cyclophosphamide, Bortezomib, Lenalidomide, Dexamethasone (Dara-CVRd), V-Augmented Autologous Stem Cell Transplant (V-ASCT) and Dara-Vrd Consolidation in Ultra-High Risk (UHiR) Newly Diagnosed Myeloma (NDMM) and Primary Plasma Cell Leukemia (pPCL) Compared with Myeloma XI/XI+ Trial Treatment for Uhir MM: The UK Optimum/Muknine Trial. Blood 138, 465-465, doi:10.1182/blood-2021-144990 %J Blood (2021).
19 Gay, F. et al. Carfilzomib with cyclophosphamide and dexamethasone or lenalidomide and dexamethasone plus autologous transplantation or carfilzomib plus lenalidomide and dexamethasone, followed by maintenance with carfilzomib plus lenalidomide or lenalidomide alone for patients with newly diagnosed multiple myeloma (FORTE): a randomised, open-label, phase 2 trial. Lancet Oncol 22, 1705-1720, doi:10.1016/S1470-2045(21)00535-0 (2021).
20 Goldschmidt, H. et al. Addition of Isatuximab to Lenalidomide, Bortezomib and Dexamethasone As Induction Therapy for Newly-Diagnosed, Transplant-Eligible Multiple Myeloma Patients: The Phase III GMMG-HD7 Trial. Blood 138, 463-463, doi:10.1182/blood-2021-145097 %J Blood (2021).
21 Leypoldt, L. B. et al. Isatuximab, carfilzomib, lenalidomide, and dexamethasone (Isa-KRd) in front-line treatment of high-risk multiple myeloma: interim analysis of the GMMG-CONCEPT trial. Leukemia 36, 885-888, doi:10.1038/s41375-021-01431-x (2022).












 苏公网安备32059002004080号
苏公网安备32059002004080号


