2022年4月13日,Turning Point Therapeutics公布了其新一代ROS1/TRK酪氨酸激酶抑制剂(TKI)Repotrectinib,治疗ROS1融合阳性晚期非小细胞肺癌(ROS1+ 晚期NSCLC)的关键临床试验TRIDENT-1基于独立中心影像(BICR)评估的最新顶线结果,在ROS1 TKI初治和经治4个患者队列中均取得积极结果。
为了及时向读者传递前沿、解读热点,本报特邀TRIDENT-1研究的中国主要研究者(Leading PI)上海交通大学附属胸科医院陆舜教授,就该研究的更新数据进行解读。
国家卫生健康突出贡献中青年专家
上海市领军人才
上海市优秀学术带头人
国家重点专项首席专家
国务院特殊津贴获得者
上海交通大学附属胸科医院
上海市肺部肿瘤临床医学中心主任
中国抗癌协会理事
肺癌专业委员会前任主任委员
中国临床肿瘤学会(CSCO)常务理事
希斯科基金会副理事长
DIA中国区顾问委员会副主席
上海市医学会肿瘤学会前任主任委员
中华医学会肿瘤学会委员
肺癌专业委员会主任委员
上海市医师协会肿瘤科分会副会长、专科规培组长
国际肺癌研究会(IASLC)出版委员会委员
美国临床肿瘤协会(ASCO)中国区代表
国际肺癌研究会官方杂志Journal of Thoracic Oncology副主编
The Oncologist杂志编委
上海市抗癌协会常务理事
中国医药生物技术协会精准医疗分会副主任委员
研究简介
研究背景
Repotrectinib是具有紧凑三维大环结构的TKI,能精准铆合到ATP结合位点。体外研究已证实其对野生型ROS1的抑制作用强于克唑替尼和恩曲替尼(IC50 <0.2nM),对包括SFM G2032R在内的ROS1耐药突变有效(IC50 3.3nM)。2019年美国临床肿瘤学会(ASCO)年会中,TRIDENT-1研究(NCT03093116)首次亮相国际舞台,Ⅰ期研究数据显示了Repotrectinib在ROS1+晚期NSCLC和NTRK+晚期实体瘤患者中令人鼓舞的临床有效率。其后,2020年世界肺癌大会(WCLC)和2021年国际分子靶向与癌症治疗学研讨会(AACR-NCI-EOTRT)上,TRIDENT-1研究分别更新了ROS1 TKI初治人群(EXP-1队列)和ROS1 TKI经治人群(EXP-2、EXP-3和EXP-4队列)的Ⅱ期扩展队列初步数据。
研究方法
Repotrectinib Ⅱ期研究推荐剂量(RP2D)为160 mg qd、持续14天,若可耐受,则加量至160 mg bid。目前,TRIDENT-1研究正在全球范围内(包括中国)积极招募ROS1+ 晚期NSCLC和NTRK 1/2/3融合阳性晚期实体瘤患者进入Ⅱ期研究的6个扩展队列(见下表)。主要终点为经BICR确认的客观缓解率(cORR)(依据RECIST v1.1标准)。此次公布了该I/Ⅱ期研究中ROS1+晚期NSCLC各队列基于BICR评估的顶线数据。
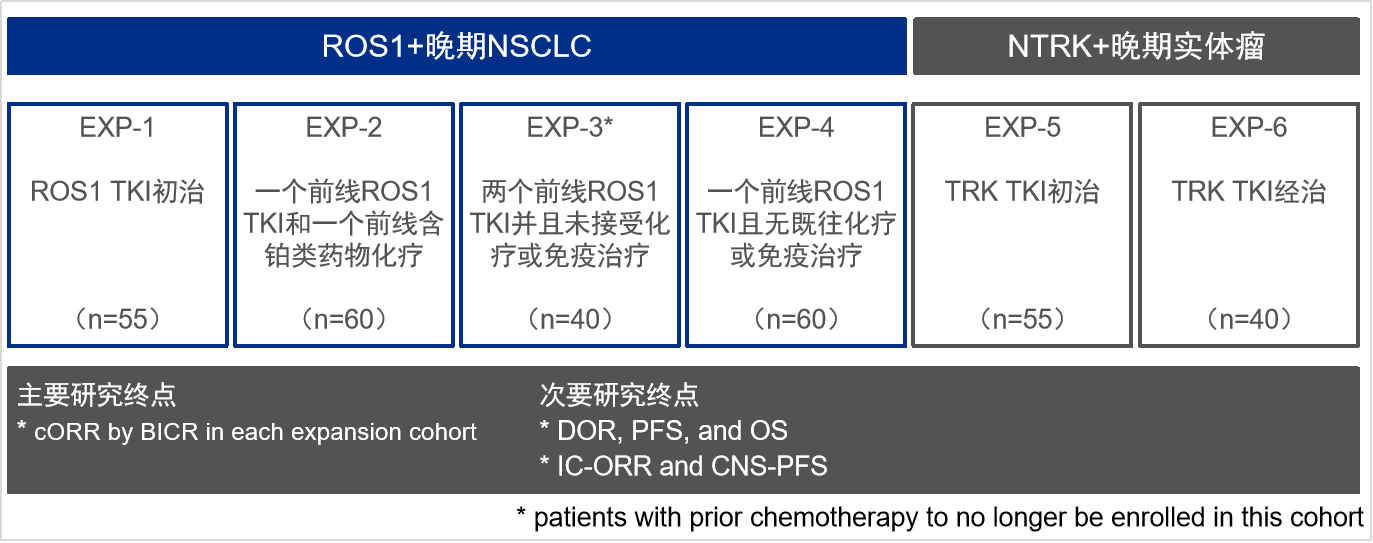
*基于方案修定案第11版,EXP-1队列更新为n=110例
图1:TRIDENT-1研究Ⅱ期扩展队列
研究结果
数据截至2022年2月11日,纳入汇总分析的Ⅰ/Ⅱ期患者为服用过至少一次Repotrectinib,且随访时间超过4个月,获得缓解的患者绝大部分已接受至少6个月的应答持续时间(DOR)随访,患者获得的客观缓解(CP或PR)均为BICR评估并经过后续>28天缓解确认(cORR)。
ROS1 TKI初治队列(EXP-1):纳入71例患者,经BICR评估的cORR达79%,4例患者(6%)达到完全缓解(CR),52例患者(73%)达到部分缓解(PR)。此外还有1例患者在数据截止时已达到PR,尚未得到确认。中位随访时间为10.2个月,中位DOR数据(范围:1.4+月- 35.1+月)和中位无进展生存(PFS)还未成熟(范围:0+月- 40.4+月),随访12个月时的DOR率和PFS率分别为85%和82%,18个月时的DOR率和PFS率分别是76%和72%。

图2:EXP-1:ROS1 TKI初治队列经BICR评估的cORR数据
1个前线ROS1 TKI + 1个前线化疗的经治队列(EXP-2):纳入26例患者,经BICR评估的cORR达42%(95% CI:23, 63),DOR范围为3.6月- 18.3+月。
2个前线ROS1 TKI并且未接受化疗或免疫治疗的经治队列(EXP-3):纳入18例患者,经BICR评估的cORR为28%(95% CI:10, 54),DOR范围为1.9+月- 20.3+月。
1个前线ROS1 TKI并且未接受化疗或免疫治疗的经治队列(EXP-4):纳入56例患者,经BICR评估的cORR为36%(95% CI:23, 50),DOR范围为1.9+月- 17.8月。



图3:EXP-2,3,4:ROS1 TKI经治队列经BICR评估的cORR数据
伴G2032R耐药突变的ROS1 TKI经治人群:共有17例患者基线伴G2032R溶剂前沿突变,经BICR评估的cORR达59%(95% CI:33, 82),DOR范围为1.9+月- 20.3+月。

图4:ROS1 TKI经治队列中基线伴G2032R突变患者的cORR数据
安全性分析纳入了Ⅰ期和Ⅱ期接受过至少一剂Repotrectinib治疗的ROS1融合阳性晚期NSCLC、NTRK融合阳性实体瘤及ALK融合阳性晚期NSCLC的共计380例患者,Repotrectinib的耐受性普遍良好。治疗相关不良事件(TRAEs)主要为1~2 级,无4~5级TRAEs发生。头晕是最常见的不良反应,发生率为61%,其中76%(175/230)的头晕为1级。治疗相关的谷丙转氨酶(ALT)和谷草转氨酶(AST)升高的发生率分别为15.5%和15.3%,绝大多数为低级别(CTC AE 1级)。10%患者因治疗出现的不良事件(TEAE)导致治疗终止。

图5:TRIDENT-1研究I期和II期安全性数据汇总分析
研究结论
TIDENT-1研究在ROS1 TKI初治和ROS1 TKI经治4个患者队列中,经BIRC评估,均取得积极顶线结果。Turning Point Therapeutics计划近期与美国食品药品监督管理局(FDA)讨论递交ROS1+ NSCLC新药申请(NDA)事宜。
专家视角
ROS1融合虽罕见但不应被忽视,仍存在巨大的临床需求
ROS1融合阳性在东亚NSCLC患者中发生率约2%~3%,多见于肺腺癌。尽管总体发生率低,考虑到我国NSCLC患者基数庞大,这部分患者不应被忽视。ROS1融合是EGFR、ALK等NSCLC常见靶点之外最早有靶向药物获批的罕见靶点。目前国际上获批用于治疗ROS1+NSCLC的TKI仅有克唑替尼和恩曲替尼(Entrectinib)两种,国内批准的仅有克唑替尼一种,药物种类及可及性对于中国的ROS1融合NSCLC患者均十分有限。此外考虑到近40%的ROS1+ NSCLC诊断时已发生脑转移,中国患者伴肝功能异常的比例更高,这些因素均制约着ROS1+ NSCLC患者的临床治疗选择。且靶向治疗一旦耐药,目前仍缺乏有效的药物接力后续治疗,如克唑替尼耐药后,超过40%的患者会发生G2032R溶剂前沿突变,目前仍没有上市靶向药物满足这部分患者需求。CSCO指南对ROS1+ NSCLC的TKI治疗失败后的推荐仍然为化疗,这部分患者仍存在着巨大的临床需求。
TRIDENT-1研究结果喜人,Repotrectinib为ROS1+ NSCLC带来新希望
从此次公布的TRIDENT-1研究数据我们看到,不论是ROS1 TKI初治还是经过不同前序治疗的ROS1 TKI经治人群,Repotrectinib均显示出了积极的临床有效率和可靠的安全性。
在研究扩大样本后,且经BICR评估,71例TKI初治人群cORR达79%,考虑到1例未确认的PR,Repotrectinib的cORR可能超80%,这在目前各ROS1 TKI关键性数据是非常亮眼的成绩。mDOR目前还未成熟,随访12个月时的DOR率达85%。在临床最关心的生存数据上,Repotrectinib的mPFS数据还需等待。已获批的克唑替尼和恩曲替尼mPFS分别能达到19.2个月和15.7个月,恩曲替尼12个月随访PFS率为55%。对标现有标准治疗,Repotrectinib的12个月随访PFS率达82%,显示出较好的生存获益趋势,我们也非常期待Repotrectinib能进一步延长ROS1+ NSCLC患者生存。
TRIDENT-1研究设计特别之处在于,将ROS1 TKI经治人群区分为不同队列进行入组(EXP-2,3,4),经BICR评估的cORR分别能达到42%,28%和36%。Repotrectinib在不同的ROS1 TKI经治人群中均显示了积极的临床疗效。从目前有限的数据看,前序接受1个TKI治疗的人群相比2个TKI治疗史的人群,Repotrectinib的获益趋势更大,随着ROS1 TKI药物开发的发展,患者将获得更多的TKI药物选择,这仍需要我们在未来临床中探索对药物使用的最佳线数。更让人振奋的是,在最常见的G2032R溶剂前沿突变中,Repotrectinib的cORR高达59%,且有应答的患者在EXP-2, 3, 4队列中均观察到,提示Repotrectinib对G2032R的疗效可能与前序治疗线数无关。
安全性方面,Repotrectinib研究的样本量很大,高达380例,数据依然保持了良好的耐受性。TRAEs主要为1~2级,最常见的不良反应是低级别头晕,且目前没有因头晕导致患者的治疗终止。肝毒性的级别低且发生率不高,对中国患者是利好的信号。
Repotrectinib有望成为ROS1+ NSCLC丰富一线治疗选择、填补后线治疗空白的全程管理“武器”。一方面,随着研究样本量的继续增加和随访时间延长,我们也共同期待Repotrectinib在脑转移人群、生存数据、其他耐药位点等方面的更多亮眼数据;另一方面,本中心带领其他30家中心也加入到了TRIDENT-1中国大陆的入组中,也为此次的亮眼的结果贡献了力量。中国大陆包括ROS1+ NSCLC、NTRK+实体瘤在内的部分队列仍在入组中,随着研究推进和数据成熟,我们希望尽早看到中国亚组人群的数据。我们相信中国人群的数据在未来更能帮助中国的临床医生了解Repotrectinib这个新一代ROS1/TRK TKI,惠及患者。
Repotrectinib新药申请在即,望早日惠及更多患者
Repotrectinib从研发伊始就一直受到普遍关注。我们非常高兴看到再鼎医药与Turning Point 公司合作,将好的创新药尽早惠及中国患者。美国FDA已先后授予Repotrectinib 共4项快速通道(Fast Track)资格,以及2项突破性疗法认证(BTD)。快速通道认证包括
治疗未接受过ROS1 TKI治疗的ROS1+晚期NSCLC(EXP-1队列);
治疗既往接受过1个前线铂类药物化疗和1个前线ROS1 TKI治疗的ROS1+晚期NSCLC(EXP-2队列);
治疗既往1个前线ROS1 TKI并且未接受化疗或免疫治疗的ROS1+晚期NSCLC(EXP-4 队列);
治疗既往接受过1个或2个前线TRK TKI治疗的NTRK+晚期实体瘤患者(EXP-6队列)。
EXP-1和EXP-6还分别获得了突破性疗法(BTD)认证,这足见临床需求的迫切性。2022年1月,Repotrectinib也获得国家药品监督管理局药品审评中心(CDE)授予的突破性治疗(BTD)认定,用于未接受过ROS1 TKI治疗的ROS1+NSCLC患者。我们已经看到了Repotrectinib的临床价值,中国大陆TRIDENT-1研究的部分队列仍在入组中,也希望有更多合适的患者加入研究,从中获益。期待中国TRIDENT-1研究早日开花结果,早日惠及中国广大ROS1+ NSCLC以及NTRK+实体肿瘤病患!
1. https://www.tptherapeutics.com/events-and-presentations/presentations
2. WCLC 2020. Abstract 3255.
3. Robet C. Doebele et al. ASCO 2020. Abstract#TPS9637.
4. Gainor JF et al. J Clin Oncol: Precision Oncol 2017.
5. Wu YL et al., J Clin Oncol 2018;36:1405-11.
6. Dziadziuszko R. J Clin Oncol . 2021 Apr 10;39(11):1253-1263.
ZMCNNP20220415004
Expire Date 2023/04/15
排版编辑:肿瘤资讯-张欣明











 苏公网安备32059002004080号
苏公网安备32059002004080号


