由中华医学会肿瘤分会乳腺肿瘤学组主办的《新见》栏目,聚焦学术前沿进展,梳理文献研究精粹,关注国际会议热点,意在拓宽科研探索的思路,传递乳腺肿瘤领域的灼见真知。

2020新见再次启航,第三期文献解读由中国医学科学院肿瘤医院的方仪教授带来晚期三阴性乳腺癌治疗的新突破。

国家癌症中心/中国医学科学院肿瘤医院
乳腺外科主任医师、硕士生导师
国家公共卫生重大专项“中国城市癌症早诊早治项目”乳腺癌组负责人
中国抗癌协会青年理事
中国医促会乳腺疾病分会常委兼副秘书长
中国医促会乳腺疾病分会青委候任主委
北京医学会乳腺疾病分会青年委员
中国医师学会乳腺外科医师分会青年委员
中国医师协会肿瘤分会委员
北京乳腺病防治学会国际医疗与合作专业委员会常委
北京乳腺病防治学会健康管理专业委员会常委
北京中西医结合学会委员
三阴性乳腺癌是一种乳腺癌中侵袭性最强,预后最差的乳腺癌亚型,占到了全部乳腺癌的15%~20%,一旦发生了复发转移,其中位生存期不足1年;三阴性乳在年轻女性中比在年老女性中更高发,在黑种人中比在其他人种和族群中更高发,并且三阴性乳腺癌常伴有内脏转移是三阴乳腺癌治疗效果较差的原因之一,另外一个原因很大程度上是由于缺乏有效的靶向治疗药物。值得注意的是,晚期三阴性乳腺癌的治疗更是当下乳腺癌治疗的困境,在过去的近20年来晚期三阴乳腺癌患者的治疗效果没有任何改善。近些年来针对晚期三阴性乳腺癌有一些研究探索包括聚ADP核糖聚合酶(PARP)抑制剂、周期蛋白依赖激酶(CDK)抑制剂等治疗方案,但很大程度上仍然处于探索阶段。近期,基于抗体-药物偶联物sacituzumab govitecan-hziy(赛妥珠单抗)针对晚期三阴乳腺癌的靶向治疗方面取得了可喜进展。 由于令人信服的疗效证据,该药验证性Ⅲ期ASCENT研究提前终止,并且4月22日,美国食品药品监督管理局(FDA)加速批准sacituzumab govitecan用于治疗既往已接受至少2种疗法的转移性三阴性乳腺癌(TNBC),这是首款获得FDA批准治疗转移性三阴性乳腺患者的靶向TROP-2的抗体偶联药物。
文献:IMMU-132-01一项1/2期、单组、多中心试验
Sacituzumab Govitecan-hziy in Refractory Metastatic Triple-Negative Breast Cancer (2019-NEJM)
研究背景
虽然靶向疗法已经给其他亚型的乳腺癌患者带来了益处,但序贯单药化疗仍然是转移性三阴性乳腺癌患者的标准治疗手段。在既往接受过治疗的转移性三阴性乳腺癌患者中,标准化疗的缓解率低,无进展生存期短,治疗效果不佳。sacituzumab govitecan-hziy(IMMU-132;Immunomedics)是一种抗体-药物偶联物,通过将人源化单克隆抗体与SN-38(伊立替康的活性代谢产物,拓扑异构酶Ⅰ抑制剂)相结合,人源化单克隆抗体靶向作用于人滋养层细胞表面抗原2(Trop-2),由于可裂解的连接物,SN-38被释放到肿瘤细胞内和肿瘤微环境中,从而能够向偶联物未结合的旁邻细胞内输送治疗浓度的药物。Sacituzumab(赛妥珠单抗)结合的肿瘤细胞通过细胞内摄取SN-38被杀死,邻近肿瘤细胞通过细胞外释放SN-38被杀死。基于此,研究者发起了IMMU-132-01研究,69例转移性三阴性乳腺癌患者使用sacituzumab govitecan-hziy(IMMU-132)抗体药物偶联物的初步结果显示:有30%的患者获得疾病缓解,包括19例部分缓解和2例完全缓解,缓解中位持续时间为8.9个月(95% CI,6.1个月 ~ 11.3个月),临床获益率为43%,中位总生存时间(OS)为16.6个月(95% CI,11.1个月 ~ 20.6个月),为了进一步研究该疗法在限定乳腺癌人群中的疗效,此次报告的研究结果是对试验纳入标准进行修正后,纳入患者因转移性三阴性乳腺癌接受过至少2线的治疗,再接受sacituzumab govitecan-hziy治疗,以观察其疗效及安全性。
这是一项1/2期、单组、多中心试验。研究纳入了108例转移性三阴性乳腺癌患者(中位年龄,55岁),入组标准为ER阴性、PR阴性、HER2阴性,ECOG PS评分0或1,有转移性疾病,肝肾功能、骨髓造血功能达标,预期生存时间大于6个月。在初次部分或完全缓解后至少4周进行了确证性CT和MRI检查。在确证性影像学检查之后,每8周进行1次后续影像学检查。患者既往接受过大量治疗[既往接受过的抗癌方案种数的中位数为3种(范围,2~10种)]。其中106例患者(98%)接受过紫杉烷类药物治疗,93例患者(86%)接受过蒽环类药物治疗。在21日周期的第1日和第8日,静脉输入sacituzumab govitecan-hziy,直至出现疾病进展或不可接受的不良事件。如果出现与治疗有关的重度不良事件,则允许在第一次出现时将剂量降低25%,第二次出现时将剂量降低50%,第三次出现时应终止治疗。允许根据研究者的意见给予造血生长因子或输血;然而,在首剂(第1周期,第1日)给药之前不允许给予预防性治疗。疗效数据集中所有转移性三阴性乳腺癌患者接受了起始剂量10 mg/kg的治疗。疗效评估:在基线时CT和MRI分期,治疗开始后每8周进行1次分期,直至出现需要终止治疗的疾病进展。 主要终点为客观缓解率,其他疗效终点包括至缓解的时间、缓解患者的缓解持续时间、临床获益率(定义为完全或部分缓解或疾病稳定至少6个月)以及无进展生存期和总生存期。安全性评估包括对不良事件和严重不良事件、实验室安全性评估、生命体征、体格检查和12导联心电图(ECG)的评估。在基线时、完成每个偶数治疗周期第1日的输入后、治疗结束时以及试验结束时进行了12导联ECG检查。
研究结果
入组患者和基线特征
在2013年6月至2017年2月,本试验共纳入了108例转移性三阴性乳腺癌患者(中位年龄,55岁)。患者既往接受过大量治疗[既往接受过的抗癌方案种数的中位数为3种(范围,2~10种)]。其中106例患者(98%)接受过紫杉烷类药物治疗,93例患者(86%)接受过蒽环类药物治疗。患者基线人口统计学特征见表1。数据截止时(2017年12月1日),108例转移性三阴性乳腺癌患者的中位随访持续时间为9.7个月(范围,0.3 ~ 36.5个月)。其中8例患者继续接受治疗。共有100例患者(92.6%)已终止治疗,其中86例患者(80%)因疾病进展终止治疗。
表1. 入组患者的基线特征
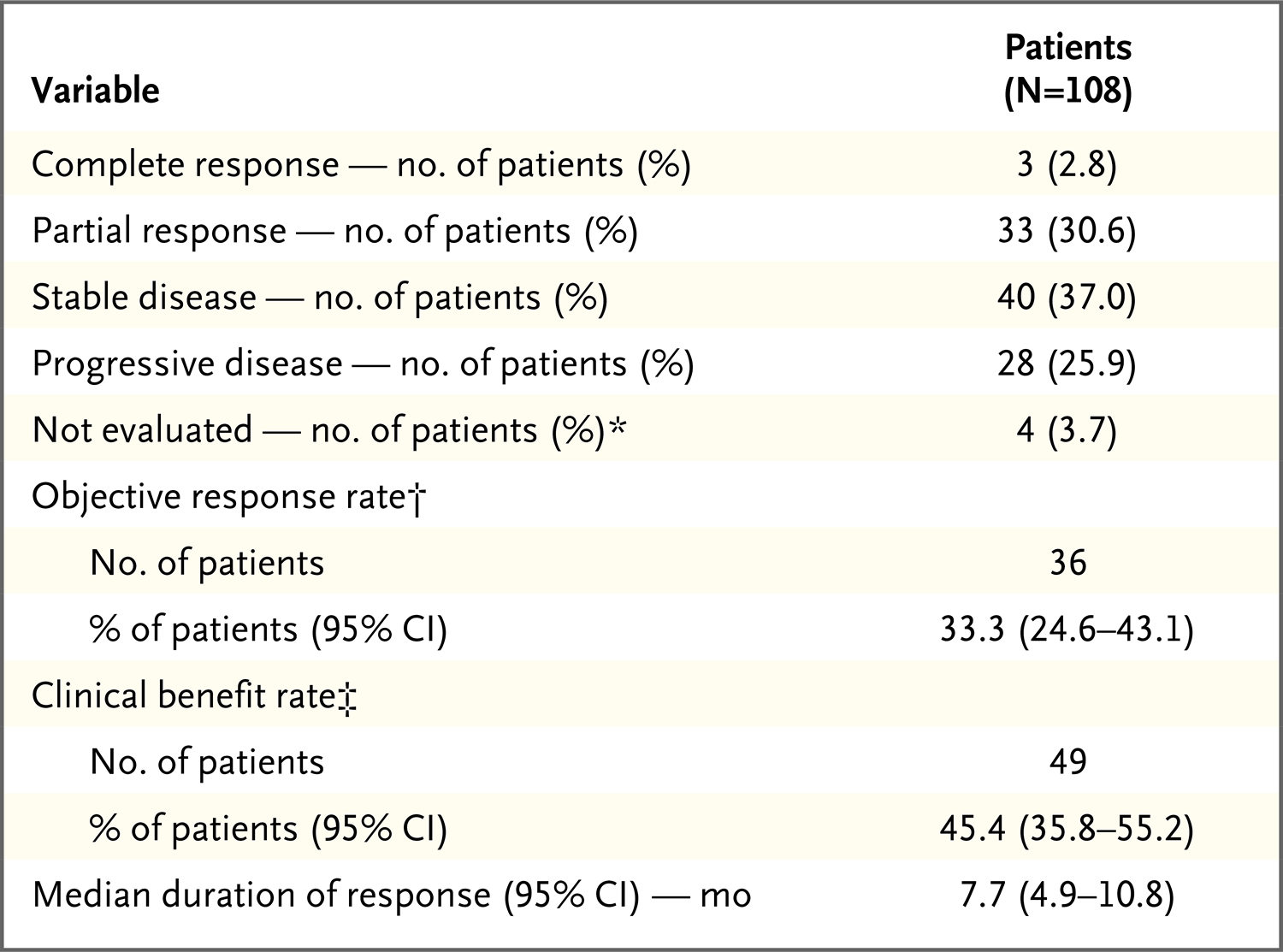
疗效
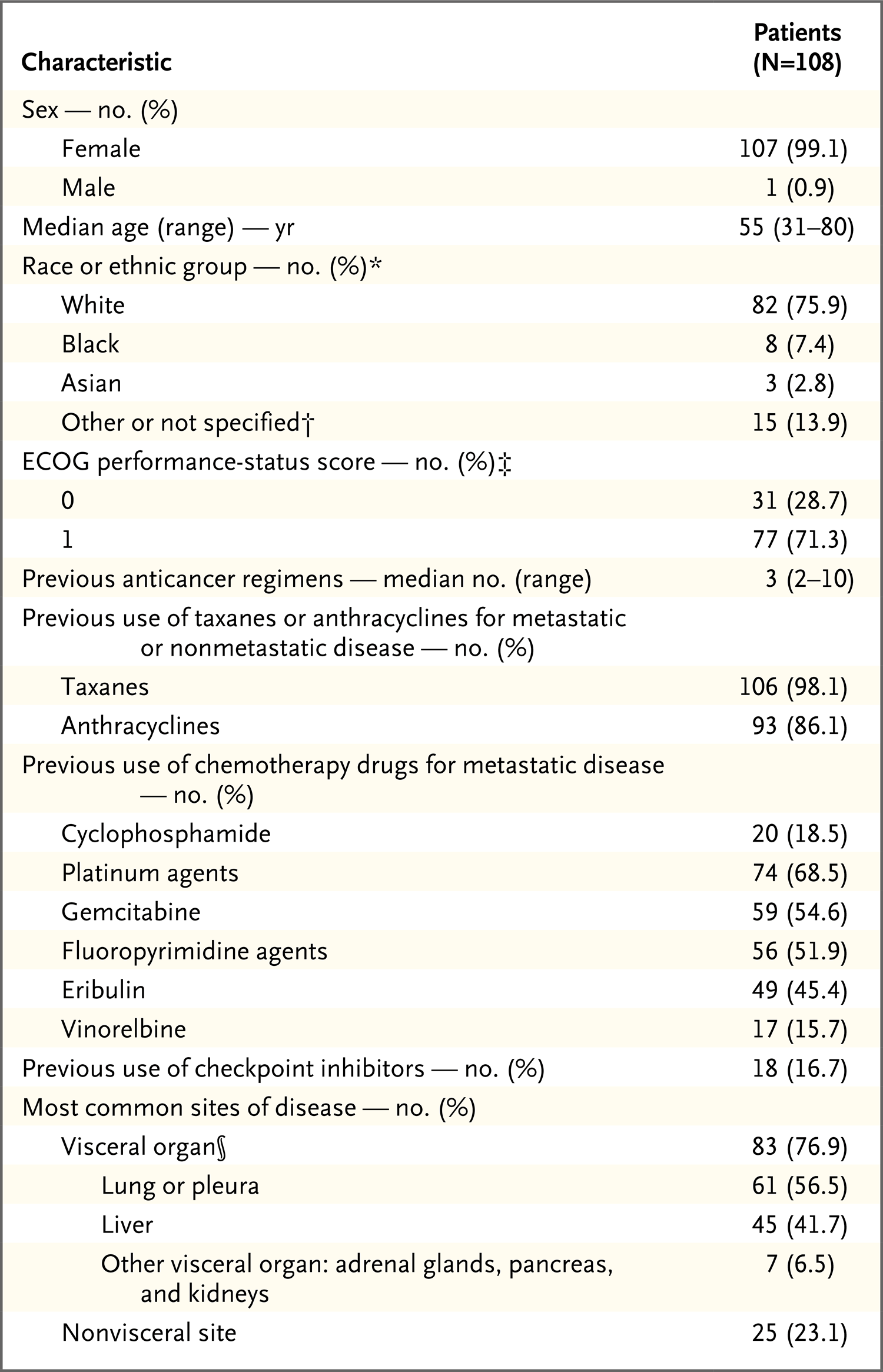
主要研究终点:缓解率为33.3%[108例患者中的36例,包括完全缓解的3例患者(2.8%)]。临床获益率(包括疾病稳定至少6个月)为45.4%(108例患者中的49例)。swimmer plot显示出现客观缓解的36例患者中,每1例的缓解开始时间和持续时间。这些患者至缓解的中位时间为2.0个月(范围,1.6~13.5个月),中位缓解持续时间为7.7个月(95%置信区间[CI],4.9~10.8)。通过盲法独立审核确定的缓解率[34.3% (95% CI,25.4~44.0)]和中位缓解持续时间[9.1个月(95% CI,4.6~11.3)]。患者在6个月时的估计缓解概率为59.7%,在12个月时的估计缓解概率为27.0%。在数据截止日期,6例患者长期缓解,缓解持续时间超过12个月(范围,12.7~30.4)。
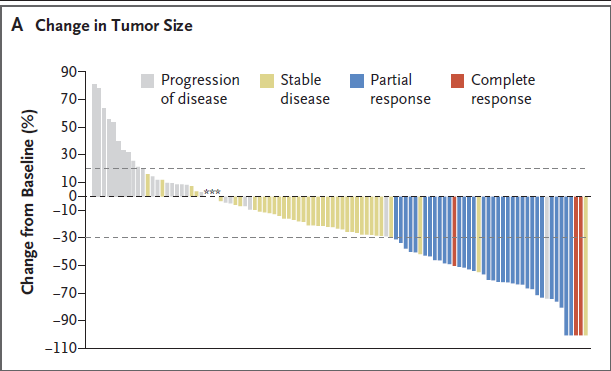
图1A.病灶直径总和(非淋巴结病变的最长直径和淋巴结病变的短轴)相对于基线的最佳变化百分比的瀑布图
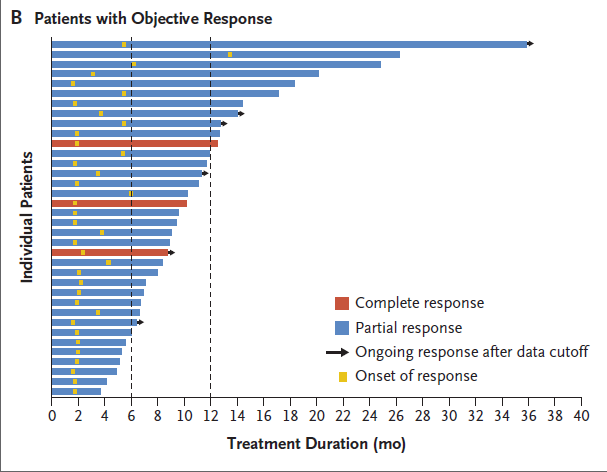
图1B. 从治疗开始至疾病进展期间的客观缓解展示
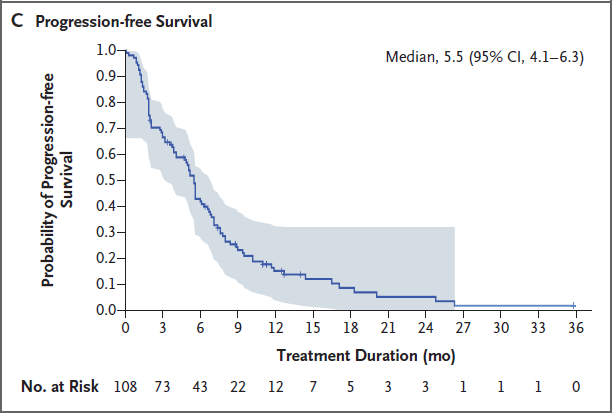
图1C.108例患者的无进展生存期的Kaplan-Meier分析
表2. 评估疗效的总结表格
亚组分析结果
该研究进一步在各种患者亚组中评估了sacituzumab govitecan-hziy治疗后患者的缓解情况,结果发现缓解率并未因下列因素而出现有意义的差异: 患者年龄、转移性疾病发病时间、既往接受过的治疗种数或是否有内脏转移。在既往接受过检查点抑制剂治疗的患者中,缓解率为44%(8/18);然而,考虑到接受过检查点抑制剂治疗及各亚组的患者数量少(这导致置信区间较宽),因此应该谨慎解读这些结果和报告的各亚组结果。
数据截止时,94例患者(87.0%)疾病进展,77例患者(71.3%)死亡。中位无进展生存期为5.5个月(95% CI,4.1 ~ 6.3);6个月和12个月时的估计无进展生存概率分别为41.9%和15.1%。中位总生存期为13.0个月(95% CI,11.2~13.7);6个月和12个月时的估计生存概率分别为78.5%和51.3%。
疗效与临床病程侵袭性的关系
为了分析疗效与临床病程侵袭性的关系,以及解决对该试验人群相对惰性的肿瘤生物学特征方面的顾虑,该研究还在获得数据的108例转移性三阴性乳腺癌患者中比较了sacituzumab 的治疗持续时间和既往抗癌治疗的持续时间。 sacituzumab的中位治疗持续时间(5.1个月)约为既往治疗(2.5个月)的两倍;这些数据表明该抗体-药物偶联物的临床活性以及无交叉耐药性。
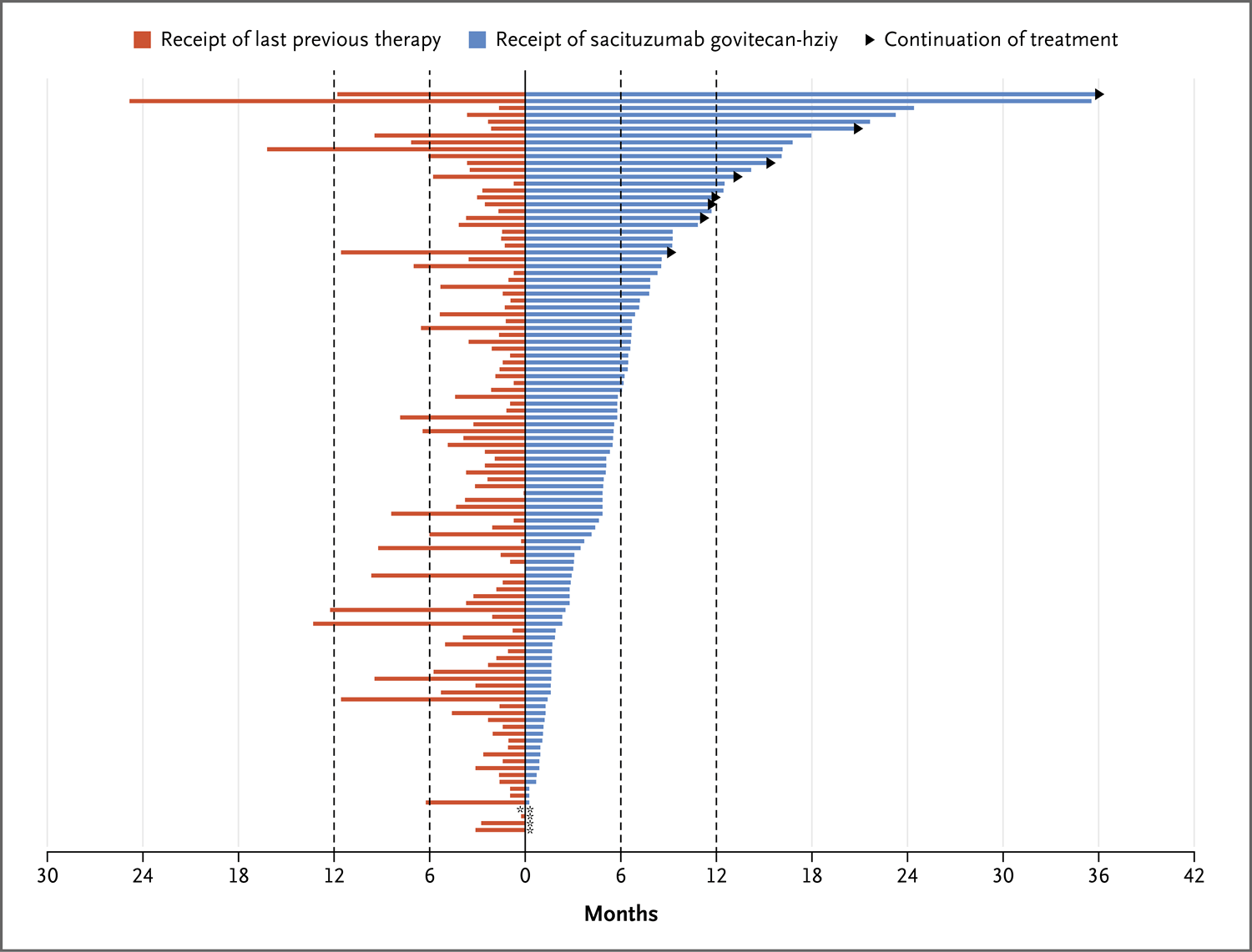
图2. 108例转移性三阴性乳腺癌患者的sacituzumab govitecan-hziy治疗持续时间与前一种治疗的持续时间
安全性分析
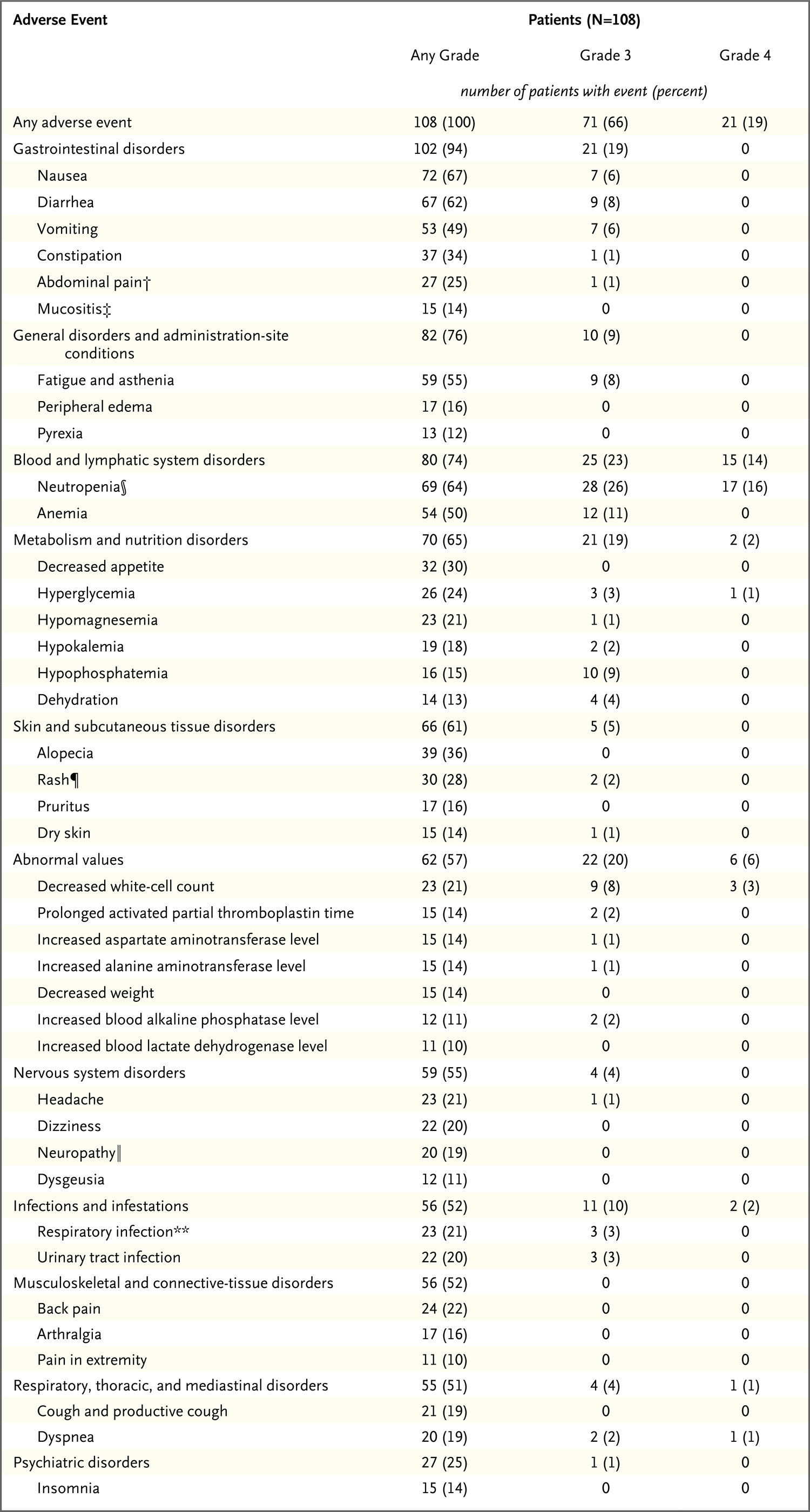
108例转移性三阴性乳腺癌患者平均接受了18.7次sacituzumab govitecan-hziy(范围,1~102次)治疗,或者9.6个周期(范围,1~51个周期),中位暴露持续时间为5.1个月(范围,0.03~36.1个月)。共有99例患者(92%)接受了输入前用药(对乙酰氨基酚、抗组胺药、H2受体拮抗剂、糖皮质激素、止吐药、抗焦虑药和阿托品)。如下表3所示,最常见的不良事件包括恶心、腹泻、疲劳、中性粒细胞减少和贫血,最常见的3级或更高级别的不良事件(发生率>5%)包括中性粒细胞减少、贫血和白细胞减少。腹泻(主要为1级)是常见不良事件(在全部患者中的发生率为62%);CTCAE 2级腹泻的发生率为14%,至少3级的腹泻发生率为8%。无关于3级或更高级别周围神经病的报告。在治疗期间,4例患者(4%)出现了导致死亡的不良事件(详细信息见补充附录的“结果”部分)。35例患者(32%)报告了严重不良事件;最常见(发生率>2%)的严重不良事件包括发热性中性粒细胞减少(7%的患者)、呕吐(6%)、恶心(4%)、腹泻(3%)和呼吸困难(3%)。
表3. 接受sacituzumab govitecan-hziy治疗患者的不良事件汇总
研究结论
在既往接受过大量治疗的转移性三阴性乳腺癌患者中,sacituzumab与持久的客观缓解相关。骨髓毒性作用是主要的不良反应。
研究点评
晚期三阴乳腺癌治疗开启新篇章
在近期的研究突破进展之前,针对晚期三阴性乳腺癌的治疗手段极其有限,除了化疗,人们束手无策。在2019年3月,FDA基于IMpassion130研究,一项多中心随机双盲Ⅲ期临床研究,评估了阿替利珠单抗(Atezolizumab)联合白蛋白紫杉醇治疗此前未接受过全身治疗的局部晚期或转移性三阴乳腺癌的疗效、安全性和药动学,入组902例患者,主要研究终点是RECIST 1.1标准评价的PFS和OS,在所有意向治疗人群和PD-L1阳性人群中进行分析。批准了PD-L1抗体阿替利珠单抗与化疗药物Abraxane结合用于转移性(扩散)三阴性乳腺癌患者的一线(或一线)治疗。这是一项突破性的进展,首先,这是第一个被批准用于乳腺癌的免疫疗法。其次,这是有史以来第一个被批准用于转移性三阴性乳腺癌患者的靶向治疗。第三,阿替利珠单抗延长了这类癌症患者的生存期,这意味着接受这种药物治疗的女性比未接受这种免疫疗法的女性寿命更长。最新的IMpassion130研究的更新数据进一步确认了在初治PD-L1阳性转移性三阴性乳腺癌患者中,阿替利珠单抗+白蛋白紫杉醇可取得有临床意义的OS获益,验证了免疫治疗在乳腺癌中的疗效与肿瘤标志物有关。2020年4月22日,基于一项三期临床试验的结果验证最初的研究结果,美国FDA加速批准了Trodelvy(sacituzumab govitecan-hziy),治疗转移性的三阴性乳腺癌成人患者。用Trodelvy之前,患者必须至少接受过两种治疗。该试验纳入108名转移性三阴性乳腺癌患者,这些患者既往至少接受过2种治疗。结果显示,Trodelvy的总缓解率为33.3%,缓解的中位持续时间为7.7个月。在缓解的患者中,55.6%的患者疗效维持6个月或以上,16.7%的患者疗效维持1年及以上。针对三阴乳腺癌,晚期一线阿替利珠单抗联合白蛋白紫杉醇已成为指南推荐的方案。至此,这两项突破性进展标志着晚期三阴乳腺癌治疗进入靶向治疗新时代,让我们看到了晚期三阴性乳腺癌未来治疗的曙光。
晚期三阴乳腺癌未来的发展方向
IMpassion130是首证实免疫治疗在晚期三阴性乳腺癌一线治疗有效的Ⅲ期临床研究。首先,回顾IMpassion130研究,我们发现选择PD-L1阳性患者作为优势人群的举措,在化疗的基础上联合PD-L1能够明显地提高PFS,甚至未来OS也可能有显著延长,提示我们未来的工作应该积极探索对晚期三阴乳腺癌进行分层的肿瘤标志物,寻找其它潜在的新型分子标志物,促进基于优势人群的精准治疗。第二,对于三阴性乳腺癌而言,目前仍然缺乏像雌激素受体和HER2那样如此具有特异性的靶点,回顾IMMU-132-01研究,未来更多的研究应该去探索Trop-2能否作为三阴性乳腺癌的最理想治疗靶点?IMMU-132-01研究在初期对69例病例的报告中提到了检测标本Trop-2表达的情况,69例患者有48例检测了Trop-2表达情况,其中60%检测的原发灶,40%检测的转移灶,88%的患者有Trop-2中到强度的表达,而这部分患者的PFS有明显延长的趋势(中位PFS 7.1个月 vs. 3.1个月;P = 0.019),但在本次研究结果报告中,没有提到Trop-2的检测和表达情况,笔者认为Trop-2的检测是未来非常值得关注的问题。第三,这两项突破性进展提示了未来靶向治疗和免疫治疗的两个方向拥有巨大的潜力,一是免疫治疗联合化疗,但联合哪些药物化疗仍然值得进一步探索研究。另一种则是基于抗体-药物偶联物 (ADC)的靶向治疗。ADC治疗是一种非常好的治疗手段,将其应用于三阴性乳腺癌治疗更是一个非常精巧的设计。
1.Bardia, A.; Mayer, I. A.; Vahdat, L. T.; Tolaney, S. M.; Isakoff, S. J.; Diamond, J. R.; O’Shaughnessy, J.; Moroose, R. L.; Santin, A. D.; Abramson, V. G., Sacituzumab govitecan-hziy in refractory metastatic triple-negative breast cancer. New England Journal of Medicine 2019, 380, (8), 741-751.
2.https://www.fda.gov/drugs/drug-approvals-and-databases/fda-grants-accelerated-approval-sacituzumab-govitecan-hziy-metastatic-triple-negative-breast-cancer
精彩回顾
新见2020 | 黄亮教授:乳腺癌的延迟治疗影响——当乳腺癌治疗遇到新冠肺炎疫情
新见2020 | 掌中日月 袖里乾坤 何以忖今生---乳腺癌相关基因检测与临床治疗进展
排版编辑:肿瘤资讯-细胞田












 苏公网安备32059002004080号
苏公网安备32059002004080号


