尽管近年来乳腺癌的治疗取得了突破性进展,如何在传统化疗的基础上优化治疗模式、延缓耐药及减少不良反应是现阶段所面临的最大挑战。节拍化疗通过低剂量、高频率、短间歇的给药方式,可以长时间维持药物在较低且有效的浓度范围。节拍化疗具有抗血管生成、免疫调节、减少药物不良反应及延缓耐药等优点,本文就长春瑞滨口服节拍化疗在一例局部晚期乳腺癌患者的应用经验作一分享。

辽宁省肿瘤医院 血液乳腺内科病房
医学硕士 博士在读
毕业于中国医科大学附属盛京医院肿瘤内科
擅长于肺癌、乳腺癌、消化道肿瘤、恶性淋巴瘤等恶性肿瘤的诊治工作
病例分享
患者基本情况
女性患者,69岁,以“确诊乳腺癌7个月”入院。
既往诊疗经过
患者2018年5月因左乳肿物行穿刺活检术,穿刺病理:浸润性癌。免疫组化:ER(-) , PR(-) , C-erbB-2(2+ ~ 3+), Ki-67:70%(+);FISH检测:基因扩增。左腋下淋巴结穿刺:见腺癌组织,不除外转移性(T3N2M0 ⅢA)。就诊于我院乳腺外科,给予新辅助化疗TEC方案化疗4周期,TXH方案6周期,末次化疗为2018年11月。
既往史
否认高血压、冠心病、糖尿病病史。
家族史
无肿瘤家族史;无其他家族性遗传性疾病史。
体格检查
左乳腺可触及肿物,左锁骨上可触及肿大淋巴结,左腋下可触及肿大淋巴结。
影像学检查
超声(2018年12月):左乳腺恶性肿瘤,左锁骨上及左腋下淋巴结多发肿大淋巴结,转移可能性大。
CT(2018年12月,图1):左乳肿物,左锁骨上及左腋下淋巴结肿大。
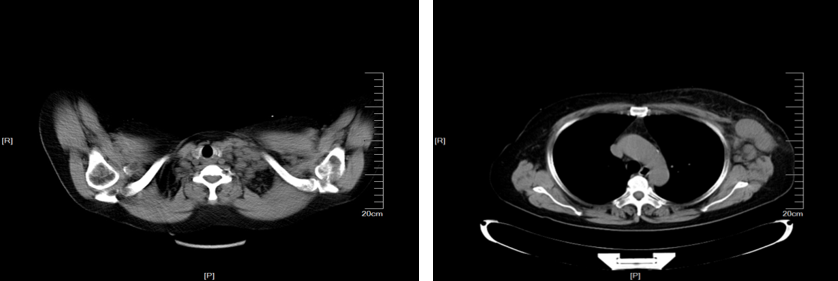
图1 胸部CT(2018年12月)检查提示左乳肿物,左锁骨上及左腋下多发肿大淋巴结,转移可能性大
病理结果
左锁骨上淋巴结活检病理结果示:(左锁骨上淋巴结)转移癌,结合病史考虑乳腺癌转移。01: CK (+), GATA-3 少数细胞(+),ER (-),PR 约5%弱(+),C-erbB-2 (2+,局部3+), Ki-67 约80%(+); FISH检测:基因扩增。(左腋下淋巴结穿刺)转移癌,结合病史考虑乳腺癌转移,请结合临床。01: CK (+),GATA-3 部分细胞(+),P63 (-), CK5/6 (-), ER (-), PR 约5%弱(+),C-erbB-2 (2+,局部3+), Ki-67 约70%(+)。
临床诊断
左乳腺恶性肿瘤 T3N3M0 ⅢC期
左锁骨上淋巴结继发恶性肿瘤
左腋下淋巴结继发恶性肿瘤
治疗经过
2018年12月因左侧锁骨上淋巴结及左腋下淋巴结肿大入院,完善淋巴结活检,病理结果示:(左锁骨上淋巴结)转移癌,结合病史考虑乳腺癌转移。2018年12月始予NPH方案化疗6周期,具体方案为:口服长春瑞滨 40mg 隔日一次+顺铂120 mg(40 mg/天,D 1-3) + 曲妥珠单抗390 mg(D1,初次剂量为520 mg),2019年4月予以曲妥珠单抗靶向联合口服长春瑞滨40 mg 隔日一次节拍维持治疗至2019年11月。
疗效评估:6周期NPH方案化疗后乳腺肿物缩小,锁骨上及腋下淋巴结较前明显缩小,评价疗效PR,后维持治疗至2019年10月,具体方案为:长春瑞滨 40 mg 隔日一次+曲妥珠单抗390 mg(D1),病灶未见明显变化,评效SD。2019年11月,乳腺肿物及腋下淋巴结增多增大,评效PD。
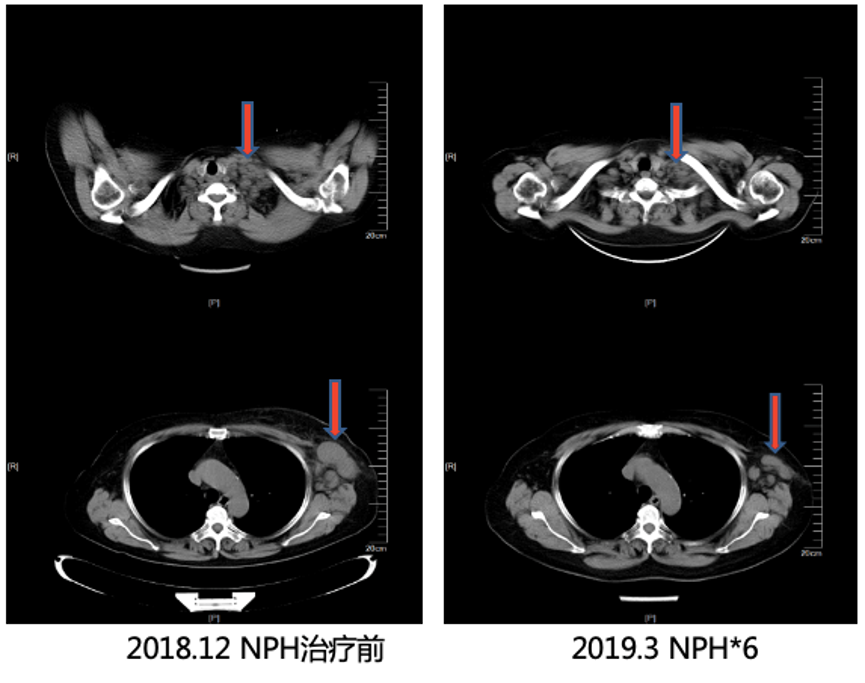
图2 6周期化疗后影像学检查提示左乳肿物较前缩小,锁骨上及腋下淋巴结较前明显缩小
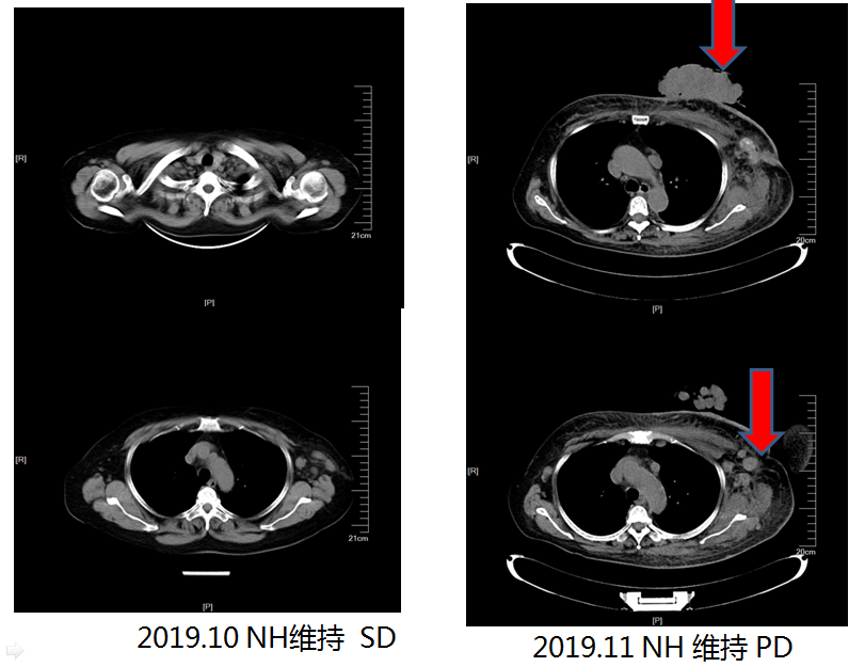
图3 2019年11月NH维持疗效评价PD
2019年10月复查胸部CT提示病灶未见明显变化,疗效评估SD。2019年11月复查提示乳腺肿物及腋下淋巴结增多增大,疗效评估PD。
专家点评

辽宁省肿瘤医院血液·乳腺内科病区主任
中国抗癌协会流行病专业委员会委员
辽宁省医学会肿瘤专业委员会委员
辽宁省抗癌协会常务理事
辽宁省抗癌协会化疗专业委员会常务委员
辽宁省抗癌协会MDT专业委员会副主任委员
辽宁省抗癌协会肿瘤转移委员会常务委员
辽宁省抗癌协会癌症康复与姑息治疗专业委员会常务委员
辽宁省抗癌协会大肠癌专业委员会常务委员
辽宁省细胞生物学学会普通外科细胞生物技术专业委员会委员
辽宁省细胞生物学学会肿瘤细胞生物学专业委员会委员
本例患者为一淋巴结转移、HER2阳性激素受体阴性表达的老年女性乳腺癌患者,分别接受TEC新辅助化疗4周期以及TXH方案6周期化疗,在确诊后7个月出现同侧锁骨上淋巴结转移,于2018年12月起给与NPH方案节拍化疗6周期,2019年4月调整为曲妥珠单抗靶向联合口服长春瑞滨40 mg隔日一次节拍维持治疗至2019年11月。该患者治疗经过涉及长春瑞滨节拍化疗,主要有以下几点值得分享:
1. 乳腺癌节拍化疗作用机制
晚期转移性乳腺癌治疗方案的选择一直困扰着临床医生。该患者为HER2阳性、激素受体阴性表达的老年女性患者,无论是美国NCCN指南,还是国内的CSCO乳腺癌诊疗中指南、CBCS共识,以曲妥珠单抗为基础联合化疗的方案是这部分患者晚期一线治疗的标准方案。临床决策需要首选曲妥珠单抗为基础的治疗,根据患者激素受体情况、既往(新)辅助治疗用药情况,选择治疗方案,使患者最大受益。
最大耐受剂量化疗是传统化疗的主要形式,因毒副反应较重,每周期化疗后需要2 ~ 3周的间歇期以利于机体组织器官功能的恢复,但易产生耐药性,极易发生疾病进展。节拍化疗 (metronomic chemotherapy) 在这一治疗背景下应用而生,其是以某些常规化疗药物,采取小剂量 (MTD的1/10 ~ 1/3)、高频率、持续性的给药方式,除了对肿瘤细胞具有直接杀伤作用外,还具有抗血管生成、免疫调节、减少肿瘤干细胞和促使肿瘤细胞休眠的作用,可延缓耐药。节拍化疗毒副反应低,患者依从性佳,不易引起肿瘤耐药,代表了肿瘤化疗一个新的走向。长春瑞滨口服制剂节拍化疗已在乳腺癌、 非小细胞肺癌、 前列腺癌等多种肿瘤的治疗中表现出良好的疗效及耐受性。长春瑞滨口服制剂可通过单药化疗、联合化疗及联合内分泌治疗、靶向治疗来改善晚期乳腺癌患者的预后和生活质量。
2. 长春瑞滨节拍化疗相关临床试验
长春瑞滨节拍化疗较早用于晚期乳腺癌的临床研究始于 2010 年,用药剂量为每周 70 mg/m2,每周一、 三、五进行单药化疗,研究中共入组34例患者,其ORR为 38%,中位PFS和OS分别为7.7个月和15.9个月[1]。3级不良反应为中性粒细胞减少(6%)和手足综合征 (15%)。上述研究证实了长春瑞滨节拍化疗是耐受性良好且可行的化疗方案。De Luliis F等后续开展了一项针对老年晚期乳腺癌患者的Ⅱ期临床试验,研究中采用长春瑞滨单药 30 mg隔天给药,疾病控制率(disease control rate,DCR)可以达到87.4%,且没有发生3级或4级不良反应,再次证实了长春瑞滨节拍化疗的有效性及安全性[2]。
3. 长春瑞滨联合其他口服药物节拍化疗临床试验
在上述研究之后,越来越多长春瑞滨联合其他口服化疗药物节拍化疗的临床试验相继开展。VICTOR-1 研究[3]探索了口服长春瑞滨和卡培他滨节拍化疗治疗局部晚期或转移性乳腺癌的剂量。在疗效观察中发现患者的临床获益率(clinical benefit rate,CBR)为 58.1%,3 级及以上不良反应发生率为5.9%,疗效及安全性均体现出优势;≥70岁老年患者的ORR为33%,中位PFS为10.5个月,两组患者疗效相似,但节拍化疗耐受性显著优于标准治疗方案。VICTOR-2 研究[4]结果表明,口服长春瑞滨联合卡培他滨一线及一线以上治疗HER2阴性乳腺癌的CBR分别为45.7%和51.1%。VICTOR-6研究即节拍化疗治疗晚期乳腺癌的真实世界数据[5]显示,在一线治疗中,含长春瑞滨的治疗方案具有最高的ORR和CBR(单药化疗的ORR和CBR分别为44%和 88%;联合化疗的ORR和CBR分别为 36.7%和82.4%)。同时,在长春瑞滨联合治疗方案和卡培他滨单药治疗方案中观察到最长的中位PFS。
4. 长春瑞滨节拍化疗联合靶向治疗
口服长春瑞滨与曲妥珠单抗一线治疗转移或局部晚期 HER2 阳性乳腺癌的Ⅱ期临床试验[6]中,ORR 为56%,CBR 为88%,患者对治疗的耐受性良好,主要的 3 ~ 4 级血液学毒性为中性粒细胞减少(46%)。31 例患者入组拉帕替尼联合口服长春瑞滨治疗HER2阳性转移性乳腺癌的Ⅱ期临床试验结果显示,中位PFS为5.6个月,6 例(19.4%) 患者达到部分缓解(partial response,PR),CBR 为38.7%。口服长春瑞滨较静脉注射长春瑞滨可显著降低 3 ~ 4级血液学毒性,再次证实口服长春瑞滨联合靶向治疗对晚期乳腺癌具有较好的疗效和安全性。
本例患者是局部晚期的HER2阳性乳腺癌患者,新辅助治疗后发现锁骨下淋巴结阳性,考虑转移性乳腺癌。晚期一线治疗通过节拍化疗+靶向治疗,在抗HER2的同时,考虑到该患者为老年人,晚期一线首发及维持治疗均给予耐受性更好的节拍给药方案,使其在保证疗效即获得了长达11个月的疾病稳定期的同时,兼顾了用药安全性。该病例为晚期乳腺癌诊疗方案的选择提供了借鉴,期待未来有更多的中国患者节拍疗法的数据及案例可供临床参考。
[1] Zhang L, Qiu MZ, Jin Y. Programmed cell death ligand 1 (PD-L1) expression on gastric cancer and its relationship with clinicopathologic factors[J]. Int J Clin Exp Pathol, 2015, 8(9): 11084-11091.
[2] Sun J, Xu K, Wu C, et al. PD-L1 expression analysis in gastric carcinoma tissue and blocking of tumor-associated PD-L1 signaling by two functional monoclonal antibodies [J]. Tissue Antigens, 2007, 69(1): 19-27.
[3] Zhang M, Dong Y, Liu H, et al. The clinicopathological and prognostic significance of PD-L1 expression in gas- tric cancer: a meta-analysis of 10 studies with 1,901 pa- tients[J]. Sci Rep, 2016, 6: 37933.
[4] Wojtkowiak JW, Rothberg JM, Kumar V, et al. Chronic au- tophagy is a cellular adaptation to tumor acidic pH micro- environments Cancer Res, 2012, 72(16): 3938-3947.
[5] Montagna E, Palazzo A, Maisonneuve P, et al. Safety and efficacy study of metronomic vinorelbine, cyclophospha- mide plus capecitabine in metastatic breast cancer: a phase II trial[J]. Cancer Lett, 2017, 400: 276-281.
[6] Barar J, Omidi Y. Dysregulated pH in tumor microenviron- ment checkmates cancer therapy[J]. Bioimpacts Bi, 2013, 3(4): 149-162.
排版编辑:肿瘤资讯-细胞田














 苏公网安备32059002004080号
苏公网安备32059002004080号


