2019年9月27—10月1日,欧洲肿瘤内科学会(ESMO)年会在西班牙巴塞罗那盛大举行,免疫治疗仍是会场热点,多项研究重磅发布。帕博利珠单抗作为免疫治疗之星,已在多个瘤种治疗中显示出不俗的实力,此次大会期间,该药在消化道肿瘤领域有4项重要研究发布,【肿瘤资讯】为您一文览尽相关研究进展。
(760P)帕博利珠单抗对比化疗用于晚期或转移性食管腺癌或鳞癌二线治疗:KEYNOTE-181中国亚组分析结果
“KEYNOTE-181全球队列”作为全球第一个在食管癌治疗中头对头对比免疫治疗与标准化疗的大型Ⅲ期随机对照研究,成功打破了近 50 年食管癌治疗的僵局,证明了PD-1免疫检查点抑制剂帕博利珠单抗单药相比于化疗在复发局部晚期和转移性食管癌治疗中的优效性。美国FDA基于KEYNOTE-181研究结果于今年7月31日批准帕博利珠单抗单药治疗PD-L1表达阳性(CPS≥10)的复发局部晚期和转移性食管鳞癌患者。
“KEYNOTE-181中国队列”中国人群数据在2019 ESMO大会展示。
结果显示,在所有意向治疗人群(ITT)和食管鳞癌人群中, 无论PD-L1表达情况,帕博利珠单抗治疗组的中位总生存期(OS)都达到8.4个月,化疗组的中位OS为5.6个月,死亡风险都降低45%;ITT和食管鳞癌人群12个月的生存率分别为36%和35.7%,分别是化疗组(ITT组, 17%;食管鳞癌,15.3%)的2倍以上。
而PD-L1高表达,帕博利珠单抗治疗组的中位OS达到12个月,可谓晚期食管癌二线治疗的超长生存,化疗组的中位OS为5.3个月(HR=0.34,95% CI 0.36~0.82;名义P值),差异之大,结果惊人(图1) 。
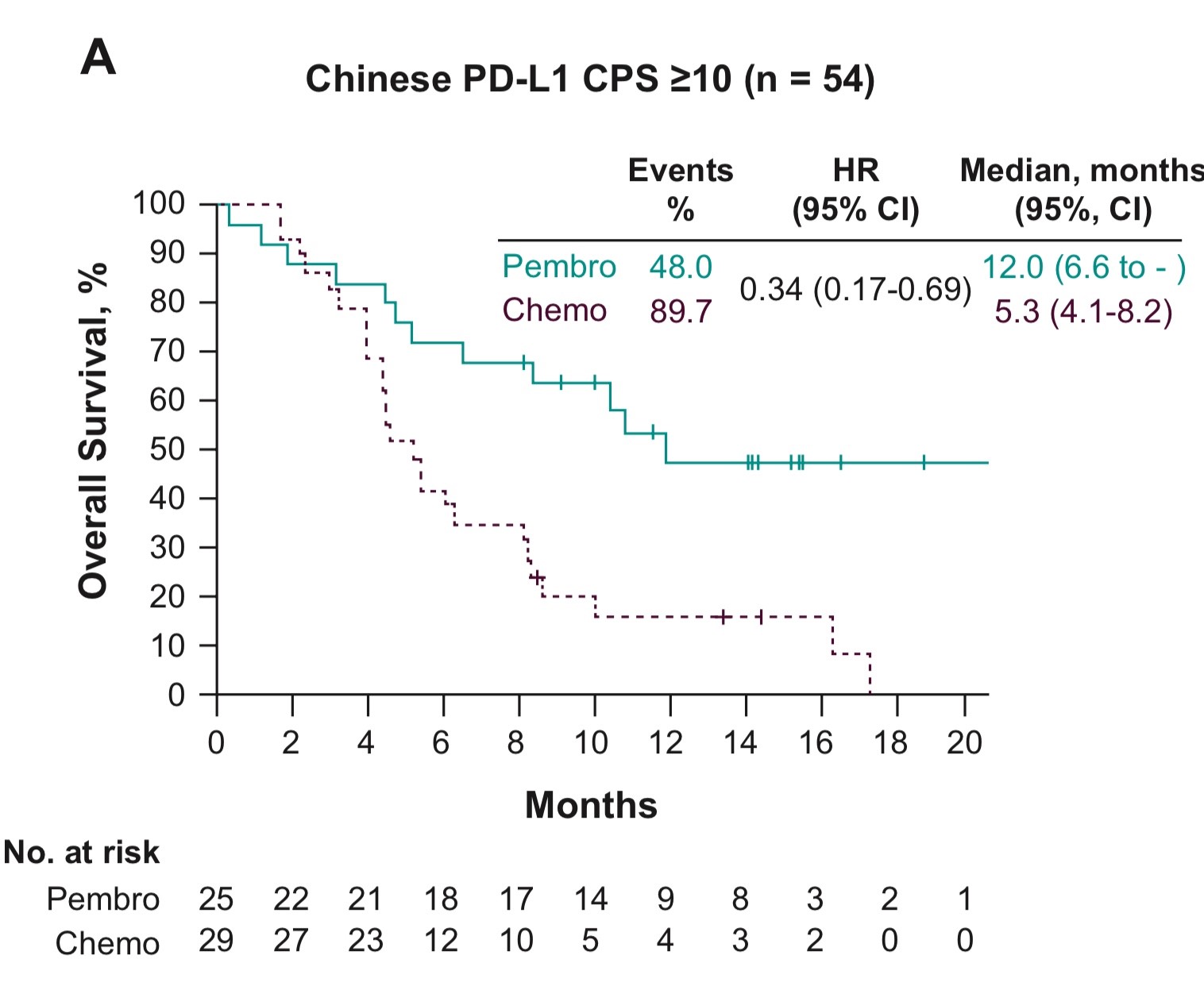
图1. 中国PD-L1 CPS≥10人群OS结果
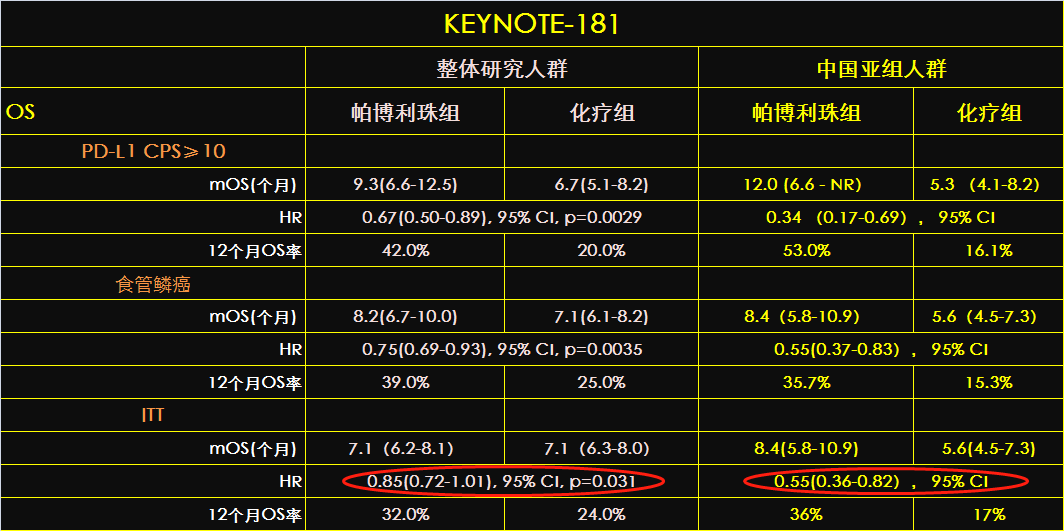
相比今年在ASOC-GI大会上发布的KEYNOTE-181的整体研究人群的治疗数据,帕博利珠单抗治疗中国人群带来的OS获益更显著,死亡风险降低幅度是整体研究人群数据的3倍:中国人群45%(HR=0.55,95% CI 0.36~0.82;名义P值)相比整体人群仅有的15%(HR=0.85,95% CI 0.72~1.01;P=0.031)。该“偏向性”在食管鳞癌和PD-L1表达阳性(CPS≥10)人群都有体现,见表1。
表1. 帕博利珠单抗在中国人群和整体研究人群的死亡风险降低幅度对比
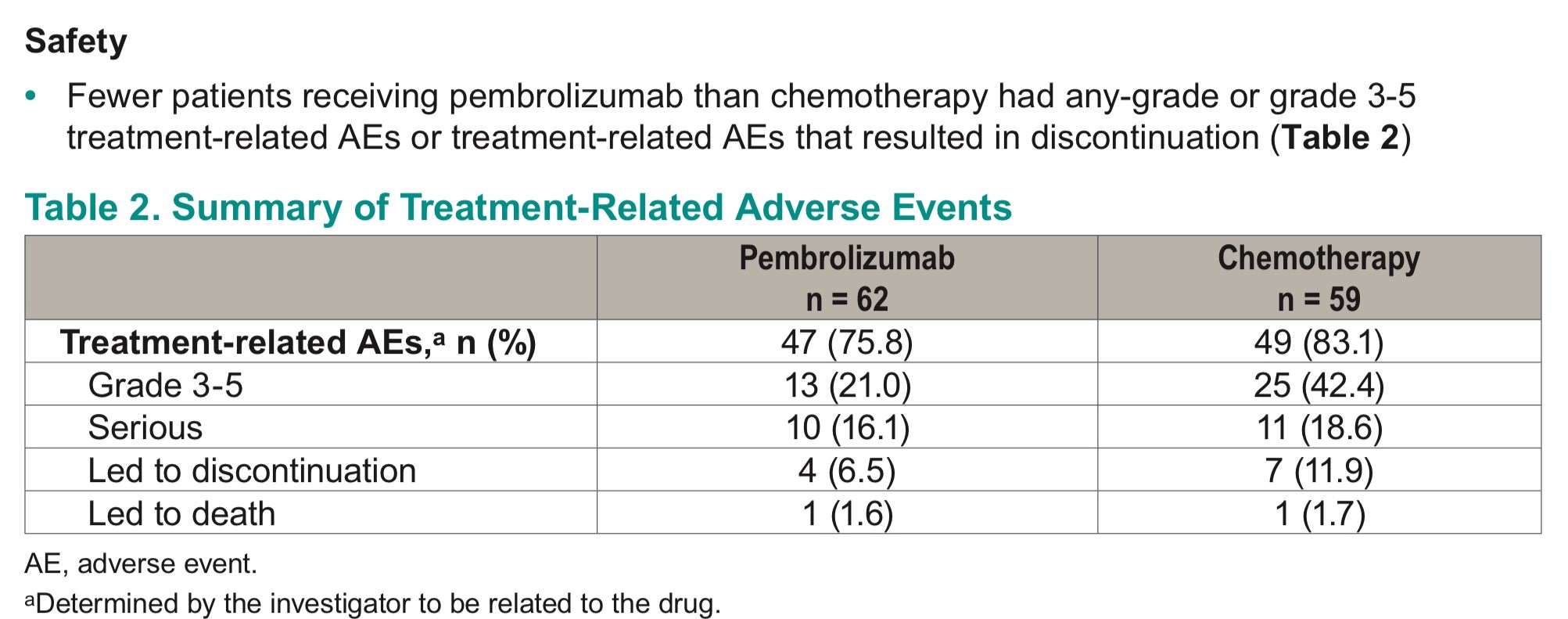
另外,帕博利珠单抗组与治疗相关的不良事件发生率低于化疗组(帕博利珠单抗组75.8%, 化疗组83.1%),3~5级不良事件发生率更是仅有化疗组的一半(帕博利珠单抗组21.0%, 化疗组42.4%),见表2。
表2. 帕博利珠单抗组与化疗组的治疗相关不良事件发生率
小结:2019 ASCO-GI公布的KEYNOTE-181全球数据奠定了帕博利珠单抗二线治疗食管癌的标准地位,基于该研究,FDA批准帕博利珠单抗用于PD-L1 CPS≥10食管鳞癌患者的二线治疗。中国的食管癌以鳞癌为主,不同于西方的以腺癌为主。此外,中国食管癌在发病诱因、发病部位、病理和临床特征方面都明显不同于西方人群,因此,将欧美食管癌治疗经验照搬于中国临床实践并不合适。因此,研究者对KEYNOTE-181研究的中国人群进行了亚组分析。中国人群的数据显示比全球的更好,OS获益是化疗的2倍以上,在近50年的食管癌治疗临床研究中还未曾有过如此生存获益的先例。KEYNOTE-181研究对于食管癌治疗具有里程碑式的意义,帕博利珠单抗将为国内食管癌的临床实践带来革命性的改变。
(747P)仑伐替尼联合帕博利珠单抗治疗不可切除肝细胞癌(HCC)的ⅠB期研究更新结果
这是一项开放的ⅠB期研究,在不可切除的HCC患者中评估了仑伐替尼联合帕博利珠单抗的疗效和安全性,研究分为2部分:剂量限制性毒性(DLT)评估期(n=6)和扩展期(n=94)。截至本次分析共纳入67例患者,总体人群的随访时间为11.7个月。研究第一部分未观察到DLT。安全性分析显示,总体人群中,治疗相关的≥3级不良事件发生率为80.6%;严重不良事件发生率为59.7%。疗效分析显示,独立评估委员会采用mRECIST标准评价的客观缓解率(ORR)为46.3%(图2),中位缓解持续时间(DOR)为9.0个月,疾病控制率(DCR)为85.1%,中位无进展生存期(PFS)为9.7个月,中位至进展时间(TTP)为11.8个月,中位OS为20.4个月(图3)。这一更新数据显示仑伐替尼联合帕博利治疗不可切除的HCC,表现出可接受的耐受性和有前景的疗效。
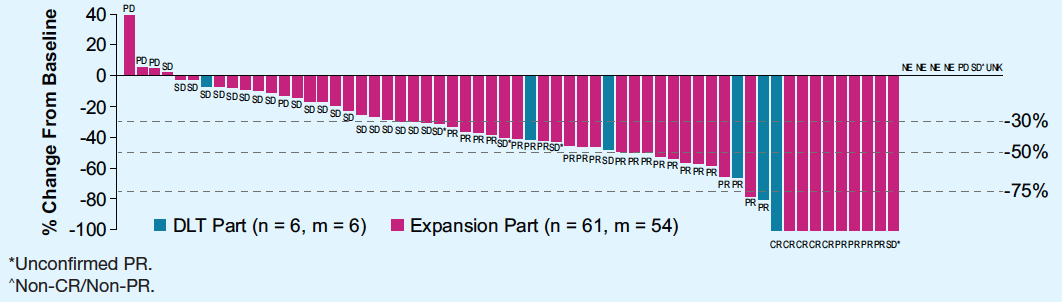
图2. 患者的疗效瀑布图
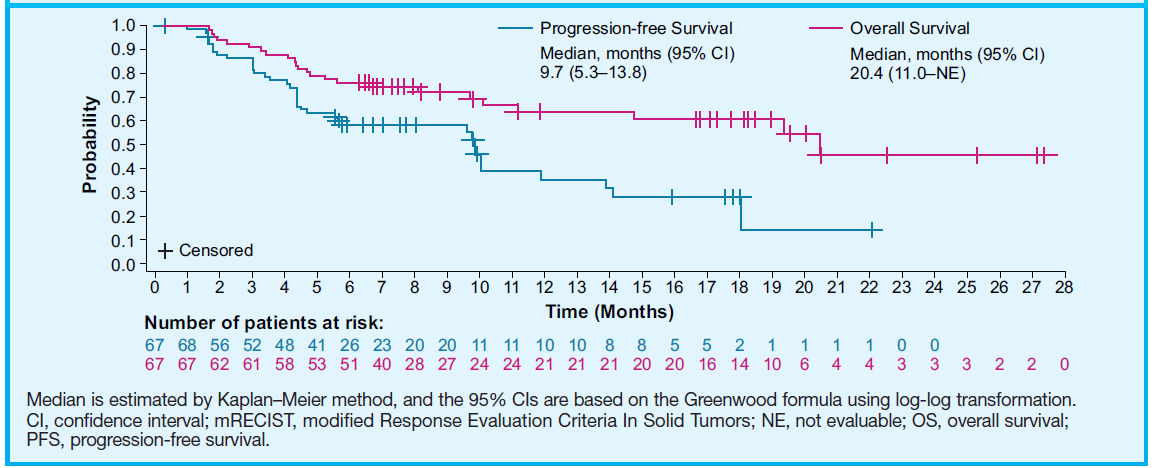
图3. PFS和OS结果
小结:手术不可切除的HCC可选治疗手段相对有限,目前获批的一线治疗药物仅索拉非尼和仑伐替尼。但这两种药物单用的有效率都相对较低,REFLECT研究中ORR算是创了历史最高纪录,索拉非尼和仑伐替尼组ORR分别为9.2%和24.1%;中位OS分别为12.3个月和13.6个月。免疫治疗也已获FDA批准为晚期HCC的二线治疗,而免疫单药的ORR也只有15%~20%,奠定帕博利珠单抗二线治疗标准地位的KEYNOTE-224研究中,ORR为17%,中位OS为12.9个月。从机制上来说,临床前研究显示,同时抑制VEGFR和PD-1通路有协同抗肿瘤作用。在小鼠模型中,仑伐替尼能大大减少肿瘤相关巨噬细胞的数量,提升CD8阳性T细胞比例,使PD-1单抗的抗肿瘤活性增加。这种协同作用在仑伐替尼联合帕博利珠单抗的这项Ⅰb期研究中得到了验证:独立评估委员会采用mRECIST v1.1标准评价的ORR高达46.3%,无论与既往的靶向治疗单药还是免疫治疗单药研究相比,ORR都翻倍;且OS长达20.4个月,显著长于既往的一线单用靶向或免疫治疗的数据。此外,该联合方案的安全性良好。目前,仑伐替尼联合帕博利珠单抗治疗不可切除HCC已获FDA突破性疗法认证。该方案已在进一步开展国际多中心的Ⅲ期临床试验,中国20家中心参与,结果值得期待。
(817P)帕博利珠单抗、曲妥珠单抗、卡培他滨和奥沙利铂一线治疗HER2阳性转移性胃食管腺癌
这是一项研究者发起的单中心Ⅱ期研究,研究假设在HER2阳性患者中,联合PD-1单抗和抗HER2治疗可以进一步扩大T细胞激活,增强ADCC作用,进而增加抗肿瘤免疫。研究入组了HER2阳性晚期胃食管腺癌,患者在接受1个周期的帕博利珠单抗联合曲妥珠单抗诱导治疗后,后续接受卡培他滨+奥沙利铂联合上述2个单抗治疗。
共入组37例患者,结果显示,25例患者在接受1个周期诱导治疗后(未接受化疗),12例(48%)出现靶病灶缩小(图4)。
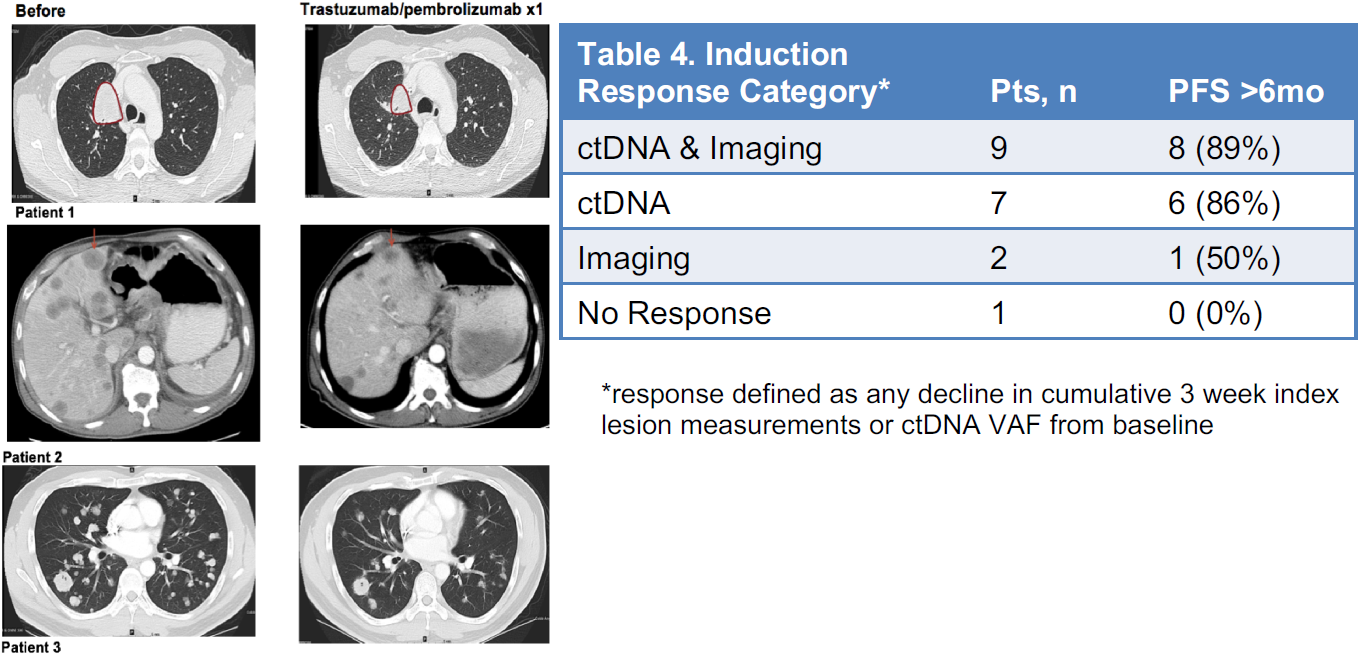
图4. 1个周期诱导治疗后(未接受化疗),靶病灶缩小情况
在35例有可测量病灶的患者中,ORR达到89%(28/35),疾病控制率(DCR)达到100%(图5)。
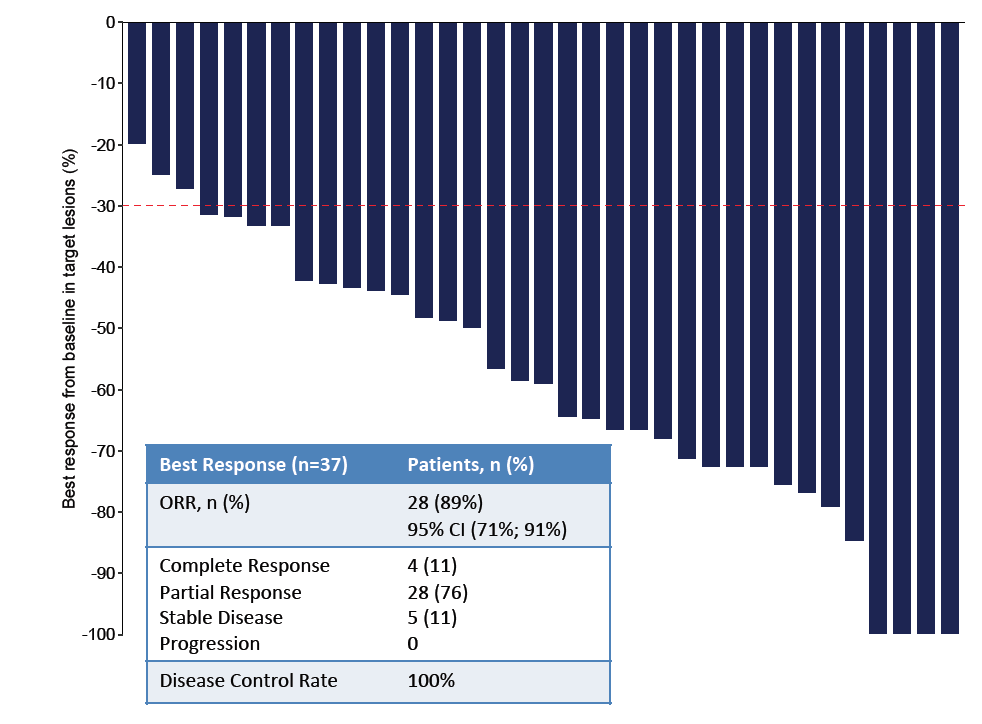
图5. 患者接受帕博利单抗、曲妥珠单抗、卡培他滨和奥沙利铂治疗的最佳疗效(n=35)
中位随访13个月后,中位PFS和中位OS分别达到13.03个月和27.17个月,12个月OS率达80%(图6)。
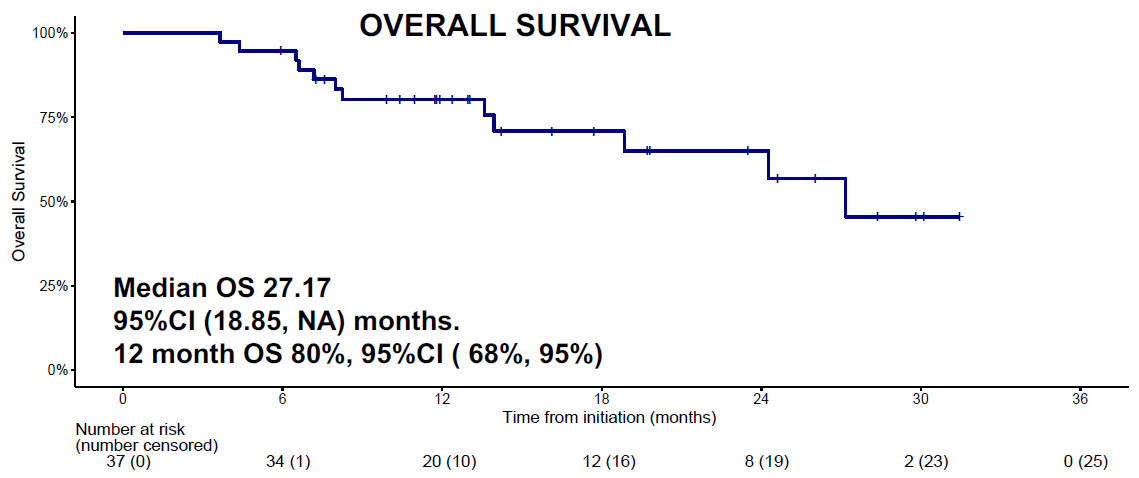
图6. OS结果
探索性分析显示,肿瘤和ctDNA ERBB2扩增水平是重要的疗效预测因子,PD-L1表达水平不能预测PFS。目前,随机Ⅲ期KEYNOTE-811研究正在进行中。
小结:基于2010年Lancet发表的ToGA研究的数据,曲妥珠单抗获批用于HER2+转移性胃食管癌的一线治疗,该研究中曲妥珠单抗联合氟尿嘧啶/铂类的OS达到13.8个月,ORR达47%。而帕博利珠单抗也已获FDA批准用于PD-L1阳性转移性胃食管癌的三线治疗。ESMO大会发表的这项研究中,HER2+晚期胃食管癌患者在曲妥珠单抗联合化疗基础上加用免疫治疗帕博利珠单抗使ORR进一步提升至89%,OS翻倍(27.17个月vs 13.8个月),显示了良好的协同抗肿瘤作用。表明免疫治疗的获益不仅限于HER2-患者,HER2+患者同样获益。
(LBA 44)KEYNOTE-062研究:根据MSI状态分析帕博利珠单抗联合或不联合化疗对比单纯化疗治疗晚期胃癌/胃食管结合部癌
KEYNOTE-062研究是一项随机对照Ⅲ期研究,在HER2阴性、PD-L1 CPS ≥1的晚期胃癌/胃食管结合部(G/GEJ)癌一线治疗上,采用帕博利珠单抗单药或帕博利珠单抗联合化疗,对比化疗,主要研究终点为在CPS≥1和CPS≥10人群中,帕博利珠单抗联合化疗vs化疗和帕博利珠单抗vs化疗的OS对比;在CPS≥1 人群中,帕博利珠单抗联合化疗vs化疗的PFS对比。共763例患者(其中281例CPS≥10)随机分配至帕博利珠单抗组(256例)、帕博利珠单抗联合化疗组(257例)和化疗组(250例),其中MSI-H患者共50例,3组分别为14例、17例和19例。研究的中位随访时间为11.3个月。
在总体人群中,CPS≥1的患者中,帕博利珠单抗组的OS非劣效于化疗组(HR=0.91,95% CI 0.69~1.18;图7);但在CPS≥10的患者中,帕博利珠单抗vs化疗的OS获得了临床意义上的延长,中位OS分别为17.4个月和10.8个月(HR=0.69,95% CI 0.49~0.97;图7),但该差异未事先设定统计学分析。
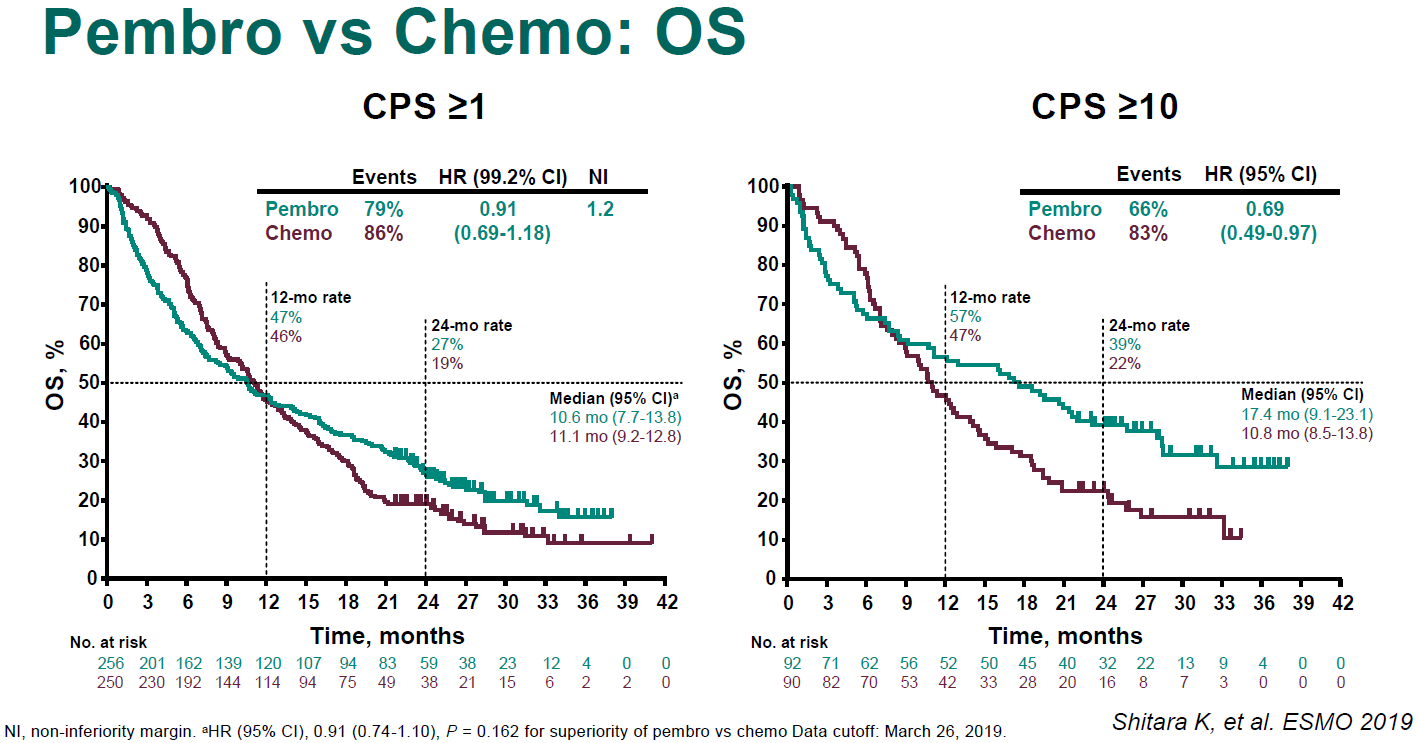
图7. 在CPS≥1或CPS≥10的患者中,P 组vs C组的OS对比
探索性分析中,研究者根据患者的MSI状态进行分组。在MSI-H型且CPS ≥1的患者中,帕博利珠单抗组vs化疗组的中位OS为尚未达到vs 8.5个月(HR=0.29,95% CI 0.11~0.81;图8);MSI-H型且CPS≥10的患者中,帕博利珠单抗组vs化疗组的OS也观察到显著获益,中位OS分别为尚未达到vs 13.6个月(HR=0.21,95% CI 0.06~0.83;图8)。但在非MSI-H型患者中,进一步根据CPS≥1和CPS≥10进行分组,帕博利珠单抗组vs化疗组的OS均未观察到显著差异,HR分别为0.94(0.77~1.14)和0.76(0.54~1.09)。
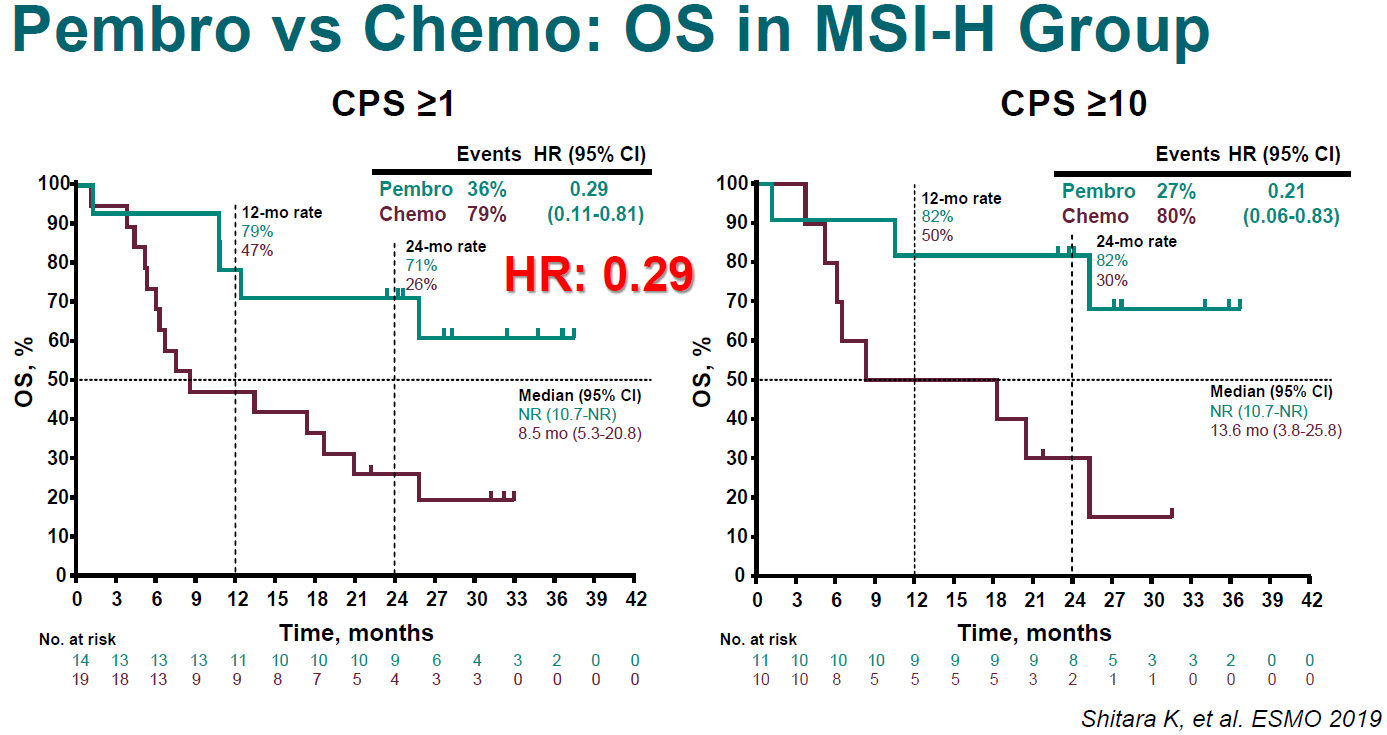
图8. MSH-H型患者中,P组 vs C组的OS对比
总体人群中,PFS对比分析显示,在CPS≥1和CPS≥10的患者中,帕博利珠单抗组vs化疗组的PFS HR分别为1.66和1.10。ORR对比显示,在CPS≥1的患者中,帕博利珠单抗组vs化疗组的ORR 分别为14.8% 和37.2%,但帕博利珠单抗组较化疗组的中位DOR更长,分别为13.7个月和6.8个月;在CPS≥10的患者中,帕博利珠单抗组vs化疗组的ORR 分别为25.0% vs 37.8%,但帕博利珠单抗组较化疗组的中位DOR更长,分别为19.3个月和6.8个月,见图9。
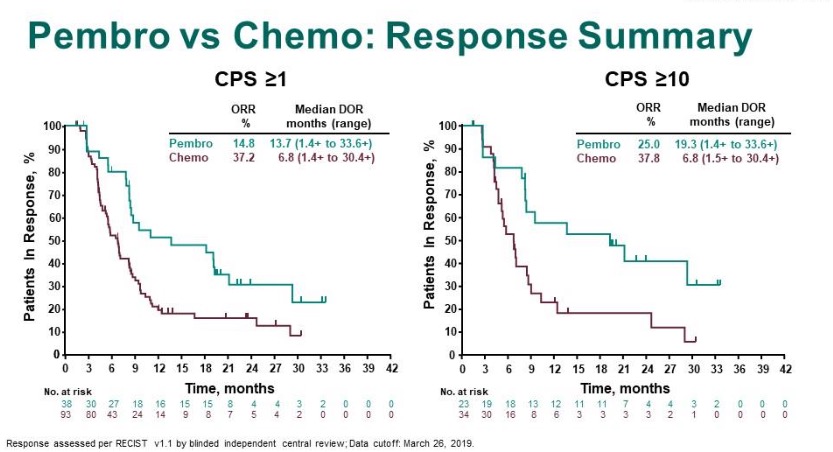 图9. 在CPS≥1或CPS≥10的患者中,P组和C组的ORR和DOR对比
图9. 在CPS≥1或CPS≥10的患者中,P组和C组的ORR和DOR对比
探索性分析中,在MSI-H型且CPS≥1的患者中,帕博利珠单抗组vs化疗组的中位PFS分别为11.2个月和6.6个月(HR=0.72,95% CI 0.31~1.68),帕博利珠单抗组vs化疗组的ORR明显更高,分别为57.1% vs 36.8%,中位DOR也更长,分别为21.2个月和7.0个月(图10)。
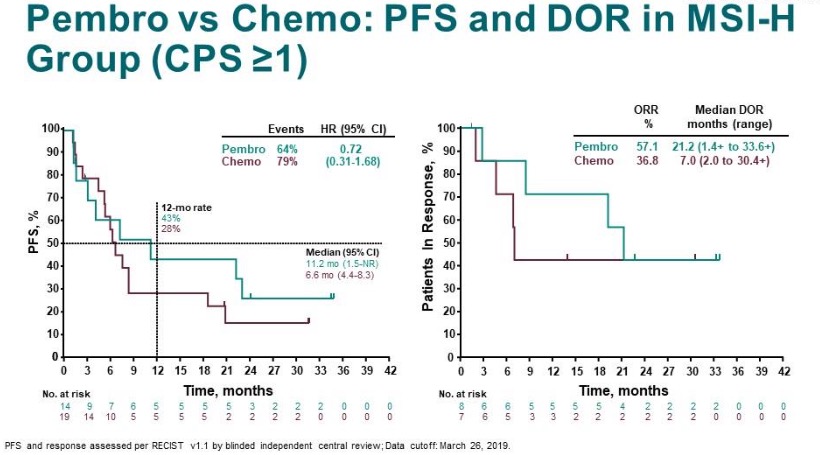 图10. MSH-H型患者中,P vs C组的PFS和DOR对比
图10. MSH-H型患者中,P vs C组的PFS和DOR对比
KEYNOTE-062研究达到了帕博利珠单抗相比于化疗的非劣效性终点:在CPS≥1的患者中,帕博利珠单抗对比化疗用于晚期G/GEJ癌一线治疗,OS获益相似;在CPS≥10的患者中,帕博利珠单抗对比化疗组的OS有临床意义上的获益。且帕博利珠单抗组的耐受性更好。因此,对于化疗耐受不佳且CPS≥1的患者,帕博利珠单抗提供了一个新的选择。而对于CPS≥10的患者,在排除了不适合免疫单药治疗的不良因素后,帕博利珠单抗单药也可作为一线治疗选择之一。本届ESMO大会上发布的这项探索性分析选取了MSI-H型患者亚组,众所周知,MSI-H在各个实体瘤中都是预示免疫治疗疗效更好的生物标志物。毫无意外,这项探索性分析中,对于MSI-H患者,无论CPS≥1还是CPS≥10,免疫治疗的疗效都得以明显放大,帕博利珠单抗组与化疗组的OS曲线明显分离,CPS≥1和CPS≥10的患者中,死亡风险分别下降71%(HR=0.29)和79%(HR=0.21)。
1. Pembrolizumab vs chemotherapy in patients with advanced/metastatic adenocarcinoma (ac) or squamous cell carcinoma (SCC) of the esophagus as second-line therapy: analysis of the chinese subgroup in KEYNOTE-181. 2019 ESMO, abs 760P.
2. A phase 1b trial of lenvatinib (LEN) plus pembrolizumab (PEMBRO) in unresectable hepatocellular carcinoma (uHCC): updated results. 2019 ESMO, abs 747P.
3. First-line pembrolizumab (P), trastuzumab (T), capecitabine (C) and oxaliplatin (O) in HER2-positive metastatic esophagogastric adenocarcinoma. 2019 ESMO, abs 817P.
4. Pembrolizumab with or without chemotherapy vs chemotherapy in patients with advanced G/GEJ cancer (gc) including outcomes according to microsatellite instability-high (MSI-H) Status in KEYNOTE-062. 2019 ESMO, abs LBA44.











 苏公网安备32059002004080号
苏公网安备32059002004080号


