
第88例
对于HER2阳性乳腺癌,曲妥珠单抗帕妥珠单抗的双靶方案显著提高了患者的病理完全缓解(pathological complete response,pCR)率,同时研究也证实在HER2阳性乳腺癌,pCR与EFS和OS获益相关。因此,对于年轻、有保乳意愿的HER2阳性乳腺癌患者,推荐接受曲妥珠单抗联合帕妥珠单抗的双靶新辅助治疗方案,有望达到pCR,实现保乳目标。

常德市第一人民医院乳甲外科
湖南省预防医学会甲状腺疾病防治专业委员会委员
湖南省健康服务业协会乳腺健康分会常务理事
常德市抗癌协会委员
基本情况
患者女性,38岁,未绝经,发现左乳肿块8个月就诊。既往体健,个人史无特殊,孕4产2流2,末次月经为2019年2月10日,母亲患乳腺癌。
现病史
2018年4月,患者无意间发现左乳腺一无痛性肿块,未在意,后自觉包块增大,于2019年2月17日第一次入院。专科查体:左乳中央区可扪及一4.5 cm × 3.0 cm的包块,质硬,无触痛,边界欠清,活动可;无乳头溢液及凹陷;无橘皮样外观。左腋下多枚肿大淋巴结,活动,较大者约1.5 cm × 1.0 cm。左锁骨上下未扪及肿大淋巴结。乳腺+腋窝淋巴结彩超:左乳中央区有一低回声结节约4.0 cm × 2.2 cm,形态不规则、边界不清,BI-RADS5级;左腋窝见多枚异形淋巴结,较大者约15 mm × 11 mm。锁骨上下及颈部淋巴结彩超:未见明显异常。妇科、心脏彩超:未见明显异常。脑部CT、胸腹CT平扫+增强:未见异常。骨扫描:未见异常。乳腺MRI:左乳腺肿物约43 mm × 24 mm,形态不规则、边界不清,BI-RADS5级。行左腋窝见多枚淋巴结,较大者约16 mm × 11 mm,考虑转移。左乳肿块粗针穿刺活检(2019年2月21日):左乳浸润性导管癌,免疫组化:HER2(3+)、ER(-)PR(-)Ki67(50%)。左腋窝淋巴结细针穿刺可见腺癌组织。诊断:左乳浸润性导管癌cT2N1M0,ⅡB期,HER2过表达型。
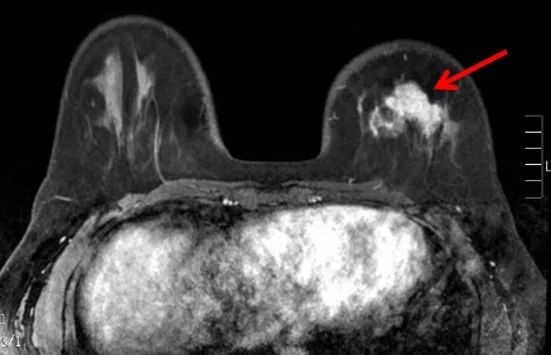
图1. 乳腺MRI检查
新辅助治疗
综合考虑后拟予以新辅助治疗。新辅助治疗前于肿瘤表面皮肤做纹身标记。按照疗效评估标准进行评估。每个周期通过查体和彩超评价肿瘤大小,每两个周期通过乳腺MRI评估肿瘤大小。完善相关检查及评估后,于2019年2月23日开始予PTH(曲妥珠单抗424 mg q3w + 帕妥珠单抗840 mg q3w + 多西他赛115 mg q3w)方案新辅助治疗4周期,患者耐受性可。(注:帕妥珠单抗(P)首剂840 mg,之后420 mg;曲妥珠单抗(H)首剂8 mg/kg(424 mg),之后6 mg/kg(318 mg))。完成两个周期新辅助治疗后(2019年4月4日)复查乳腺MRI:左乳肿块缩小(43 mm × 24 mm缩小至25 mm × 12 mm)。淋巴结缩小( 16 mm × 11 mm缩小至12 mm × 8 mm )疗效评价:PR。完成四个周期新辅助治疗后(2019年5月6日)复查乳腺MRI :左乳肿块缩小(25 mm × 12 mm缩小至12 mm × 7 mm)。淋巴结缩小( 12 mm × 8 mm缩小至7 mm × 5 mm )疗效评价:PR。
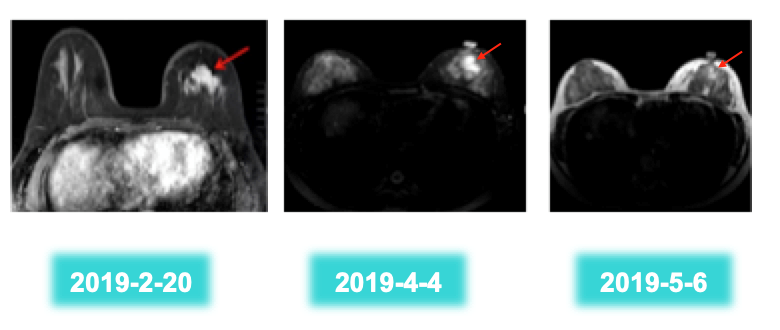
图2. 新辅助PTH方案治疗2周期和4周期后胸腹部CT检查
手术治疗
术前积极完善相关检查及评估,就手术方式和患者进行详细的交流,患者有强烈的美容愿望,于2019年5月8日在全麻下行左乳癌保乳+左腋窝淋巴结清扫+背阔肌皮瓣I期重建术。术后病理:左侧乳腺瘤区纤维囊性变,仅见少许原位癌成分。各切缘及乳头、皮肤、基底未见癌,淋巴结未见癌转移(腋窝淋巴结I水平:0/18,Ⅱ水平0/5 ),免疫组化:HER2(3+),ER(-),PR(-),Ki-67指数约10%。新辅助治疗评价:pCR。
辅助治疗
2019年5月18日,患者因为经济原因,继续完成1年曲妥珠单抗靶向治疗,同时完成FEC方案辅助化疗,辅助化疗完成后继续放疗。目前定期复查评估中。
总结
患者38岁未绝经女性,因发现左乳肿物8个月就诊,2019年2月21日行左乳肿物穿刺,病理示:左乳腺浸润性导管癌,免疫组化结果:HER2(3+)、ER(-)PR(-)Ki67(50%),左腋窝淋巴结细针穿刺可见腺癌组织。诊断为:左乳浸润性导管癌(cT2N1M0,IIB期,HER2阳性型)。行PTH方案新辅助治疗2个周期后,肿物缩小,疗效评价为PR;后继续接受PTH方案新辅助治疗2个周期,继续维持PR。于2019年5月8日在全麻下行左乳癌保乳+左腋窝淋巴结清扫+背阔肌皮瓣I期重建术。术后病理仅见少许原位癌成分,评价为pCR。术后接受辅助曲妥珠单抗靶向治疗,FEC化疗,同时行辅助放疗,期间定期复查未见明显新发转移或进展征象。
专家点评

复旦大学附属华东医院普外科甲乳专业组
中国临床肿瘤学会CSCO青年专家委员会 秘书
上海市抗癌协会乳腺癌专业青年委员会 副主任委员
中国临床肿瘤学会CSCO 患教专委会委员
中国研究型医院学会乳腺专业委员会委员
中国抗癌协会乳腺癌专业委员会CBCS青年委员
中国抗癌协会肿瘤精准治疗专委会青年委员
中国医促会乳腺癌专委会青年委员
中国妇幼保健协会青年委员
上海市抗癌协会乳腺癌专业委员会委员
上海市中西医结合学会乳腺病专业委员会委员
上海市中西医结合学会甲状腺专业委员会委员
上海市中医乳腺病专业委员会委员
上海市卫生发展基金会首批优青培养计划 专业班班长
点评
患者为年轻绝经前女性,术前诊断为cT2N1M0,HER2阳性型,通过新辅助治疗到辅助治疗的全程设计,使患者获得了很好的疗效,结合CBCS指南及CSCO乳腺癌诊疗指南,对患者的治疗决策有如下思考:
1. 双靶向新辅助治疗可以达到降期保乳的目的
CBCS指南中指出,对于局部晚期患者或IIA以上有保乳要求患者,可以考虑新辅助治疗。CSCO乳腺癌诊疗指南2019版中指出,对于T > 5 cm、LN+、TNBC、HER2+、有保乳意愿的患者,可以考虑新辅助治疗。新辅助治疗的适应症不再仅仅依据临床分期,还应结合分子分型、临床分期及患者意愿做个体化决策。这例患者为腋窝淋巴结转移,HER2+型,且为年轻女性,有保乳意愿,可以考虑进行新辅助治疗。那么如何选择新辅助方案呢?研究表明,新辅助化疗结束后,评估患者术后是否达到病理学完全缓解(pCR)对治疗具有重要意义。新辅助治疗后获得pCR是重要的生存指标,尤其是对于HER2阳性患者,新辅助治疗取得pCR可以改善EFS及OS。对于这例患者可供选择的新辅助方案包括TAC、AC-T、AC-TH、TCbH和PTH等。NOAH研究确立曲妥珠单抗新辅助治疗地位的研究,曲妥珠单抗联合化疗组5年随访EFS和OS显著高于对照化疗组。CSCO乳腺癌诊疗指南中也指出,对于HER2阳性患者新辅助治疗,曲妥珠单抗联合化疗与单用化疗相比能够显著提高pCR率,对于HER2阳性乳腺癌新辅助治疗推荐含曲妥珠单抗的方案。因此,该患者新辅助治疗方案应选择含曲妥珠单抗联合化疗的方案。是否可以进一步提高新辅助的疗效呢?NeoSphere研究评估了帕妥珠单抗+曲妥珠单抗+多西他赛(PHT)治疗的疗效,结果显示PH双靶联合化疗较单靶联合化疗或PH单纯双靶无化疗方案,可显著提高pCR率并改善患者预后。正是基于NeoSphere的研究结果,美国FDA将帕妥珠单抗纳入审评快速通道并纳入了欧美诸多指南共识,2019版CSCO乳腺癌诊疗指南也将PHT双靶方案列入指南推荐。可以看到,双靶联合化疗的新辅助方案在该例患者中呈现了非常显著的效果,接受了4周期治疗后便取得了pCR。
2. 年轻患者手术方式如何选择?
对于年轻患者,在手术设计中应充分平衡疗效与美观,对于近5cm的初治肿瘤,我们当然可以考虑直接行全乳切除,但对患者心理创伤大,如行Ⅱ期重建则会面临二次手术问题。我们也可以考虑全乳切除+I期假体重建,但这例患者术后需要辅助放疗,可造成一定比率的假体包膜挛缩,影响美观。相对合理的选择应该是降期后行保乳术,既能保留住乳房外形,又保证了肿瘤的R0切除,这也是体现了从新辅助到手术的全程设计理念。但该患者在新辅助评估中,乳腺MRI判断该患者新辅助后肿瘤退缩模式为筛状退缩(非向心性),故术中切缘的选择还是以化疗前的范围为标准,但这样切除的范围较大,影响美观。所以,患者选择了保乳+用背阔肌皮瓣再造乳房,不仅手术时间较短、术后恢复较快、而且美容效果突出。它是利用自体组织重建乳房,术后美观自然、具有适当的柔软度,可塑性高,且重建后的乳房可耐受放射线照射,有长久的安全性。这一手术方式突破了保乳术切除范围的限制,扩大了保乳手术的适应症。关于腋窝淋巴结的处理,鉴于患者术前腋窝淋巴结阳性,新辅助治疗后行前哨淋巴结活检仍有争议,CBCS指南和CSCO乳腺癌诊疗指南均不推荐3. HER2阳性乳腺癌新辅助治疗完成后达到pCR,术后的辅助治疗该如何决策
3.HER2阳性乳腺癌新辅助治疗完成后达到pCR,术后的辅助治疗该如何决策?
APHINITY证实研究,双靶联合化疗对于淋巴结阳性高危亚组获益更多(4年iDFS率:89.9% vs 86.7%)、对于ER阴性高危亚组获益更多(4年iDFS 率:91.0% vs 88.7%)。同时根据KATHERINE临床研究,新辅助靶向治疗未达到pCR患者,术后换用T-DM1可以改善患者的iDFS,3年iDFS绝对获益达到11.3%(iDFS率: 88.3% vs 77.0%)。该患者新辅助后达到pCR ,故不推荐辅助换用T-DM1强化治疗,可考虑参照PEONY研究的设计维持辅助阶段的双靶治疗。此外,患者为高危复发人群,年轻,心脏功能良好,根据NeoSphere及PEONY研究,术后继续完成FEC方案辅助化疗。所以对于该患者的最佳方案应该是FEC后维持双靶一年的治疗,但鉴于经济因素,最终接受了曲妥珠单抗单靶辅助治疗。目前患者已经完成辅助治疗,建议鼓励患者加强随访,定期复查。
1. Gianni L, Eiermann W, Semiglazov V, Manikhas A, Lluch A, Tjulandin S, et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet 2010;375(9712):377-84.
2. Gianni L, Pienkowski T, Im YH, Roman L, Tseng LM, Liu MC, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol 2012;13(1):25-32.
3. von Minckwitz G, Procter M, de Azambuja E, Zardavas D, Benyunes M, Viale G, et al. Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer. N Engl J Med 2017;377(2):122-131.
4. von Minckwitz G, Huang CS, Mano MS, Loibl S, Mamounas EP, Untch M, et al. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med 2019;380(7):617-628.











 苏公网安备32059002004080号
苏公网安备32059002004080号


