2019年9月7-10日,国际肺癌研究协会(IASLC)主办的第20届世界肺癌大会(WCLC)在西班牙巴塞罗那召开。在本次大会上,来自纪念斯隆凯特琳癌症中心早期药物研发部门的研究室主任、胸部肿瘤科Alexander Drilon教授在全体大会上公布了Ⅰ/Ⅱ期LIBRETTO-001研究中肺癌队列结果。研究结果显示,礼来公司强效选择性RET抑制剂Selpercatinib(LOXO-292)在RET融合基因阳性晚期非小细胞肺癌(NSCLC)患者中显示出优异的疗效和安全性。全体大会后,Alexander Drilon教授接受了【肿瘤资讯】的采访,分享RET融合基因阳性NSCLC的治疗现状,深度解析了LIBRETTO-001研究的结果。

Alexander Drilon教授在WCLC全体大会上
报告LIBRETTO-001研究结果
Selpercatinib(LOXO-292)是一种口服、强效选择性RET抑制剂。据悉,美国FDA已经授予Selpercatinib治疗三类患者的突破性药物资格(BTD),其中包括RET融合基因阳性的非小细胞肺癌和晚期甲状腺癌患者,以及RET基因突变的甲状腺髓样癌患者。另外,礼来公司预计将在2019年年底之前,向美国FDA提交Selpercatinib的新药申请,如果获得批准,Selpercatinib将成为首个用于RET融合基因阳性晚期NSCLC患者的选择性靶向药物。
LIBRETTO-001研究是一个Ⅰ/Ⅱ期研究,旨在探索Selpercatinib在RET改变肿瘤中的疗效和安全性,Alexander Drilon教授本次报告的是Selpercatinib在RET融合基因阳性晚期NSCLC中的疗效和安全性。研究主要终点为客观缓解率(ORR),次要终点包括缓解持续时间(DoR)、无进展生存期(PFS)及安全性。
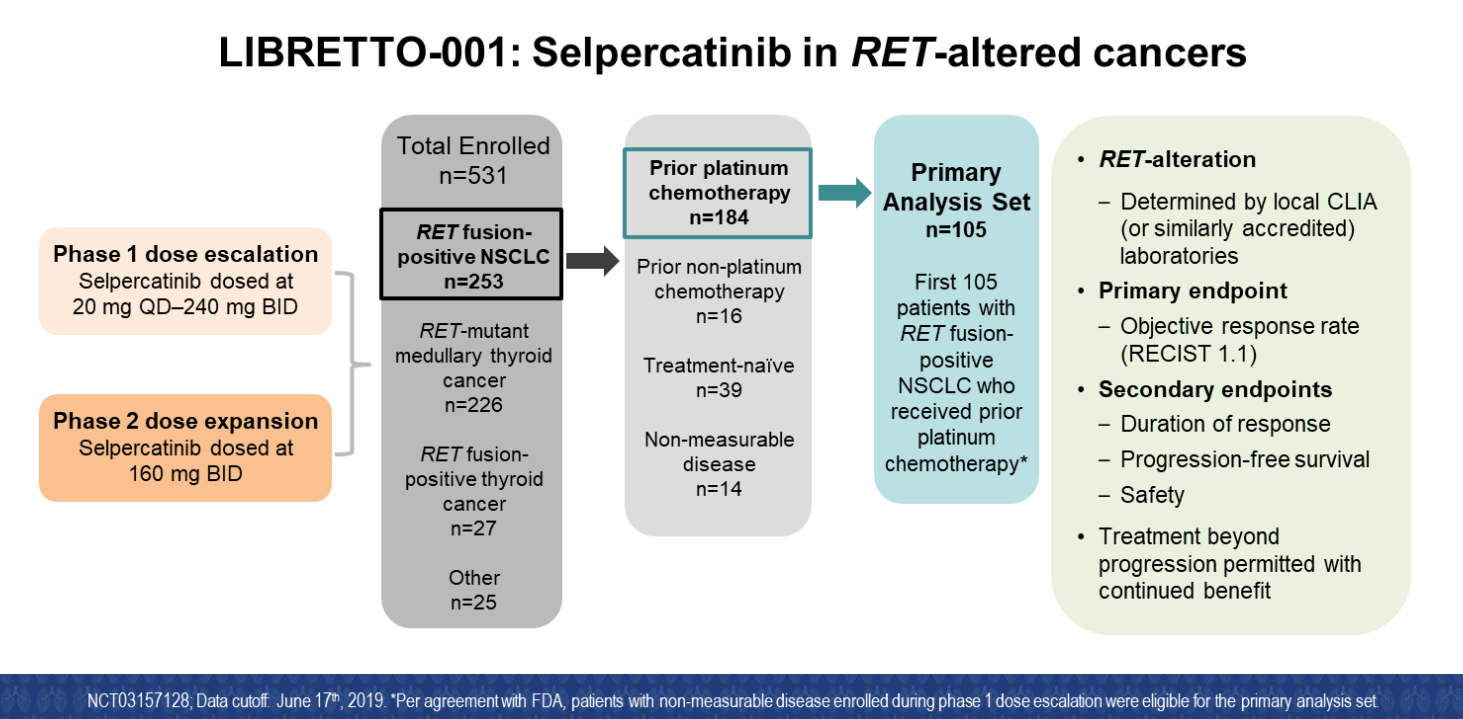
LIBRETTO-001研究设计
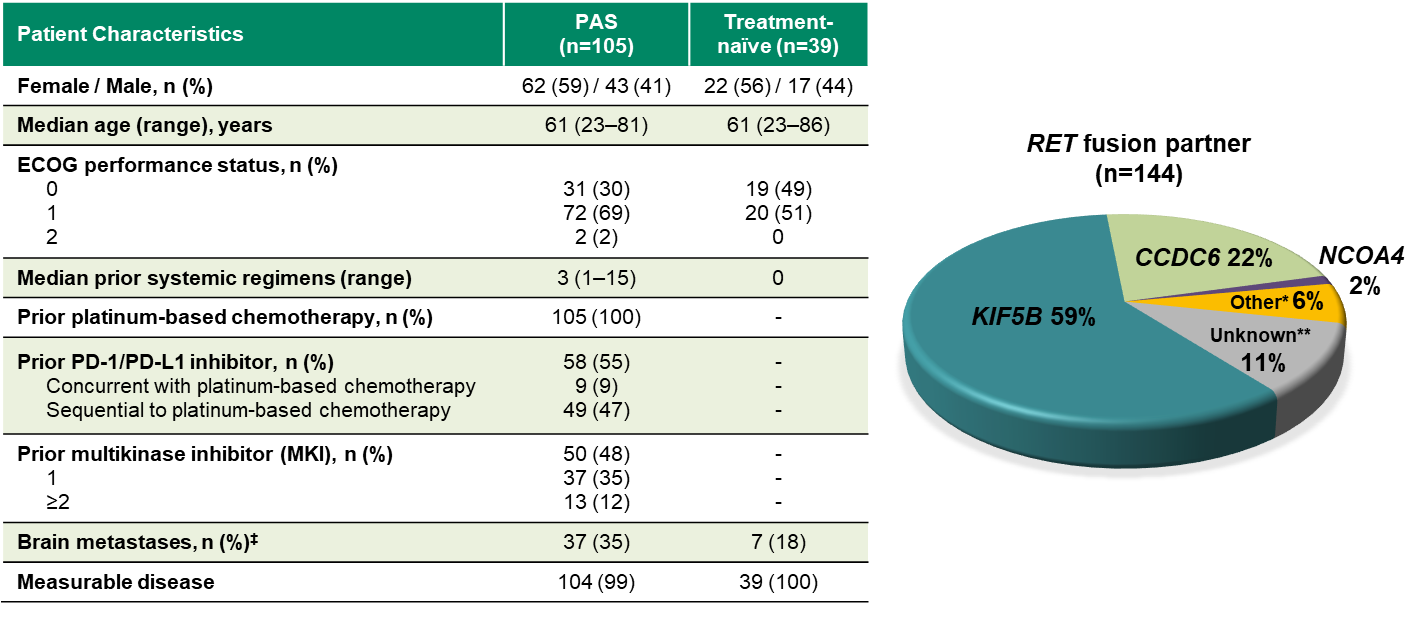
入组患者基线特征
主要终点——ORR
数据截止2019年6月17日,在主要分析集(PAS)——既往接受过铂类为基础化疗的105例患者中,接受Selpercatinib治疗的ORR高达68%(95%CI:58~76%)。11例合并中枢神经系统(CNS)转移的患者,颅内ORR更是高达91%(95%CI:59~100%),其中完全缓解(CR)率为18%,部分缓解率(PR)为73%。
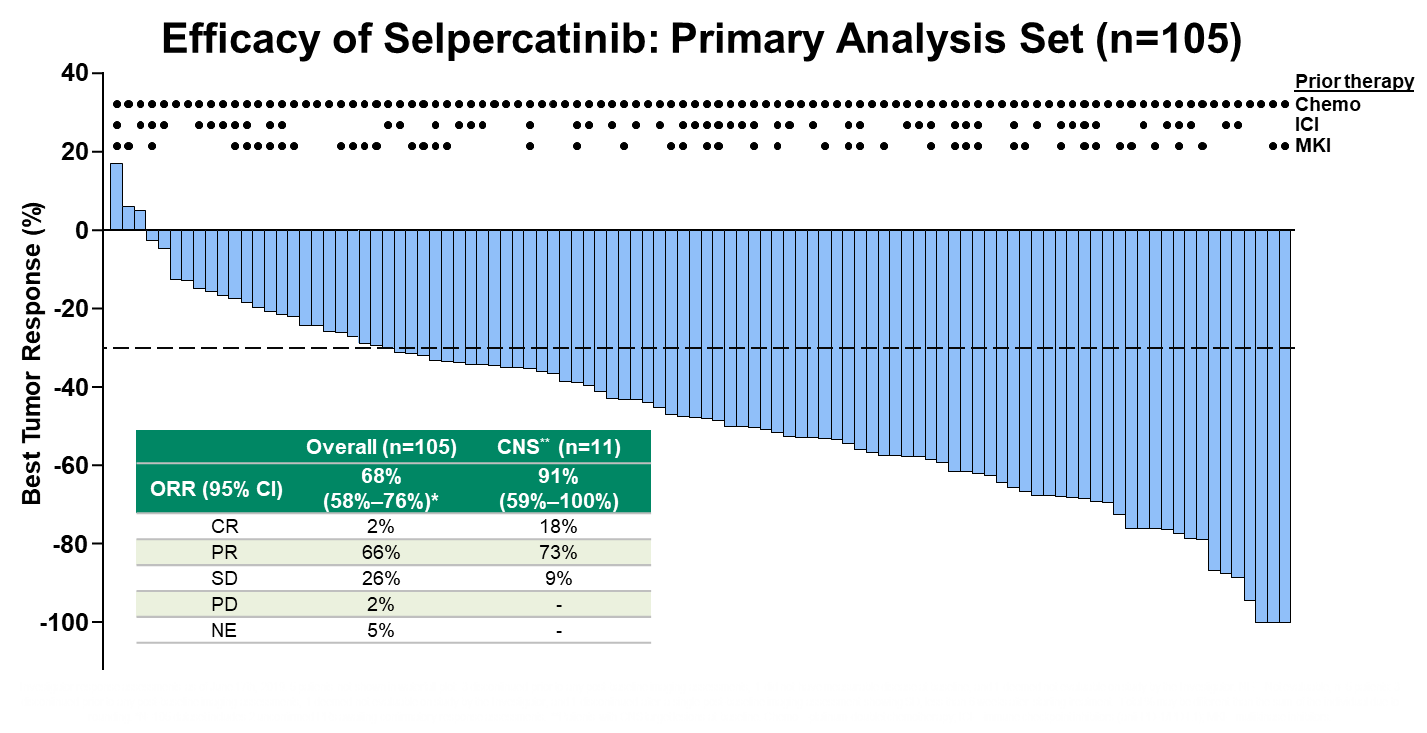
Selpercatinib在先前接受过化疗的患者中的ORR分析
研究纳入39例初治患者,34例可评估患者,接受Selpercatinib治疗的ORR高达85%(95%CI:69~95%)。
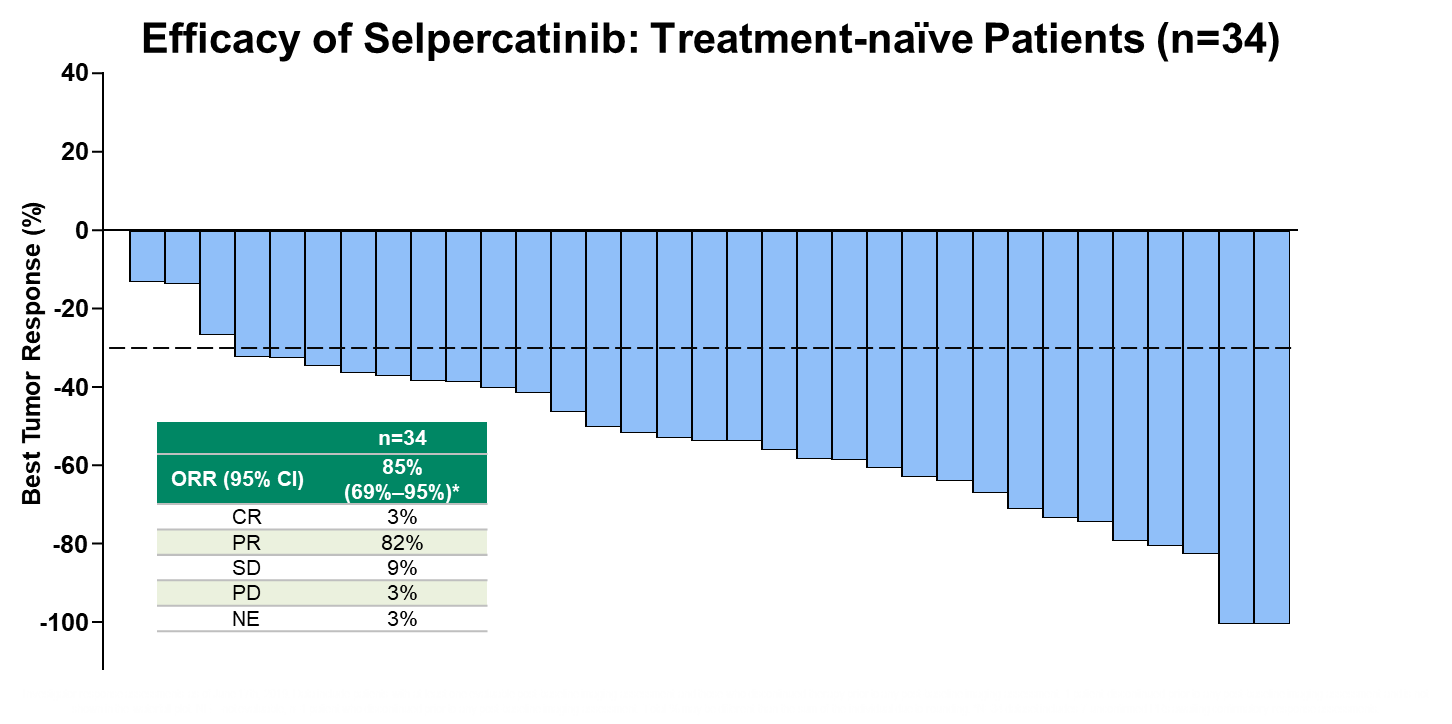
Selpercatinib在未经治疗的患者中的ORR分析
次要终点——DoR和PFS
主要分析集105例患者中,对69例患者进行评估,中位DoR为20.3个月(95%CI:13.8~24.0个月)。在所有105例患者中,中位PFS达到18.4个月(95%CI:12.9~24.9个月)。
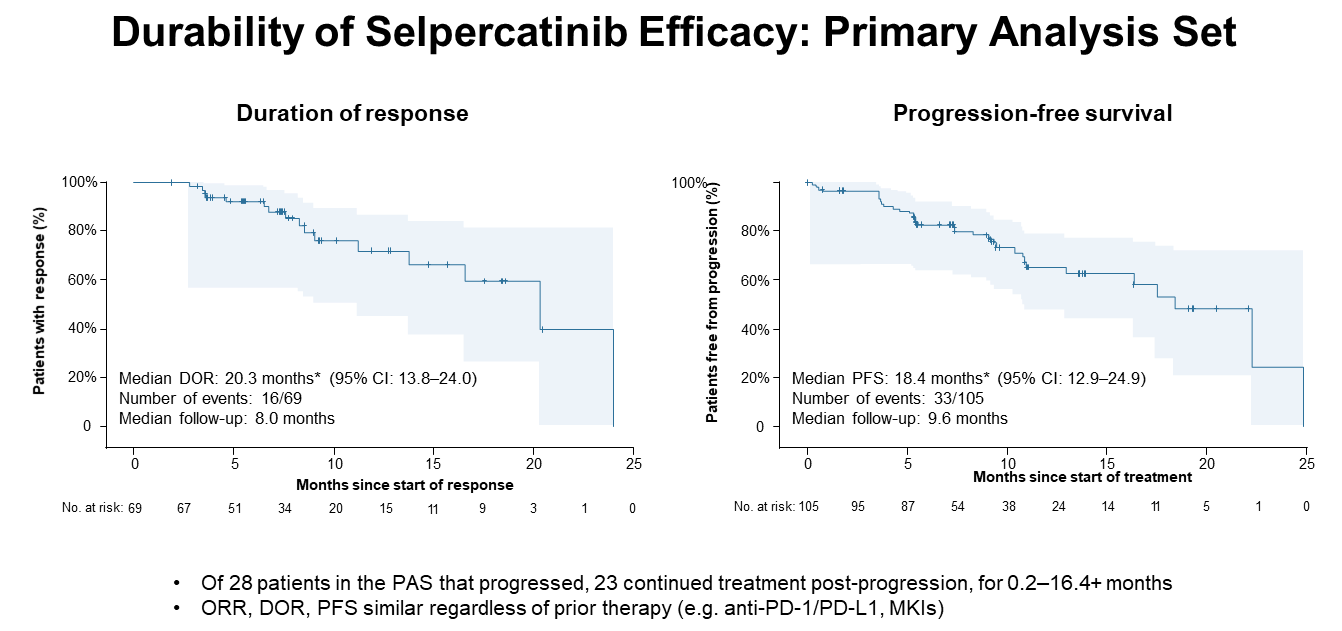
Selpercatinib在先前接受过化疗的患者中的DoR和PFS分析
在39例初治患者中,22例患者进行DoR分析,中位DoR未达到(95%CI:8.3个月~不可评估)。34例患者进行PFS分析,只有4例患者出现疾病进展事件,中位PFS未达到(95%CI:9.2个月~不可评估)。
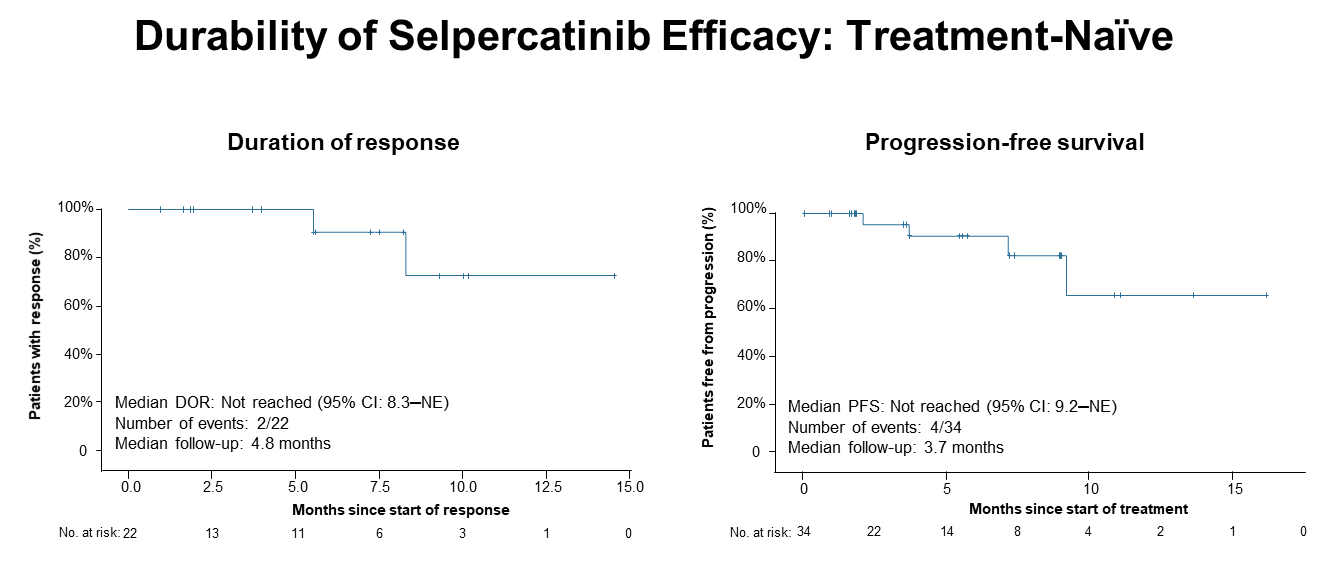
Selpercatinib在未经治疗的患者中的DoR和PFS分析
次要终点——安全性分析
安全性数据显示(N=531),selpercatinib耐受性良好,最常见治疗后出现的不良事件(AEs)为口干、腹泻、高血压、转氨酶升高等,且大多数为1~2级,极少数为4级;更为引人注目的是,531例患者中,仅有9例患者因治疗相关AEs而停药,停药率仅为1.7%。
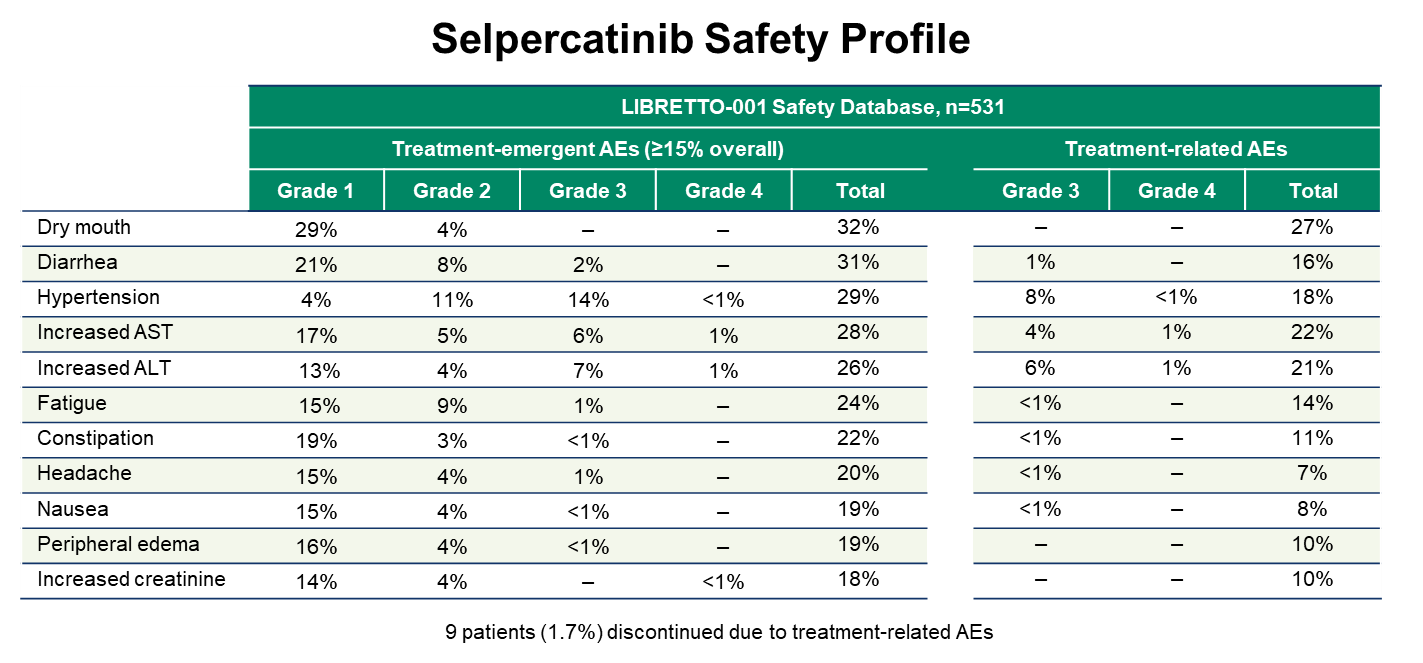
安全性分析
【肿瘤资讯】:能否请您介绍下Ⅰ/Ⅱ期LIBRETTO-001研究及本次大会所公布的最新结果?
Alexander Drilon教授:众所周知,RET基因融合突变是肺癌驱动基因突变之一,在非小细胞肺癌患者中的发生率约为2%,这与其他融合基因突变(比如ROS1)等的发生频率相当。但是,ROS1融合基因突变目前已有了相关的靶向药物进行针对性治疗。
众多的少见融合基因突变,比如ROS1融合基因、ALK融合基因突变等,大多发生于非吸烟或者既往少量吸烟的(患者),尤其是肺腺癌患者中。尽管我们不能仅仅针对该患者人群进行少见融合基因的筛查,但是我们在临床实践中也确实能观察到这些少见融合基因发生于其他人群,比如既往吸烟严重的患者,或者其他病理类型,比如肺鳞癌、肺神经内分泌肿瘤等的患者中。
虽然研究者已经于1985年首次发现RET融合基因突变,但在这35年以来,我们目前仍旧没有有效的靶向药,能够针对性地治疗该肺癌患者人群。至今已有的关于新靶点药物的研究尚未达到临床实际应用的要求。此外,虽然既往也有一些多重激酶抑制剂进入临床试验,但是这些抑制剂的毒性较大,而且客观缓解率也较为一般。
与既往的多重激酶抑制剂,包括卡博替尼(Cabozantinib)、凡德他尼(Vandetanib)、乐伐替尼(Lenvatinib)相比,LIBRETTO-001研究涉及的新药Selpercatinib(LOXO–292)的优势在于,它是一个强效选择性的药物,能有效地针对性抑制携带RET融合突变的肿瘤细胞,并且不会像多重激酶抑制剂那样抑制其他靶点,因此(Selpercatinib)引发的不良反应较少。
回到LIBRETTO-001研究本身。这是一项Ⅰ/Ⅱ期临床试验,旨在研究任何有RET基因融合或突变的不同肿瘤类型,包括甲状腺癌、胰腺癌、肉瘤、非小细胞肺癌等。我们在此次WCLC汇报的结果主要是关于既往接受过含铂双药化疗的RET融合基因突变阳性非小细胞肺癌患者的初步分析结果。
在该项临床试验入组的前105例RET融合基因突变阳性非小细胞肺癌患者中,Selpercatinib治疗的总体客观缓解率高达68%,其中部分患者在化疗进展后接受Selpercatinib治疗,可达到完全缓解。在有中枢神经系统转移的患者中,颅内病灶的总体客观缓解率达到91%。在初步分析的105例患者中,中位缓解持续时间为20.3个月,中位无进展生存期可达到18.4个月。
在另外39例既往未经任何治疗的的RET融合基因突变阳性的晚期非小细胞肺癌患者中,总体客观缓解率更高,达到85%。虽然目前该亚组患者的中位缓解持续时间、无进展生存期等数据尚不成熟,但在数据分析截止期时,上述指标的中位数据尚未达到。
Selpercatinib的安全性和不良反应方面,我们可以看到,因为Selpercatinib是选择性较强的药物,所以Selpercatinib引起的不良反应显著低于既往研究的多重激酶抑制剂。分析数据显示,Selpercatinib相关的3-4级不良反应发生率较低,大多数患者发生的不良反应为1级或2级,这种程度的不良反应在临床上也能够很好地控制,并能保证患者继续接受Selpercatinib的治疗。Selpercatinib相关的,最常见的不良反应依次是口干、腹泻、高血压、肝功能下降等。
我个人认为,最能够全面评价药物耐受性的指标,是药物停止治疗的发生率。在LIBRETTO-001研究招募的总共531例患者中,仅9例因为Selpercatinib相关的严重不良反应而停药,Selpercatinib停药的发生率非常低,仅为1.7%。所以,Selpercatinib不仅在缓解持续时间、控制中枢神经系统转移病灶等方面疗效显著,而且其安全性和耐受性也较高。
另外,我还未提到的、很重要的一点是,对于已经对其他多重激酶抑制剂产生获得性耐药突变的肿瘤病灶,Selpercatinib也体现了较好的疗效。
事实上,美国FDA已经授予Selpercatinib治疗三类患者的突破性药物资格(BTD),其中包括RET融合基因阳性的晚期非小细胞肺癌患者和甲状腺癌患者,以及RET基因突变的晚期甲状腺髓样癌患者。此外,目前也有计划在2019年年底之前,向美国FDA提交Selpercatinib的新药申请。希望我们能够很快看到Selpercatinib获批的消息,这将是治疗RET基因融合或突变的晚期癌症患者的重大胜利。
【肿瘤资讯】:能否请您告知更多关于目前美国FDA审批过程的细节?
Alexander Drilon教授:基于我们今天所讨论过的数据,美国FDA会像审批我们熟知的其他酪氨酸激酶抑制剂一样,对Selpercatinib寄予较高的重视。
【肿瘤资讯】:您认为Selpercatinib在与其他药物联合用药方面的前景如何?是否有希望获得联合用药的适应证呢?
Alexander Drilon教授:首先,在新的适应证方面,正如我前面所说的,该项研究纳入了不同癌种(比如胰腺癌、肉瘤等),或者标准治疗后疾病进展的患者。如果能够在每个亚组中都纳入更多的病例,那么未来有希望扩大Selpercatinib在RET基因融合或突变的任何癌种或者任何疾病阶段的适应证。此外,Selpercatinib在治疗转移性的甲状腺癌患者方面也有一定的疗效,希望将来能够获批该适应证。
其次,在Selpercatinib联合其他药物的治疗方案方面。我个人认为,Selpercatinib单药治疗的疗效较为显著,所以我暂时无法认同Selpercatinib联合第二个药物的意义所在,Selpercatinib联合用药方案还有待认可。
此外,我们无法忽视的一个问题是,Selpercatinib获得性耐药之后该何去何从?目前也有一些新型药物公司在加快对第二代RET融合基因突变靶向药物的研发,希望能在不久的将来能够克服Selpercatinib获得性耐药的问题。

Alexander Drilon教授











 苏公网安备32059002004080号
苏公网安备32059002004080号


