
第64例
乳腺癌中HER2阳性乳腺癌侵袭性强、复发率高,预后不良。临床工作中应秉承“尽早明确HER2,尽早临床获益”和“全程抗HER2,全程要规范”的理念,对于HER2+的晚期乳腺癌患者,需充分告知有所HER2阳性乳腺癌患者及时接受抗HER2全程规范治疗临床获益的必要性和重要意义。

绍兴市人民医院乳甲外科主任,学科带头人,主任医师。
浙江省医学会肿瘤学分会专业委员会委员
中国医药教育协会浙江省分会常委
浙江省抗癌协会乳腺癌专业委员会委员
绍兴市医学会肿瘤外科专委会副主任委员
绍兴市抗癌协会乳腺癌专委会主任委员。
注重乳腺、甲状腺肿瘤的早期诊断,带领团队开展乳腺、甲状腺肿瘤的影像和病理学良恶性鉴别诊断;着力于乳腺、甲状腺的保留功能与美容、微创化手术治疗;在乳腺癌的个体化综合治疗领域与国内、国际最新动态接轨

绍兴市人民医院乳腺甲状腺科副主任
浙江省医学会普通外科专业委员会甲状腺学组委员
浙江省中西医学会乳腺病专业委员会委员
绍兴市抗癌协会乳腺癌专业委员会委员
绍兴市抗癌协会肿瘤康复委员会委员
基本情况
患者女性,63岁,已绝经。否认慢性病、传染病、家族病史。
既往病史
患者于2011年5月行左乳腺癌改良根治术,病理示:左乳浸润性导管癌,WHO Ⅱ-Ⅲ级,大小约为3.6cm×2.0cm×2.0cm,左腋窝淋巴结转移 (1/17)枚,未见脉管和神经侵犯,切缘阴性。免疫组化示:ER(+)、PR(-)、HER2(2+)、Ki-67(90%)。结合患者手术病理,分期为pT2N1M0,Ⅱb期。患者拒绝进一步行HER2原位杂交(in situ hybridization,ISH)检测。术后患者行多西他赛+表柔比星+氟尿嘧啶(CEF)方案3周期序贯T 3周期化疗,化疗结束后口服来曲唑内分泌治疗,未行放疗。
第一次转移
2012年9月,患者因全身多处疼痛就诊, PET-CT示:肝脏、胸椎、肋骨等部位多发代谢增高,结合病史考虑转移。因患者拒绝肝穿刺活检,故将既往手术病理进行会诊,结果示:ER(+40%)、PR(-)、HER2(3+)。其无病生存期(disease-free survival,DFS)为16个月。结合患者既往病史、病理结果和治疗史,一线给予多西他赛+卡铂联合曲妥珠单抗(TCbH)方案治疗,同时每月给予唑来膦酸。6周期化疗后给予曲妥珠单抗维持治疗。3周期治疗后复查,综合疗效评价为部分缓解(partial response,PR)。6周期治疗后复查综合疗效评价维持PR(图1)。患者曲妥珠单抗治疗1年,因个人原因不再行靶向治疗,采用依西美坦联合唑来膦酸维持治疗,定期复查随诊。
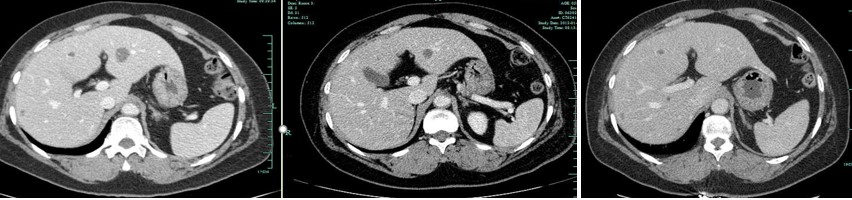
图1 患者一线TCbH方案化疗
(左:3周期治疗后,中:6周期治疗后,右:治疗后半年)
第二次转移
2015年7月,患者复查肿瘤标记物CA15-3明显增高,腹部CT示:肝脏转移灶消失,可见腹主动脉旁多发淋巴结肿大,结合病史考虑腹膜后多发淋巴结转移(图2)。PET-CT示:腹主动脉旁多发淋巴结代谢增高,结合病史考虑转移可能。综合疗效评价为病情进展(progressive disease,PD),无进展生存期(progression-free survival, PFS)为31个月。患者于2015年8月起行TCbH方案治疗6周期化疗及靶向治疗,腹主动脉旁淋巴结逐渐缩小、消失(图3,4),肿瘤指标恢复正常。遵医嘱维持曲妥珠单抗靶向及唑来膦酸治疗,建议患者联合依西美坦,但患者拒绝,定期复查随访。

图2 腹部CT示腹膜后多发淋巴结转移(2015年7月)
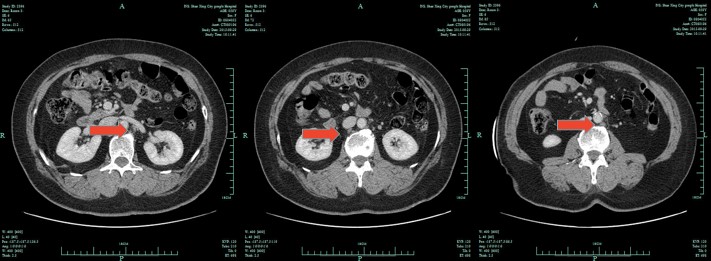
图3 腹部CT示腹膜后多发淋巴结转移缩小(2015年9月)
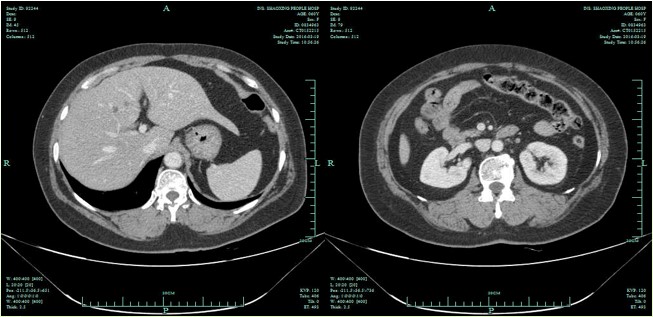
图4 腹部CT示肝脏无转移灶,腹主动脉旁无肿大淋巴结(2016年3月)
第三次转移
患者2017年3月患者在曲妥珠单抗维持治疗期间出现头痛、头晕,伴恶心症状。颅脑MR示:左侧小脑半球后缘区占位,大小约20mm×22mm×24mm,结合病史考虑转移可能(图5)。综合疗效评价为PD,PFS 2为 19个月。患者在外院行左侧小脑半球后缘区占位伽马刀治疗,治疗结束后继续曲妥珠单抗联合拉帕替尼治疗至今,定期复查腹部彩超未见肝脏及腹膜后转移病灶,左小脑转移灶消失逐渐,肿瘤指标在正常范围。截至目前PFS为26个月。
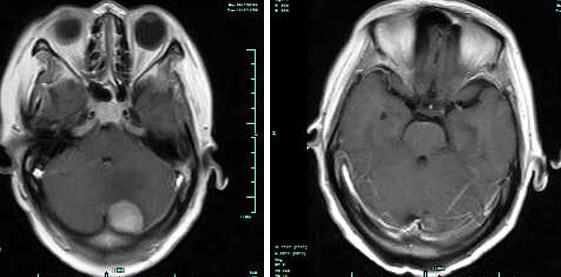
图5 患者率脑转移灶(左)及治疗后(右)
意外状况
在治疗期间,患者隐瞒病史于2018年8月就诊于当地口腔医院拔除右下颌龋齿,准备镶牙。拔牙后一周出现右侧下颌骨肿痛,结合病史考虑唑来膦酸使用期间因拔牙导致的下颌骨坏死,随立即停用唑来膦酸并给予口服抗生素治疗。于2018年11月行右侧下颌骨坏死灶清除术后下颌骨肿痛消失。
点评专家

华中科技大学协和医院肿瘤中心乳腺肿瘤科主任
中国临床肿瘤学会乳腺癌专家委员会常委
中国抗癌协会肿瘤临床化疗专委会常委
中国南方肿瘤临床研究协会乳腺癌专委会常委
中国医师协会精准医疗乳腺癌专委会委员
湖北省抗癌协会乳腺癌专委会副主任委员
湖北省乳腺甲状腺学会副会长
亚太医学生物免疫学会常务理事
湖北省医学生物免疫学会放射免疫专委会主任委员
点评
患者老年女性,已绝经。分析患者年龄、既往治疗和手术病理等情况,结合NCCN 乳腺癌指南和《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》,在治疗方案的选择上有以下几点需要商榷和讨论。
(1)尽早明确HER2,尽早临床获益
目前病理切片常规会进行HER2检测,HER2阳性的定义为:免疫组化(Immunohistochemistry)表达为HER2(3+),或HER2(2+)进一步行FISH检测阳性。该患者在术后病理提示HER2(2+),未及时进行FISH检测确认,在辅助化疗阶段未进行有效的抗HER2治疗,可能是日后疾病复发、DFS较短的原因。
曲妥珠单抗是目前应用最基础、最主要的抗HER2靶向药物,既往以HERA、NOAH [1~2]等为代表的一系列研究多次证实曲妥珠单抗用于HER2阳性乳腺癌的靶向治疗,能够显著提高HER2阳性早期乳腺癌的治愈机会,显著延长HER2阳性晚期乳腺癌患者的总生存期(OS),显著降低复发和病死风险。该患者若能及时明确HER2状态,并在辅助治疗阶段选择合理的抗HER2辅助治疗方案,其无病生存时间可能更长。
(2)一线治疗与维持方案
目前国际上HER2阳性晚期乳腺癌标准一线治疗为帕妥珠单抗、曲妥珠单抗双靶向联合多西他赛,且帕妥珠单抗已经在中国上市,因此HER2阳性晚期乳腺癌患者可以在一线治疗时选择帕妥珠单抗+曲妥珠单抗的双靶方案,未来若帕妥珠单抗能够与曲妥珠单抗一样纳入医保,将有更多患者从曲帕双靶方案中获益。但2012年帕妥珠单抗在国内还未上市,所以该患者复发转移后一线采用TCbH方案治疗是合适的,且取得了较为明显的效果,遗憾的是维持治疗时间仅1年,而指南则推荐应维持治疗至疾病进展,如果该患者持续使用抗HER2治疗,有可能获得更长的疾病控制时间。
(3)曲妥珠单抗的再使用
指南推荐,以下患者可以考虑曲妥珠单抗再使用:①新辅助治疗有效;②辅助治疗结束一年以后复发;③解救治疗有效后停药。对于HER2阳性乳腺癌患者,在曲妥珠单抗治疗进展后,持续抑制HER2通路能够持续带来生存获益。因此一线曲妥珠单抗进展后,推荐二线继续使用抗HER2靶向治疗。而对于既往治疗有效,因其他原因停药的患者,优先考虑继续使用曲妥珠单抗。该患者在二线治疗继续选择TCbH方案,PFS达到31个月,再次选择曲妥珠单抗是比较合理的选择。
(4)HER2阳性晚期乳腺癌脑转移治疗方案选择
近年来,乳腺癌脑转移的发生率呈上升趋势,这是因为乳腺癌全身治疗疗效逐步提高,患者生存期延长,而MRI等检查手段的应用也能更多发现无症状脑转移患者。相对而言,HER2阳性乳腺癌发生脑转移的风险较高。一般情况良好、颅外病灶控制好的患者可以考虑局部治疗。而药物治疗也是乳腺癌脑转移重要的治疗手段之一,对于HER2阳性的乳腺癌,发生脑转移后,小分子酪氨酸激酶抑制剂对脑转移有治疗作用。该患者发现脑转移后予以伽玛刀局部治疗,并选择继续曲妥珠单抗加用小分子酪氨酸激酶抑制剂联合使用,脑转移治疗效果令人满意。
总体而言,该患者虽然在初期治疗时未及时确认HER2状态,导致未进行及时的抗HER2治疗,但后期治疗过程中,遵循指南规范及时确认HER2状态,积极进行持续抗HER2治疗,并结合局部治疗处理脑转移病灶,联合小分子酪氨酸激酶抑制剂治疗脑转移,获得了较长的生存期。所以在临床工作中应重视抗HER治疗的早期性,必要性和持续性。
[1] Cameron D, Piccart-Gebhart MJ, Gelber RD, et al; Herceptin Adjuvant (HERA) Trial Study Team. 11 years' follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial. Lancet. 2017;389(10075):1195-1205.
[2] Gianni L, Eiermann W, Semiglazov V, et al. Neoadjuvant and adjuvant trastuzumab in patients with HER2-positive locally advanced breast cancer (NOAH): follow-up of a randomised controlled superiority trial with a parallel HER2-negative cohort.[J]. Lancet Oncology, 2014, 15(6):640-647.
[3] Kataoka K, Tokunaga M, Mizusawa J, et al. A randomized phase II trial of systemic chemotherapy with and without trastuzumab followed by surgery in HER2-positive advanced gastric or esophagogastric junction adenocarcinoma with extensive lymph node metastasis: Japan Clinical Oncology Group study JCO[J]. Japanese Journal of Clinical Oncology, 2015, 45(11):1082-1086.
[4] Slamon D J, Leylandjones B, Shak S, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2[J]. N Engl J Med, 2001,15;344(11):783-792.











 苏公网安备32059002004080号
苏公网安备32059002004080号


