一例HR+/HER2+乳腺癌的多线诊疗探索

(图片来源于网络)
初次见到周阿姨时,她全身浮肿,胸闷,气促,眼神中充满绝望。周阿姨的丈夫张伯伯那焦急又期望的眼神,深深地刺痛着我们医务人员的心。经过尽心处理并发症后,周阿姨体力状况渐渐好转,她期盼进一步治疗的心情给了我们动力,夫妇俩的充分理解也给予了我们信心。科里医务人员详细复习之前外院治疗经过之后,进行了多次讨论并请院外专家会诊,结合患者病情,制定了治疗方案。为了让妻子尽快好起来,张伯伯及女儿寸步不离的服侍其左右。经过积极的治疗,周阿姨状态逐渐好转,更加燃起好好活下去的希望,治疗上更加积极配合。可是使用的靶向药物费用再次成为头痛的问题。2018年将抗癌靶向药纳入本市医保支付范围,久旱逢甘霖,解决大问题。周阿姨在医生查房时经常激动的说:“多亏了你们医务人员的照顾,感谢党的政策,让我活到了今天”。
今年是周阿姨与癌共舞的第九年,周阿姨对生活有了更加深刻的理解,她的故事也给大家带来更多启示:以前觉得得癌了就会面临死亡,事实上,经过合理治疗,能长期带瘤生存,可以活的很好、很阳光,她也把这一观念传达给了身边的癌症病友;在疾病面前,医生和患者是同一个战壕里的战友,在共同敌人面前,要携手共进,永不言弃;家属的陪同能带给患者本人更多的活下去的理由,也增强其抗击肿瘤的信心。
“我珍惜活着的每一天。确诊乳腺癌以后,我的人生开始清零,现在的每一刻都是我多赚的。以前我每天为家里大小事情操心,而这九年我真正开始为自己而活。”这是周阿姨讲述给大家的心声。
即使与癌共舞,生命仍能更精彩。

浦东新区人民医院肿瘤血液科副主任医师
上海市抗癌协会疑难肿瘤专委会委员
中国宋庆龄基金会肿瘤产学研联盟疑难肿瘤专业委员会委员
中美医师学会委员
上海市抗癌协会淋巴瘤专业委员会第二届委员会委员
上海市医学会肿瘤专科分会第十届委员会委员
上海市浦东新区医学会肿瘤专业委员会委员
上海市浦东新区医学会血液病专业委员会委员
上海市浦东新区医学会中西医结合康复专委会委员
上海国际医学中心血液肿瘤疑难会诊平台专家委员

上海市浦东新区人民医院肿瘤血液科主治医师、博士生
中国抗癌协会临床肿瘤学协作专业委员会(CSCO)会员
上海市肿瘤姑息与康复治疗青年委员会委员
基本病史
患者女性,65岁,顺产1女1男。2010年11月因“发现左乳包块”就诊。既往体健,否认慢性病、传染病、家族病史。患者平时因窦性心动过速,长期口服美托洛尔缓释片。
诊断
(左)乳腺浸润性癌术后复发Ⅳ期(rTxNxM1 Ⅳ期)
分子分型:HR阳性HER2阳性型
躯干骨继发恶性肿瘤
胸腹腔积液
肝继发恶性肿瘤
现病史
患者于2010年11月因发现左乳包块到中山医院青浦分院就诊,2010年11月1日行左乳房改良根治术,术后病理:左乳浸润性导管癌,肿块大小2cm×3cm。腋下淋巴结2/17转移。免疫组化:ER(+)、PR(-)、HER2(3+)。
2010年11月16日—2011年4月15日,予长春瑞滨40mg d1,8+表柔比星120mg d1+氟尿嘧啶 500mg d1-3 q3w辅助化疗6周期。患者于2011年5月19日—6月22日在外院放疗,以左胸壁5000cGy/25Fx,左锁骨上区4800cGy/25Fx。并给予依西美坦内分泌治疗及中医药治疗。
2012年8月14日,磁共振示肝左叶膈顶转移灶机会大,肝及左肾囊肿;T12椎体强化结节,转移灶可能。考虑疾病复发。
2012年8月18日—2013年1月23日,外院继续予多西他赛110mg d1+卡培他滨1500mg bid d1-14,q3w化疗8周期,期间3次疗效评价SD。
2013年2月21日—8月19日,予替吉奥60mg bid d1-14 q3w单药口服维持及阿那曲唑内分泌治疗。
2013年8月16日,疗效评价为PD(肝左叶膈顶部转移灶增大)。
2013年8月16日—2014年2月9日,予多西他赛110mg d1+卡培他滨1500mg bid d1-14,q3w化疗11周期。化疗期间4次疗效评估SD。
2014年3月4日、2014年3月25日,予多西他赛110mg d1+替吉奥60mg bid d1-14,q3w)化疗2周期。
2014年4月14日,疗效评价为PD。
2014年4月19日—8月5日,予培美曲塞800mg d1+奥沙利铂150mg d2 q3w化疗6周期。
2014年8月25日,疗效评价为PD(肝左叶膈顶部转移灶增大)。
2014年8月29日—2015年7月2日,予GD方案(吉西他滨1.6 d1+多西他赛60mg d1 q2w)化疗20周期。期间多次疗效评估SD。
2015年3月2日,开始联合曲妥珠单抗每周给药(首剂280mg ,以后每次140mg qw靶向治疗,同时每月予唑来磷酸修复骨质。2015年6月1日,查心脏彩超室左室射血分数60%。2015年7月15日,复查心脏彩超,左室射血分数44%,予以停用曲妥珠单抗。
2015年8月25日,复查心脏彩超示左室射血分数66%。
2015年8月14日—2016年1月5日,予GD方案(吉西他滨1.6 d1+多西他赛60mg d1 q2w)化疗8周期。
2016年2月1日患者于我院就诊,2月4日胸部CT示:①两肺感染,双侧胸腔积液,左侧乳腺Ca术后改变,建议结合临床及抗炎后复查。②扫描包括部分上腹部示腹腔积液(图1)。
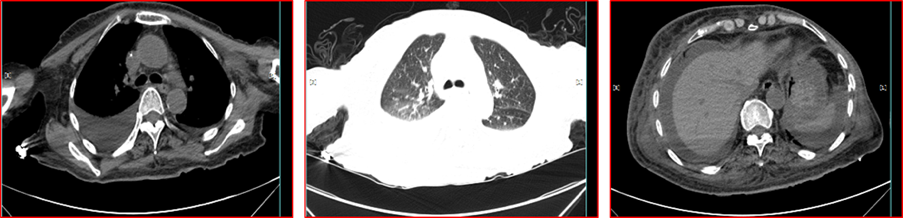
图1 2016年2月4日胸腹部CT
2016年2月27日,患者体能欠佳,PS评分3分。患者及家属强烈要求使用原GD方案(吉西他滨1.2 d1、d8+多西他赛60mg d1 q3w)化疗1周期。2016年4月21日胸腹部CT提示:①两肺感染,双侧胸腔积液较前增多,局部肺不张,左侧乳腺Ca术后改变,建议结合临床及抗炎后复查。②腹腔中-大量积液,较前增多,请结合临床及复查。③肝及左肾小囊肿,胆脾胰右肾输尿管及盆腔CT未见明显异常(图2)。给予胸腔积液引流术,胸水化验提示:多项肿瘤标志物升高。疗效评估PD。
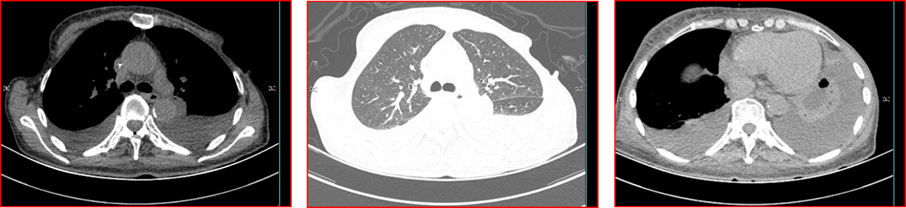
图2 2016年4月21日胸腹部CT
2016年4月24日—11月11日,予靶向拉帕替尼(1250mg qd)联合替吉奥(40mg bid d1-14 q3w)化疗8周期。因出现Ⅲ度腹泻,给予拉帕替尼减量20%。2016年11月8日,胸腹部CT示:胸腹水较前减少(图3)。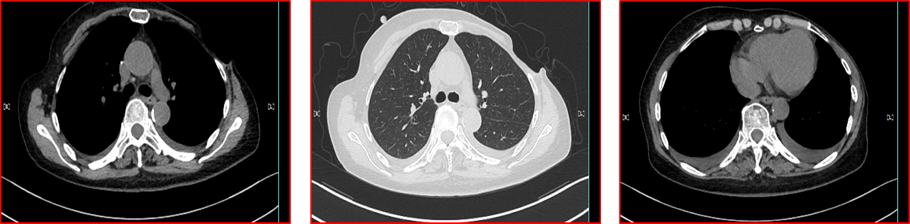
图3 2016年11月8日胸腹部CT
2016年12月9日—2019年4月25日,予靶向拉帕替尼(1000mg qd)联合替吉奥(40mg bid d1-14 q3w)化疗31周期。期间每月给予唑来膦酸钠修复骨质。期间多次疗效评估SD,末次疗效评估时间见2019年03月29日胸腹部CT(图4)。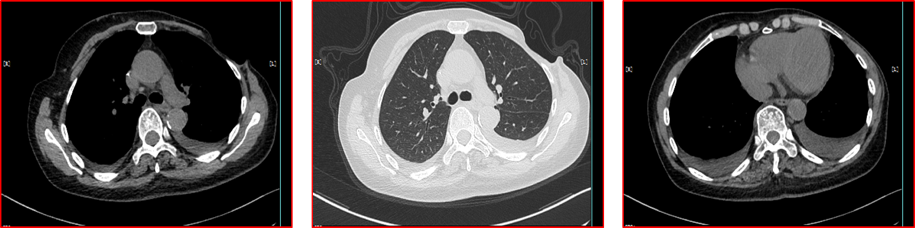
图4 2019年3月29日胸腹部CT
大咖点评

复旦大学附属肿瘤医院肿瘤内科行政副主任、副主任医师
上海市肿瘤化疗质控中心秘书
中国抗癌协会乳腺癌专业委员会委员
CSCO乳腺癌专家委员会委员
中国研究型医院协会乳腺专业委员会青委会副主任委员
中国研究型医院协会乳腺专业委员会常务委员
CSCO肿瘤支持与康复治疗专家委员会常务委员
CSCO青年专家委员会委员
上海市抗癌协会癌症康复与姑息治疗专业委员会常务委员
上海市抗癌协会青年理事
国家食品药品监督管理总局CDE首批化药临床兼职审评员
JCO中文版(泌尿男生殖系统肿瘤专刊)编委
《中华乳腺病杂志》中青年编委
《Precision Cancer Medicine》青年编委
《中国癌症杂志》青年编委

复旦大学附属肿瘤医院肿瘤内科
该患者2010年11月行左乳癌改良根治术,术后病理分期为pT2N1M0 ⅡB期,分子分型为Luminal B2型。患者因经济方面的原因,辅助治疗及晚期多线治疗均未使用抗HER2靶向治疗,因此多次出现疾病进展。2015年3月患者才开始化疗联合曲妥珠单抗的一线抗HER2治疗,后因不能耐受心脏毒性而停用。2016年4月患者接受化疗联合拉帕替尼的二线抗HER2治疗,PFS长达36个月,获益明显。截至目前未见再次复发转移。
1、警惕药物的心脏毒性
心脏毒性是曲妥珠单抗最主要的不良反应,但曲妥珠单抗导致心脏毒性的机制与蒽环类不同,源于心肌细胞上HER2的表达,其心脏毒性是可逆的、程度较轻。但患者既往的心脏疾病史、与蒽环类药物合用、左侧胸壁放疗等都可能会增加曲妥珠单抗的心脏毒性。使用曲妥珠单抗前应常规行心电图及超声心电图检查,LVEF正常时方可使用,治疗期间也应当每三个月复查心功能。根据《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》2019版,LVEF较治疗前绝对数值下降≥16%,或LVEF低于正常范围并且LVEF较治疗前绝对数值下降≥10%时应暂停曲妥珠单抗的使用。若4周-8周内LVEF回升至正常范围则可以考虑恢复曲妥珠单抗的使用。那么是否有药物可以预防曲妥珠单抗产生的心脏毒性?有研究[1]提示,辅助治疗阶段蒽环类药物与曲妥珠单抗联用时,使用赖诺普利或卡维地洛可有效降低心功能不全事件的发生率,晚期乳腺癌患者较少联用蒽环类药物与曲妥珠单抗,而目前暂无循证医学证据证明曲妥珠单抗与其他化疗药物联用时药物的预防作用。拉帕替尼的心脏毒性与曲妥珠单抗相比较轻,不能耐受曲妥珠单抗的患者可换用拉帕替尼。ALLTO临床研究[2]头对头对比了拉帕替尼与曲妥珠单抗在辅助治疗中的疗效,不良反应分析提示拉帕替尼的心脏毒性显著低于曲妥珠单抗。
该患者使用曲妥珠单抗治疗后LVEF降低16%,停用曲妥珠单抗4周后恢复正常,可考虑恢复曲妥珠单抗的使用或更换其他抗HER2靶向药物,但持续抑制HER2通路是重要的。该患者暂停抗HER2治疗显然是不合适的。幸运的是,患者接受拉帕替尼的二线抗HER2治疗,疾病控制良好,PFS长达36个月。但拉帕替尼联合替吉奥的治疗方案是有待商榷的,因为患者既往使用替吉奥方案治疗期间曾出现疾病进展。拉帕替尼联合卡培他滨是标准的治疗方案,患者既往卡培他滨的治疗期间并未出现疾病进展,可以使用考虑拉帕替尼联合卡培他滨。同时一项II期临床研究[3]提示拉帕替尼联合长春瑞滨或吉西他滨也是晚期乳腺癌的可选方案。
2、HER2阳性乳腺癌患者应尽早开始抗HER2治疗
该患者术后分子分型提示为Luminal B2型。根据NSABP B31、NCCTG N9831和 BCIRG006 这三个临床试验结果得知,曲妥珠单抗联合化疗的辅助治疗方案较不包含曲妥珠单抗的方案显著提高HER2阳性的淋巴结阳性及淋巴结阴性高危患者的DFS及OS。同时,APHINITY[4]研究结果提示,与使用含曲妥珠单抗的单靶方案相比,使用含帕妥珠单抗和曲妥珠单抗的双靶方案能够降低 19% 的 iDFS 事件,因此对于有高危复发风险的患者,一定程度上可尝试帕妥珠单抗和曲妥珠单抗双靶向辅助治疗。该患者未进行抗HER2的辅助治疗,存在辅助治疗不足的情况,长春瑞滨+表阿霉素+氟尿嘧啶也并非标准的辅助化疗方案。这些可能都是患者后续复发的重要原因。事实上,对于HER2阴性的淋巴结阳性乳腺癌,阿霉素/表阿霉素联合环磷酰胺(AC/EC)序贯紫杉类(紫杉醇或多西他赛)是最常用的辅助方案,TAC和TC是次选;对于HER2阳性的淋巴结阳性乳腺癌,国内外常用AC/EC-紫杉类+H(±帕妥珠单抗)和TCbH(±帕妥珠单抗);这在《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》2019版中也有体现。
2012年8月患者的辅助检查提示肝转移、骨转移,DFI为9个月。根据《ESO/ESMO晚期乳腺癌国际共识指南》第四版[5]:HER2阳性的晚期乳腺癌患者除非存在禁忌症都应尽早开始抗HER2治疗;对于之前未接受过抗HER2治疗的晚期患者的一线标准治疗方案是化疗+曲妥珠单抗+帕妥珠单抗,已证实此方案获得的OS优于化疗+曲妥珠单抗;当帕妥珠单抗不可获得时,一线治疗方案可选化疗+曲妥珠单抗。但患者复发转移后,多线治疗都未联合抗HER2靶向治疗,这可能是疾病不断进展的原因。2015年3月患者才开始曲妥珠单抗的一线抗HER2治疗,后因LVEF降低≥16%停用曲妥珠单抗。2016年4月患者接受拉帕替尼的二线抗HER2治疗,PFS长达36个月,获益明显。可知,对于HER2阳性乳腺癌而言,抗HER2治疗是获益的关键。
3、多西他赛的再使用
荟萃分析[6]提示,既往蒽环类治疗失败的晚期乳腺癌患者,一线治疗优选紫杉类药物为基础的方案,紫杉类方案较对照组显著改善TTP及OS。一项III期临床试验[7]比较XT方案与单药T方案治疗转移性乳腺癌的疗效,结果提示,与T组相比,XT组可明显延长TTP、OS及ORR。因此,在患者因经济因素不能使用抗HER2靶向治疗时,晚期一线治疗使用卡培他滨联合多西他赛也是可以接受的。但一线化疗8周期结束后,使用替吉奥、阿那曲唑的维持治疗方案则有待商榷。根据《中国晚期乳腺癌维持治疗专家共识》[8],目前临床实践中有三种维持治疗选择:原方案维持、原方案中部分药物维持、换药维持。前两种治疗策略应当首先考虑,因为原方案经过临床实践证明有效,继续应用治疗失败的风险较低。因此,该患者使用卡培他滨维持可能更为合适。患者第二次进展时再次使用多西他赛联合卡培他滨是合适的。一项回顾性研究[9]提示,多西他赛解救治疗有效后停药,再次使用含多西他赛的化疗方案时ORR达到42.5%。因此,既往多西他赛治疗有效而停药的患者可以考虑后线治疗的再使用。
整体而言,本例患者治疗过程中虽然存在部分不足与遗憾,但最后治疗的获益非常明显,值得临床借鉴。
[1] Guglin Maya,Krischer Jeffrey,Tamura Roy et al. Randomized Trial of Lisinopril Versus Carvedilol to Prevent Trastuzumab Cardiotoxicity in Patients With Breast Cancer.[J] .J. Am. Coll. Cardiol., 2019, 73: 2859-2868.
[2] Piccart-Gebhart Martine,Holmes Eileen,Baselga José et al. Adjuvant Lapatinib and Trastuzumab for Early Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer: Results From the Randomized Phase III Adjuvant Lapatinib and/or Trastuzumab Treatment Optimization Trial.[J] .J. Clin. Oncol., 2016, 34: 1034-42.
[3] Gómez Henry L,Neciosup Silvia,Tosello Célia et al. A Phase II Randomized Study of Lapatinib Combined With Capecitabine, Vinorelbine, or Gemcitabine in Patients With HER2-Positive Metastatic Breast Cancer With Progression After a Taxane (Latin American Cooperative Oncology Group 0801 Study).[J] .Clin. Breast Cancer, 2016, 16: 38-44.
[4] MINCKWITZ G, PROCTER M, AZAMBUJA E, et al. APHINITY Steering Committee and Investigators. Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer. N Engl J Med. 2017 Jul 13;377(2):122-131.
[5] Cardoso F,Senkus E,Costa A et al. 4th ESO-ESMO International Consensus Guidelines for Advanced Breast Cancer (ABC 4)†.[J] .Ann. Oncol., 2018, 29: 1634-1657.
[6] Ghersi Davina,Willson Melina L,Chan Matthew Ming Ki et al. Taxane-containing regimens for metastatic breast cancer.[J] .Cochrane Database Syst Rev, 2015, undefined: CD003366.
[7] O'Shaughnessy Joyce,Miles David,Vukelja Svetislava et al. Superior survival with capecitabine plus docetaxel combination therapy in anthracycline-pretreated patients with advanced breast cancer: phase III trial results.[J] .J. Clin. Oncol., 2002, 20: 2812-23.
[8]徐兵河,王树森,江泽飞,邵志敏.中国晚期乳腺癌维持治疗专家共识[J].中华普通外科学文献(电子版),2018,12(01):1-5.
[9] Toulmonde M,Madranges N,Brouste V et al. Docetaxel rechallenge after a first response in non-resistant metastatic breast cancer: significant activity with manageable toxicity.[J] .Breast Cancer Res. Treat., 2012, 134: 325-32.
查阅往期精彩文章:
【新案】艰难中探索,寻找生的希望——一例难治性HR-/HER2+乳腺癌的诊疗探索











 苏公网安备32059002004080号
苏公网安备32059002004080号


