审校 贾友超 河北大学附属医院肿瘤内科
近年来,以单克隆抗体和小分子抑制剂为代表的靶向药物发展如火如荼,除了针对老靶点CD19和CD20抗原的药物外,一些针对B细胞受体信号通路等最新靶点的药物也取得了不错的临床试验结果,部分药物已经上市并使患者获益,让我们逐一梳理。

河北大学附属医院肿瘤内科副主任
淋巴瘤亚专业负责人
河北大学硕士生导师
作为Sub-I参与多项国内外临床试验
河北省抗癌协会淋巴瘤专业委员会 委员
2017年CSCO“35 under 35”最具潜力青年肿瘤医生

河北大学附属医院肿瘤内科淋巴瘤亚专业骨干医师。
中国医药教育协会腹部肿瘤专业委员会委员
北京医学奖励基金会肺癌青委会委员
保定市抗癌协会肿瘤生物治疗专业委员会委员、秘书
1. 概述
在过去的二十年里,一些新的药物已经被监管机构批准用于治疗不同类型的恶性淋巴瘤。在非霍奇金淋巴瘤(NHL)中,大多数新制剂被批准用于滤泡性淋巴瘤。相比之下,30多年来只有两种药物被批准治疗复发的弥漫性大B细胞淋巴瘤。多数情况下,批准的药物靶向单一的分子机制,同时,也有一些被批准的药物靶向相同的致癌信号通路,如PI3K途径和BTK。一些针对细胞内机制的药物正在研究。图1为针对弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤和套细胞淋巴瘤几种新药单药活性的总结。在这篇综述中,我们将重点介绍针对一些新的特异性靶标药物的开发现状。
2. EZH2抑制剂
Zeste同源物2(即EZH2)的增强子是催化组蛋白H3赖氨酸Lys27甲基化(H3K27)的酶亚基。EZH2在生发中心生物学中起着重要的作用。EZH2基因的完全缺失破坏了小鼠生发中心的形成。在滤泡性淋巴瘤和GCB-DLBCL中,杂合的点突变影响EZH2的C碳端具有催化作用SET结构域中的酪氨酸641 (Y641),并且发生率约为15%至20%。Y641是一种功能增益激活突变,导致H3K27me3表达水平升高而基因表达受到抑制。在体内,功能增益激活等位基因突变在GCB细胞中的表达与BCL2蛋白过表达同时发生,加速淋巴瘤的发展,为单独抑制EZH2或联合抑制EZH2和BCL2活性药物的开发提供了理论依据。相反,在骨髓增生异常综合征(MDS)、骨髓增殖性肿瘤(MPN)和T细胞急性淋巴细胞白血病(T-cell acute lymphocytic leukemia)中会出现EZH2基因失活(缺失、移码、无意义和错义突变)。这些研究预示着EZH2失活可能在恶性肿瘤发展中起作用。因此,这引发了大家对于长期使用EZH2抑制剂潜在毒性的关注。
迄今为止,有两种EZH抑制剂在临床开发中,一种选择性靶向EZH2 (tazemetostat, EPZ-6438),另一种同时抑制EZH1和EZH2 (DS-3201b)。在第一项针对复发性淋巴瘤或实体瘤患者的I期临床研究中,tazemetostat显示出合理的安全性和良好的临床活性。21例(38%)B-NHL患者中有8例有主要临床反应,其中3例完全缓解。未达到最大耐受剂量,建议II期剂量为800mg,每日两次。此次实验的目的是观察INI1或SMARCA4阴性实体瘤患者的肿瘤反应。Tazemetostat也在156例FL或DLBCL患者的II期临床试验中进行了评估。根据是否存在EZH2突变对患者进行分组,最高的临床反应率(71%)是存在EZH2突变的FL患者中,然而,在没有突变的FL和GCB-DLBCL中也观察到了临床反应(图1)。最常见的毒性(不分等级)包括疲劳、恶心、咳嗽、腹泻和血小板减少。最近,一种双EZH 1/2抑制剂(DS-3201b)最近在I期临床试验中被评估。DS-3201b在多种B细胞和T细胞NHL亚型中有临床活性,总有效率53%。值得注意的是,在一小部分T细胞淋巴瘤患者中,80%有主要反应。
3. 新的B细胞受体通路
BCR信号通路的异常激活参与了多种B细胞恶性肿瘤的发病机制和进展。Fostamatinib二钠(R788)是第一个通过抑制SYK蛋白来靶向BCR信号通路的药物。然而,最初的临床结果并不理想。随后,开发了几种针对下游蛋白布鲁顿酪氨酸激酶(BTK)的药物。迄今为止,已有两种BTK抑制剂(ibrutinib和acalabrutinib)被批准用于治疗淋巴恶性肿瘤。在NHL中,这些药物目前仅被批准用于治疗复发的MCL患者(图1)。
BTK抑制剂治疗B淋巴细胞恶性肿瘤的成功激发了人们对开发其他药物的热情,这些药物可以破坏增强的B细胞受体信号的不同节点。到目前为止,主要的化合物是针对IRAK4和MALT1的(图2)。
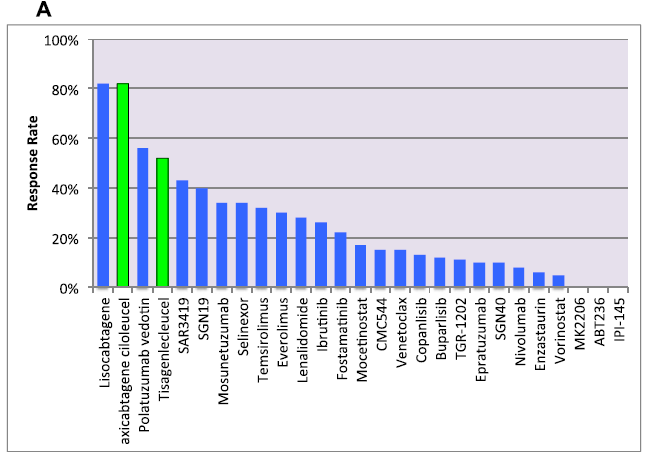
图1常见非霍奇金淋巴瘤(NHL)单药活性。A,弥漫性大B细胞淋巴瘤;B,滤泡性淋巴瘤;C,套细胞淋巴瘤。绿色条表示美国食品和药物管理局(FDA)批准的药物。图1C中的Temsirolimus以散列绿色显示,表明该药物已获得欧洲药物管理局(EMA)的批准,但未获得FDA的批准
3.1 | IRAK4
Toll样受体(TLR)信号转导蛋白MYD88在包括Waldenstrom巨球蛋白血症,边缘区淋巴瘤和弥漫大B细胞淋巴瘤在内的多种淋巴系统恶性肿瘤中经常发生突变。在大多数这些病例中,携带L265P突变的肿瘤对BTK抑制剂更敏感。白细胞介素1受体相关激酶4(IRAK4)几乎参与了MYD88所有的生物学功能,使其成为治疗受MYD88驱动的淋巴系统恶性肿瘤的具有吸引力的靶点(图2)。一项研究显示,IRAK4的小分子抑制剂对含有MYD88 L265P突变的DLBCL具有毒性。从机制上看,IRAK4抑制剂减弱NF-κB和IL-6 / IL-10-JAK-STAT3信号传导途径。此外,BTK或BCL2抑制剂增强了IRAK4抑制剂对DLBCL异种移植模型的抗增殖活性。CA-4948是一种可逆的IRAK4口服激酶抑制剂。CA-4948在ABC-DLBCL MYD88-L265P异种移植瘤模型和患者源性肿瘤中显示出剂量依赖性疗效,并且与抗Bcl-2抑制剂venetoclax具有协同作用。IRAK4抑制剂CA-4948的I期研究目前正在复发和难治性淋巴瘤患者中进行评估(NCT03328078)。
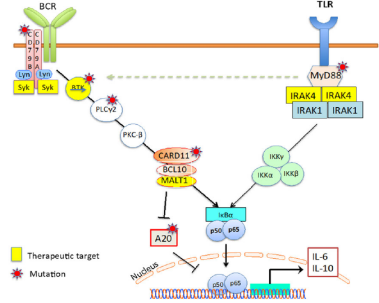
图2 BCR和TLR信号通路相互作用示意图
3.2 | MALT1
1999年,在MALT(黏膜相关淋巴组织)淋巴瘤中发现了新的染色体易位t(11;18)(q21;q21),发现了MALT1基因。融合蛋白的C- 端包含一个与caspases同源的结构域,因此MALT1被定义为“paracaspase”。
MALT1通过调节NF-kB的活化,在激活B淋巴细胞和T淋巴细胞中发挥着关键作用。NF-kB通路的激活是通过多种机制实现的,包括招募TRAF6和切割负调节因子TNFAIP3 (A20)(图2)。因此,MALT1是治疗NF-kB驱动型淋巴瘤,尤其是ABC亚型DLBCL的一个有吸引力的靶点。在临床前试验中,MALT1的共价抑制剂MI-2,以及可逆的MALT1抑制剂甲哌嗪和噻嗪,在体外和小鼠模型中显示了对ABC-DLBCL的有希望的临床活性。其他的MALT1抑制剂也在研发中。虽然目前还没有MALT1抑制剂的临床试验,但Janssen和Abbvie都计划对复发性淋巴瘤患者进行MALT1抑制剂的临床试验。
4.MCL1
B-细胞淋巴瘤2 (BCL2)蛋白家族,是细胞生存和死亡的关键调控因子,由三个功能不同的亚群组成:(1)抗凋亡蛋白(BCL2, BCL-XL, BCL-W,MCL1, A1/BFL-1), (2)促凋亡效应蛋白(BAX和BAK), (3)促凋亡BH3蛋白质(BIM, PUMA, BID ,BAD, BIK ,BMF,NOXA, HRK)。通过使用模拟BH3结构域的小分子,可以实现对抗凋亡蛋白的药理学抑制。这些BH3‐mimetics与BCL2或MCL1结合,导致促凋亡蛋白的释放并触发凋亡。第一个被监管机构批准的BH3模拟药物是venetoclax,一种BCL2选择性口服抑制剂。
C-MCL1基因在人类癌症中被频繁扩增,其蛋白过表达在多种肿瘤中被发现,包括多发性骨髓瘤、急性髓系白血病、慢性髓系白血病、B-细胞急性淋巴母细胞白血病等。Mcl-1能介导对多种细胞毒性药物以及Bcl-2选择性抑制剂 venetoclax 的耐药性。几种Mcl-1选择性抑制剂目前正在临床研发中,用于治疗癌症。AZD5991是一种设计合理、对Mcl-1具有高选择性和亲和力的大环分子,目前正处于临床研发阶段。AZD5991直接与Mcl-1结合,通过激活Bak依赖的AZD5991线粒体凋亡通路,诱导癌细胞快速凋亡。目前,AZD5991的I期临床试验正在对血液系统恶性肿瘤患者进行评估(NCT03218683)。
S63845是一种选择性的BH3模拟的MCL1抑制剂,与BCL-2或BCL-XL没有明显的结合。S63845与人的MCL1的BH3结合沟在Kd为0.19 nM时结。S63845在体外和异种移植小鼠模型中有效地杀死了MCL1依赖性的细胞系。有趣的是,S63845显示出对c-MYC驱动的人的Burkitt淋巴瘤细胞系的强大细胞毒性活性。目前,I期临床试验正在评估S63845对白血病患者的安全性和有效性(NCT02979366)。第三种化合物AMG176是一种强效的、选择性、口服的生物活性MCL1抑制剂,可在体外诱导多种血液恶性肿瘤的快速凋亡。第一阶段AMG176的研究目前正在复发多发性骨髓瘤和白血病患者中评估(NCT02675452)。
5.PRMT5
精氨酸甲基化是由蛋白精氨酸甲基转移酶(PRMTs)催化的翻译后修饰。PRMTs催化组蛋白和非组蛋白上精氨酸残基的单甲基化或二甲基化。PRMTs的异常表达或功能失调与包括癌症在内的多种疾病状态有关。
目前,已在人类细胞中鉴定出9个PRMTs成员。PRMT5是一种II型PRMT,专门催化精氨酸残基在H3或H4上的对称二甲基化。PRMT5调节转录抑制、RNA剪接和信号转导。PRMT5在包括淋巴瘤在内的多种癌症中上调。PRMT5已被证实在淋巴发育中发挥重要作用,控制转化B细胞的生长。关于PRMT5致癌活性的确切机制鲜有叙述。然而,最近已经发现了一些机制,包括肿瘤抑制因子p53的精氨酸甲基化,抑制p53介导的凋亡。此外,PRMT5支持组成CYCLIND1/CDK4/6的活性,导致RBL2/E2F抑癌通路失活。总的来说,这些数据表明,靶向PRMT5可能在包内的多种癌症中具有治疗价值。
套细胞淋巴瘤(MCL)中也有PRMT5过表达。PRMT5抑制剂已被证实可以抑制MCL细胞系的增殖和/或诱导细胞死亡。在大多数情况下,PRMT5抑制剂在P53野生型状态具有最佳抗淋巴瘤活性。迄今为止,至少有一种PRMT5抑制剂(GSK3326595)正在复发实体肿瘤和NHL (NCT02783300)患者中进行研究。
1. Younes A, Ansell S, Fowler N, et al. The landscape of new drugs in lymphoma. Nat Rev Clin Oncol. 2016;14(6):335‐346.
2. Heyn H, Esteller M. EZH2: an epigenetic gatekeeper promoting lymphomagenesis. Cancer Cell. 2013;23(5):563‐565.
3. Souroullas GP, Jeck WR, Parker JS, et al. An oncogenic Ezh2 mutation induces tumors through global redistribution of histone 3 lysine 27trimethylation. Nat Med. 2016;22(6):632‐640.
4. Bodor C, Grossmann V, Popov N, et al. EZH2 mutations are frequent and represent an early event in follicular lymphoma. Blood. 2013;122(18):3165‐3168.
5. Intlekofer AM, Joffe E, Batlevi CL, et al. Integrated DNA/RNA targeted genomic profiling of diffuse large B‐cell lymphoma using a clinical assay. Blood Cancer J. 2018;8(6):60.
6. Italiano A, Soria JC, Toulmonde M, et al. Tazemetostat, an EZH2 inhibitor,in relapsed or refractory B‐cell non‐Hodgkin lymphoma andadvanced solid tumours: a first‐in‐human, open‐label, phase 1 study.Lancet Oncol. 2018;19(5):649‐659.
7. Kuppers R. IRAK4 inhibition to shut down TLR signaling in autoimmunity and MyD88‐dependent lymphomas. J Exp Med. 2015;212(13):2184.
8. Ngo VN, Young RM, Schmitz R, et al. Oncogenically active MYD88 mutations in human lymphoma. Nature.2011; 470 (7332):115‐119.
9. Kelly PN, Romero DL, Yang Y, et al. Selective interleukin‐1 receptorassociated kinase 4 inhibitors for the treatment of autoimmune disorders and lymphoid malignancy. J Exp Med. 2015;212(13):2189‐2201.
10. Hailfinger S, Lenz G, Ngo V, et al. Essential role of MALT1 protease activity in activated B cell‐like diffuse large B‐cell lymphoma. Proc Natl Acad Sci U S a. 2009;106(47):19946‐19951.
11. Dufner A, Schamel WW. B cell antigen receptor‐induced activation of an IRAK4‐dependent signaling pathway revealed by a MALT1‐IRAK4 double knockout mouse model. Cell Commun Signal. 2011;9(1):6.
12. Ferch U, Kloo B, Gewies A, et al. Inhibition of MALT1 protease activityis selectively toxic for activated B cell‐like diffuse lymphoma cells. J Exp Med. 2009;206(11):2313‐2320.
13. Xin BT, Schimmack G, Du Y, et al. Development of new Malt1 inhibitors and probes. Bioorg Med Chem.2016;24 (15):3312‐3329.
14. Liu Y, Mondello P, Erazo T, et al. NOXA genetic amplification or pharmacologic induction primes lymphoma cells to BCL2 inhibitor‐induced cell death. Proc Natl Acad Sci U S a. 2018;115(47):12034‐12039.
15. Tron AE, Belmonte MA, Adam A, et al. Discovery of Mcl‐1‐specific inhibitor AZD5991 and preclinical activity in multiple myeloma and acute myeloid leukemia. Nat Commun. 2018;9(1):5341.
16. Kotschy A, Szlavik Z, Murray J, et al. The MCL1 inhibitor S63845 is tolerable and effective in diverse cancer models. Nature. 2016;538(7626):477‐482.
17. Caenepeel S, Brown SP, Belmontes B, et al. AMG 176, a selective MCL1 inhibitor, is effective in hematologic cancer models alone and in combination with established therapies. Cancer Discov. 2018;8(12):1582‐1597.
18. Li Y, Chitnis N, Nakagawa H, et al. PRMT5 is required for lymphomagenesis triggered by multiple oncogenic drivers. Cancer Discov. 2015;5(3):288‐303.
19. Berger SL. Out of the jaws of death: PRMT5 steers p53. Nat Cell Biol.2008;10(12):1389‐1390.
20. Chan‐Penebre E, Kuplast KG, Majer CR, et al. A selective inhibitor of PRMT5 with in vivo and in vitro potency in MCL models. Nat ChemBiol. 2015;11(6):432‐437.











 苏公网安备32059002004080号
苏公网安备32059002004080号


