2019年第24届欧洲血液学大会(EHA2019)将于2019年6月13日~16日在荷兰阿默斯特丹举行。来自全球100多个国家的血液领域人士汇集于此,共同分享血液学的创新理念和最新科学与临床研究结果。 本次EHA会议将报道“急性白血病”领域的诸多研究进展,【肿瘤资讯】特别筛选出该疾病领域的3篇oral摘要,让您先睹为快!

Nelarabine桥接移植治疗R/R T-ALL/T-LBL:
4期临床试验数据公布(ABS:S1620)
成人难治/复发T淋巴细胞白血病/淋巴瘤(T-ALL/T-LBL)的预后很差,仅不到10%的患者能够生存5年。该疾病目前还没有统一的治疗标准,涉及此类患者的临床试验亦数量有限。Nelarabine是近期特别批准用于难治/复发T-ALL/T-LBL的一种药物(孤儿药),但目前关于其使用信息的可用数据仍有限。
目的
该4期观察性研究旨在评估Nelarabine治疗难治/复发T-ALL/T-LBL患者的疗效和安全性,以及在奈拉滨挽救治疗后接异基因造血干细胞移植(Allo-SCT)的可行性和临床结局。
纳入标准:年龄>18岁、诊断难治/复发T-ALL/T-LBL、经至少1个完整周期的Nelarabine治疗。主要研究终点是总反应率(ORR)和总生存(OS)。其他终点包括安全性(graded according NCI CTCAE v3.0),Allo-SCT率和移植后OS。在2007年月到2018年11月间,27个意大利血液中心收治的118例难治/复发T-ALL/T-LBL患者接受了Nelarabine的挽救治疗。中位年龄为38岁(18~81岁);73%男性;77例诊断为T-ALL、41例诊断为T-LBL;65/118 (55%)接受过2种以上化疗方案;18/118 (15%)例患者在Allo-SCT后复发。
Nelarabine治疗中位周期是2周(1~4周)。所有入组的患者经评估治疗反应,有43/118 (36%)例患者获得了完全缓解(CR),16例部分缓解(14%),59例(50%)被评估为难治。ORR为50%。共47例患者(40%)在挽救治疗后接受了Allo-SCT。1年OS为37%(5年OS为18%),中位生存期为8个月。较之于未移植患者,Nelarabine挽救化疗后接受造血干细胞移植的患者1年OS显著更佳(58% vs 22 %, log-rank P = 0,0001,图1)。多因素分析结果示OS独立良好预测因素如下:年龄<55岁和Nelarabine治疗后接受造血干细胞移植。移植后2年和5年OS预测分别为46%和38%。75例患者(64%)出现了1种或以上药物相关不良反应(AE)。III-IV级神经毒性可在9/118例(8%)患者中观察到,轻微的神经系统AE(I-II级)在7/118例(6%)的患者中报道。血小板减少和/或中性粒细胞减少(III-IV级)分别在41%和43%的患者中观察到。有3例AE相关死亡(2例脓毒症休克和1例曲霉病)。4/118例(3%)的患者出现肝毒性(II级)。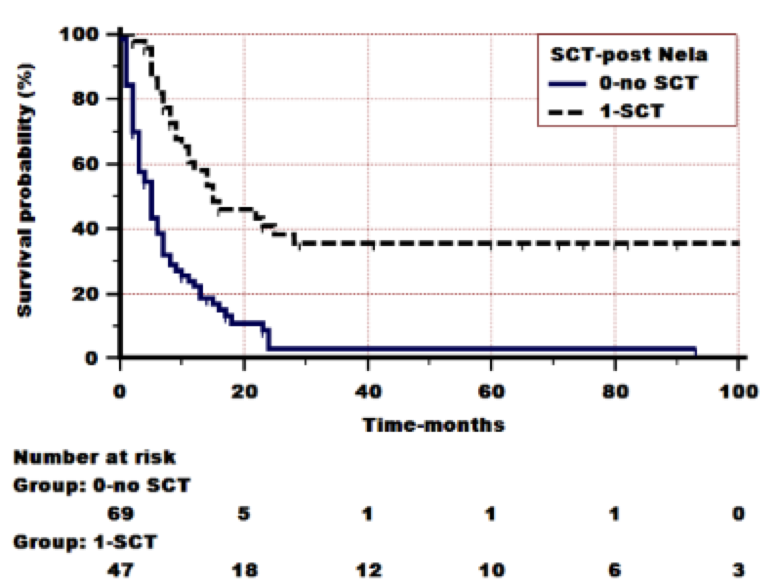
本研究是迄今为止报道Nelarabine治疗成人难治复发T-ALL/T-LBL最大的队列和真实世界研究。考虑到该疾病的不良预后,奈拉滨带来了50%的ORR和36%的CR,可作为一种高效的治疗选择。除此之外,40%的患者在Nelarabine挽救治疗后接受Allo-SCT获得了46%和38%的2年、5年OS。就安全性而言,总的来说Nelarabine治疗仅导致了8% III-IV级的神经系统AE,是可以接受的。
BLAST研究:Blinatumomab治疗MRD BCP-ALL生存数据公布(ABS:S1619)
背景
微小残留病(MRD)是预测急性前体B细胞淋巴细胞白血病(BCP-ALL)复发的强大指标。Blinatumomab是介导T细胞杀伤CD19阳性靶细胞的双特异性免疫衔接器。在一项研究成人BCP-ALL和MRD的单臂研究中(BLAST; NCT01207388),我们先前报道过78%(88/113)的患者在使用1个疗程的Blinatumomab后获得完整MRD反应(complete MRD response)。患者发生的3-4级不良反应包括神经学事件(13%)或细胞因子释放综合征(2%),和既往研究Blinatumomab的报道一致。
目的
本研究报道了BLAST研究中成人MRD RBCP-ALL的OS最终分析数据,并随访了患者使用Blinatumomab治疗后5年的情况。
方法
BLAST研究招募了者获得初次血液学完全缓解(CR1)或在接受3个周期以上强化疗封闭后获得完全缓解(CR2+)的BCP-ALL成人患者,且末次化疗后MRD(≥10–3)至少2周。所有患者予Blinatumomab 15µg/m2/日治疗4个疗程。每个疗程为持续输注4周、停2周。完全的MRD反应定义为无目标方法,最低敏感性为10-4。在MRD反应评估后(1疗程末),患者可以在任何时段接受异基因造血干细胞移植(HSCT)。Kaplan-Meier生存曲线预估了长期随访(5年)的OS。45天(1疗程末)作为一个条件性标志被用于完全MRD反应的亚组分析。
结果
共116例MRD患者接受了博纳吐治疗。OS在110例诊断Ph阴性BCP-ALL且初诊原始细胞数<5%的患者中进行了评估,其中有74例患者在Blinatumomab治疗获得持续CR(CCR)后接受了HSCT。中位随访时间为59.8月,中位OS为36.5月(95% CI: 22.0-not estimable [NE])。
5年中,获得CCR的患者进行和未进行HSCT的结局如下:生存无复发40.5% vs 19.4%; 复发23.0% vs 72.2%;死亡无复发 36.5% vs 8.3%。在第一疗程中通过完全MRD反应评估OS的患者(n=107)排除了未进行中心MRD方法检测(n=1)和MRD检测敏感性不充分(n=2)的患者。完全MRD反应者(n=84)未达到中位OS(95% CI: 29.5个月-NE),而MRD未反应者(n=23; log-rank p=0.002; 图1)的中位OS为14.4月(95% CI: 3.8-32.3)。总人群和完全MRD反应者的预测的5年总体生存率分别为43%(95% CI: 34%>52%)和50%(95% CI: 39%>60%)。获得CCR后接受HSCT的患者中,完全MRD反应者(n=61)未达中位OS(95% CI: 25.7个月-NE),MRD未反应者((n=10; log-rank p=0.065)的中位OS为16.5月(95% CI: 1.1-NE)。获得CR1的MRD患者中,完全MRD反应者(n=60)未达中位OS(95% CI: 29.5个月-NE),MRD未反应者(n=13;p=0.008)的中位OS为10.6月(95% CI: 2.7-39.7)。
结论
多国家研究BCP-ALL成人MRD血液学CR患者的5年随访分析结果示Blinatumomab治疗的中位OS为36.5个月。Blinatumomab治疗1个疗程后未获得完全MRD反应的患者未达中位OS。以上结果为Blinatumomab治疗成人BCP-ALL MRD患者带来长期生存优势进一步提供了依据。
Tisagenlecleucel治疗高危遗传学异常儿童和年轻成人r/r ALL安全有效(ABS:S1618)
背景
在B细胞急性淋巴细胞白血病(B-ALL)患者中,诊断时的细胞遗传学和分子学指标为独立预后和风险分层因素。特定改变预示高危(HR)细胞遗传学异常并与更差的预后和临床结局相关,尤其在难治/复发(r/r)的患者中亦是如此。Tisagenlecleucel是一种CD19嵌合抗原受体(CAR)T细胞疗法,被多个国家地区批准用于儿童或年轻成人r/r ALL的治疗。Tisagenlecleucel在ELIANA和ENSIGH临床试验中显示了高反应率和可控的安全性。
目的
本研究分析了ELIANA和ENSIGH研究中亚组患者的结局,这些患者在招募时的HR细胞遗传学异常已报道如下:低二倍体;;t(9;22)(q34;q11.2)/BCR-ABL1; KMT2A (MLL)重排;21号染色体扩增 (iAMP21); t(17;19)(q23;p13), 编码TCF3-HLF fusion; BCR-ABL1-like; CRLF2 重排和/或TP53 突变/缺失。
ELIANA和ENSIGH为研究Tisagenlecleucel治疗r/r ALL患者的单臂、多中心、2期临床试验。主要终点为3月内经独立评审委员会(IRC)评估的总缓解率(ORR:完全缓解[CR]+CR伴不完全血液学缓解[CRi])。
共29/137例输注患者(ELIANA 13/79, ENSIGN 16/58)有HR细胞遗传学异常(表)。中位年龄为12岁(3~31);既往中位治疗方法为3种(1~8);15/29例患者接受了至少1次先行造血干细胞移植。在所有输注的患者中(全组分析),19/29例(65.5%)有HR细胞遗传学异常(81/108例[75.0%]患者无上述HR细胞遗传学异常)的胡拿着获得了明确缓解,这些反应的患者中18/19例患者通过流式细胞术检测出MRD阴性。在剩余10例患者中,有4例在数据截止日期时未能够参与第28天的评估,3例在第28天评估前死亡(分别有1例白血病进展、脑出血和脑梗塞),2例失访,1例对治疗无反应。在19例反应的患者中,4例复发且未达中位反应持续时间,自缓解后12和24月的估测无复发可能性为74.6%(在无HR细胞遗传学异常的患者中分别为 61.7%和58.5%)。HR细胞遗传学异常患者未达中位总生存,12月和24月的估测生存分别为74.9% 和66.6% (在无HR细胞遗传学异常的患者中分别为70.7%和58.8%)。HR细胞遗传学异常患者输注内8周发生的不良事件有:细胞因子释放综合征(3级17.2%; 4级27.6%),感染(3级13.8%; 4级3.4%), 第28天未缓解的全血细胞减少 (3级17.2%; 4级 13.8%), 以及神经系统事件(3级3.4%; 无4级事件)。
Tisagenlecleucel治疗既往预后不良的HR细胞遗传学异常患者似乎有效:反应率高、生存改善并且安全可控。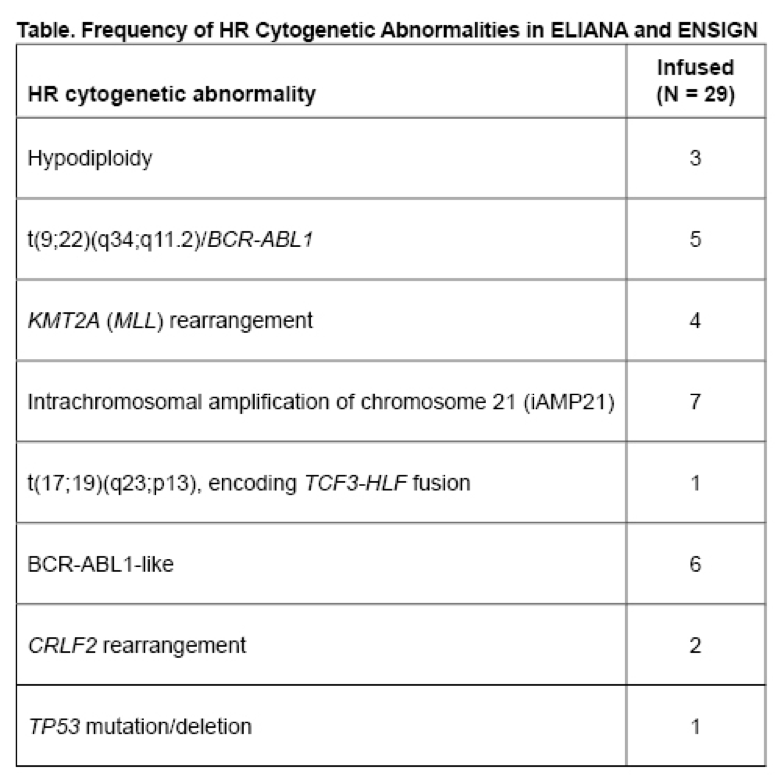
https://learningcenter.ehaweb.org/eha/2019/24th/267372/stephan.a.grupp.tisagenlecleucel.appears.effective.and.safe.in.pediatric.and.html?f=menu%3D6%2Abrowseby%3D8%2Asortby%3D2%2Amedia%3D3%2Ace_id%3D1550%2Aot_id%3D20966%2Amarker%3D530%2Afeatured%3D16435












 苏公网安备32059002004080号
苏公网安备32059002004080号


