
第52例
不同分子亚型的乳腺癌生存期有所不同。对于HER2阳性晚期乳腺癌患者,抗HER2治疗改变了HER2阳性乳腺癌的自然病程,并显著延长了生存时间。本文回顾一例未进行新辅助治疗,多次复发转移后通过曲妥珠单抗靶向抗HER2治疗长期获益的病例,分享临床经验。

中央保健会诊专家,北京医院肿瘤科副主任
北京肿瘤防治研究会乳腺癌分委会副主任委员
北京中西医慢病防治促进会中西医乳腺癌防治全国专家委员会副主任委员
北京乳腺病防治学会乳腺健康管理专委会副主任,内科/转化医学专委会常委
中国性学会乳腺疾病分会副主任委员
北京医学会乳腺疾病分会常委
北京肿瘤学会理事
中国老年学和老年医学学会老年肿瘤分会理事,基础与转化/肿瘤康复分会委员
中国抗癌协会肿瘤营养与支持治疗专业委员会精准肿瘤营养学组委员
中国心理卫生协会老年心理卫生专业委员会委员
国家卫生计生委人才交流服务中心卫生人才评价领域专家

北京医院肿瘤内科
基本情况
患者女性,2011年6月因“发现右乳肿物”确诊为乳腺癌,2011年8月行右乳癌改良根治术,术后病理:右乳腺)浸润性导管癌,中分化,大小3cm×2.5cm×1cm,(右乳浸润性导管癌肿物切除术后)输乳管内可见少量癌组织,切缘及乳头未见癌累及,腋窝淋巴结可见转移癌(12/23)(淋巴结0.2cm~1.2cm),(后组)淋巴结未见转移癌(0/1)。免疫组化:PR(-),ER(-), HER2(3+)。既往体健,婚育史未见异常,绝经46岁,家族史:父亲患肺癌,母亲患肝癌,否认家族肿瘤及遗传性疾病史。个人史无特殊。
术后诊断
右乳浸润性导管癌pT2pN3M0,ⅢC期,HR阴性HER2阳性型。
辅助治疗
2011年9月至2012年4月予以AT方案8周期辅助化疗,2012年4月予以放疗(具体不详)。
第一次复发转移
2012年12月,腹部超声提示肝内多发实性占位,考虑转移。
无病生存期(Disease-free survival,DFS)约16个月。
2013年1月至2014年10月,予多西他赛140mg×d1+卡培他滨1.5g Bid×d1-d14,至少20程,同时予以曲妥珠单抗300mg×q3w,15次(1年)。
疗效评价部分缓解(partial response,PR)。
第二次复发转移
2014年12月,腹部超声示肝右后叶及左外叶各见一实性结节,大小分别为1.3cm×1.0cm、1.4cm×0.7cm。
肿瘤无进展生存时间(progression-free survival, PFS)1为24个月。
2014年12月10日行肝射频消融治疗。
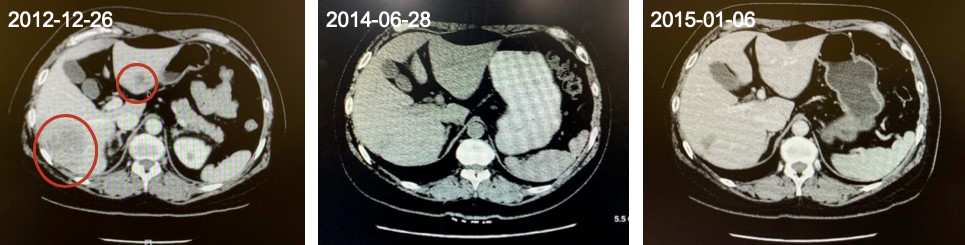
肝脏病灶变化
第三次复发转移
2016年6月,体检触及左锁骨上结节,超声:左颈部及锁骨上窝多发肿大淋巴结(大者1.2cm×1.1cm)。活检病理:可见腺癌组织。
PFS2为18个月。
2016年7月—12月,予以多西他赛+卡培他滨共计5周期。2016年11月22日,复査超声提示左锁骨上窝淋巴结较前缩小(0.8cm×0.7cm×0.9cm)。
评价病情稳定(stable disease,SD)。
2016-12至2017-03卡培他滨500mg,Tid节拍化疗。

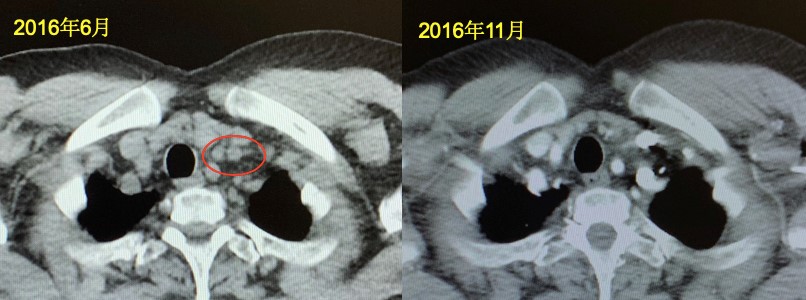
第四次复发转移
2017年3月21日,复查颈部CT:左侧颈动脉鞘周围及左侧锁骨上窝可见数个淋巴结(较大者短径0.8cm),较前增大。胸部CT:双肺、纵隔内多发小结节(较大者位于左肺上叶尖后段斜裂胸膜下,直径0.8cm),新出现。疗效评价疾病进展(progressive disease,PD),PFS3为9个月。
治疗方案:2017年4月—9月,曲妥珠单抗+多西他赛方案8周期,后续曲妥珠单抗维持治疗至今。
至今总生存时间:7年10个月。
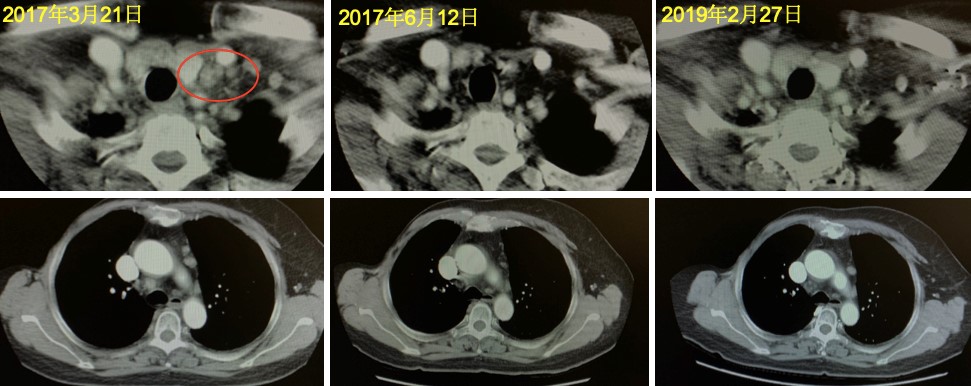
点评专家

中国抗癌协会乳腺癌专业委员会委员
CSCO乳腺癌专家委员会委员
中国医药教育协会乳腺疾病专业委员会常委
中国研究型医院学会乳腺专业委员会常务委员
中国研究型医院学会精准医学与肿瘤MDT专业委员会乳腺学组副组长
湖南省医学会肿瘤内科学专业委员会主任委员
湖南省医学会肿瘤内科学专业委员会乳腺癌学组组长
湖南省妇幼保健与优生优育协会妇科与乳腺肿瘤防治专业委员会主任委员
湖南省抗癌协会肿瘤化疗专业委员会副主任委员

湖南省肿瘤医院乳腺内科
湖南省抗癌协会乳腺癌专业委员会青年委员
湖南省健康服务业协会肿瘤防治分会秘书
湖南省医学会乳腺癌规范化诊治专家巡讲团成员
《肿瘤药学》杂志中青年编委
参编国家级乳腺癌著作多本
在国内外核心期刊发表论文多篇
主持省部级课题数项
Siena University Hospital 交流学习
点评
该病例为初诊局部晚期pT2pN3M0,ⅢC期,分子分型为HR阴性HER2阳性型的乳腺癌患者。该患者在辅助治疗阶段未使用抗HER2治疗,后续多次复发,也未规范化足疗程地进行抗HER2治疗。纵观患者的整个病史,患者应属于HER2阳性患者中对抗HER2治疗较为敏感的类型,如能及早并规范地接受抗HER2治疗,有可能取得比现实情况更好的预后。现就该患者诊疗过程中可学习总结的经验作一简要分析。
1. HER2阳性的局部晚期乳腺癌患者应当使用包含抗HER2靶向药物在内的(新)辅助治疗方案来改善预后
根据术后病理,患者分子分型为HR阴性HER2过表达型。不论是欧美国家还是我国国内的乳腺癌指南与共识,都把抗HER2靶向治疗作为HER2过表达型乳腺癌患者治疗过程中不可或缺的一个重要环节。
《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》2019版指出,满足以下条件之一者可选择术前新辅助药物治疗:①肿块较大(>5cm);②腋窝淋巴结转移;③HER2 阳性 ;④三阴性;⑤有保乳意愿,但肿瘤大小与乳房体积比例大难以保乳者。本病例患者乳腺肿物>5cm、HER2阳性且有淋巴结转移,适宜进行包含抗HER2靶向药物在内的新辅助治疗。临床研究证明,HER2阳性患者新辅助治疗,曲妥珠单抗联合化疗与单用化疗相比能够显著提高完全缓解(pCR)率,奠定了曲妥珠单抗在HER2阳性乳腺癌新辅助治疗中的标准地位[1]。而曲妥珠单抗联用帕妥珠单抗的双靶向HER2治疗也是可选的治疗策略。NeoSphere 研究证实了曲妥珠单抗和帕妥珠单抗与多西他赛联合进一步提高了pCR率[2]。目前帕妥珠单抗已经在中国上市,中国HER2阳性乳腺癌患者也可以选择“妥妥双靶”方案,更多获益。未来待帕妥珠单抗纳入医保范围,将有更多患者切实获益。
该患者术后分期提示局部晚期ⅢC期,HER2阳性型,在当时未行新辅助治疗即行手术的情况下,术后辅助治疗应当采用曲妥珠单抗靶向抗HER2联合化疗的治疗方案。证据来源于HERA研究、NSABP B31/N9831研究、BCIRG 006研究等大型随机对照临床研究的结果。一年的曲妥珠单抗的靶向治疗业已成为HER2阳性乳腺癌术后辅助治疗的标准治疗方案。当然,由于经济或者其他各种原因,不是所有的患者在真实世界中都能接受到标准的治疗。HER2阳性意味着恶性肿瘤较强的侵袭性,易出现复发转移。该患者在辅助化疗后接受了放疗,但一直没有使用曲妥珠单抗进行抗HER2辅助靶向治疗,这肯定是导致患者在较短的DFS时间后即出现复发转移的重要原因。
2.晚期HER2阳性乳腺癌,持续抗HER2才是成功的关键
患者在出现肝脏转移后,晚期一线治疗方案选用TXH方案,这是值得肯定的,患者也取得了较长的PFS时间(约24个月)。但晚期抗HER2治疗在疗效评价未达到CR的情况下,治疗时长不应以1年为限,而应使用到病情出现进展或患者不能耐受。简言之,就是应当持续地抗HER2!
《CSCO乳腺癌诊疗指南》2019版指出:对于复发转移乳腺癌患者在曲妥珠单抗治疗进展后,需要根据患者既往治疗情况决定后续治疗。如果既往治疗有效,因为毒性或经济原因停药,则优先考虑继续使用曲妥珠单抗,换用其他化疗药;如果在曲妥珠单抗治疗中出现进展,则优先考虑更换抗HER2药物。本病例中,患者一线治疗使用曲妥珠单抗1年,已从治疗中获益,停药后再次复发,原则上可继续使用曲妥珠单抗至疾病进展。HERMINE研究[3]观察了在常规实践中使用曲妥珠单抗治疗转移性乳腺癌的情况,包括接受过进展治疗(TBP)的患者。本研究观察623例患者>2年。TBP 亚分析比较177例患者的总生存期(OS),他们接受一线曲妥珠单抗治疗,或在进展后30天内继续使用曲妥珠单抗,或在进展前停止。结果显示中位治疗时间为13.3个月。第一、第二、第三线或以上治疗组的中位进展时间(TTP)分别为10.3个月、9.0个月和6.3个月。 中位OS时间分别为30.3个月、27.1个月和23.2个月。在TBP亚分析中,继续使用曲妥珠单抗 TBP的患者从治疗开始到疾病进展的中位OS时间更长。
本病例中患者在出现第二次及第三次复发转移的治疗过程中,先不论治疗方式及化疗方案的选择是否合理,患者均未接受任何形式的抗HER2治疗是最大的遗憾。患者在第四次进展继续使用曲妥珠单抗后获得约2年多的缓解时间,截止目前仍未出现疾病进展。由此可知,对于HER2过表达的晚期乳腺癌患者,持续的抗HER2治疗有可能带来明显获益。
总结
本例患者在初治过程中未接受抗HER2治疗,DFS时间较短,早期出现复发转移,但在晚期一线中及第四次复发转移后加入抗HER2靶向治疗,取得了较长的PFS及OS,效果显著,可见对于HER2阳性型患者而言,全程抗HER2治疗的理念应贯穿于治疗过程中,患者可获益更多。患者在第四次进展后,再次尝试曲妥珠单抗联合化疗并治疗有效,疾病得到控制,这也是曲妥珠单抗治疗有效进展后,继续使用曲妥珠单抗仍有可能获益的一个很好的例子。
[1] Buzdar AU, Ibrahim NK, Francis D, et al. Significantly higher pathologic complete remission rate after neoadjuvant therapy with trastuzumab, paclitaxel, and epirubicin chemotherapy: results of a randomized trial in human epidermal growth factor receptor 2-positive operable breast cancer[J]. J Clin Oncol. 2005,23(16):3676-85.
[2] Gianni L,Pienkowski T,Im Yo, et al. 5-year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced, inflammatory, or early-stage HER2-positive breast cancer (NeoSphere): a multicentre, open-label, phase 2 randomised trial[J] .Lancet Oncol, 2016, 17: 791-800.
[3] Extra J M , Antoine E C , Vincent-Salomon A , et al. Efficacy of Trastuzumab in Routine Clinical Practice and After Progression for Metastatic Breast Cancer Patients: The Observational Hermine Study[J]. The Oncologist, 2010, 15(8):799-809.











 苏公网安备32059002004080号
苏公网安备32059002004080号


