他莫昔芬是一种选择性雌激素受体(ER)调节剂,可用于HR阳性乳腺癌患者的辅助治疗,同时还可以预防高风险女性的乳腺癌发病风险。然而,他莫昔芬治疗也具有一定的毒副作用,导致其治疗依从性较低。近期发布在《临床肿瘤学期刊》(Journal of Clinical Oncology)的TAM-01临床研究,评估了低剂量他莫昔芬(5mg/d连用3年)是否可以降低乳腺上皮内瘤变患者导管原位癌(DCIS)、浸润性复发或对侧乳腺癌的发生风险。【肿瘤资讯】谨对该研究进行介绍,并邀请复旦大学附属肿瘤医院的余科达教授进行点评。

《新见》是由中华医学会肿瘤分会乳腺肿瘤青年学组主办的期刊文献解读点评栏目,全年计划推出10期内容,本次文献解读为该栏目第一期内容。
研究背景
乳腺上皮内瘤变,包括非典型导管增生(ADH)、小叶原位癌(LCIS)和导管原位癌(DCIS),这类患者发展为浸润性乳腺癌的风险比普通人群高5~10倍。在乳腺钼靶筛查中,这类患者占乳腺肿瘤的15%~ 25%。乳腺上皮内瘤变的自然病程具有广泛的异质性。部分患者可以一直表现为惰性,而部分患者可能发展为浸润性疾病,因此对这类患者的最佳治疗策略仍然存在争议。
他莫昔芬是一种选择性ER调节剂,可以称为分子靶向药物的“始祖”,可用于HR阳性乳腺癌患者的辅助治疗,同时还可预防高风险女性(基于Gail模型预测)的乳腺癌发病风险,包括ADH和LCIS患者(其后续发展为浸润性癌的风险分别为10人/1000人和13人/1000人)。然而,他莫昔芬也有一定的毒副作用,包括深静脉血栓和子宫内膜癌,这也可以部分解释为何他莫昔芬作为预防性治疗的使用率较低。此外,他莫昔芬治疗过程中可导致绝经症状,包括血管舒缩症状和性生活、妇科障碍,也会影响患者的生活质量,导致停药。此外,目前他莫昔芬作为预防策略之一,并未观察到其可以降低乳腺癌的病死率,且因为其合并一定的毒副作用,使得我们需要探索另外的策略,如剂量增加或减低。我们进行了相关研究以确定他莫昔芬的最低有效剂量。标志物研究揭示他莫昔芬5mg/d在抑制乳腺癌细胞和正常内膜组织增殖上并不劣效于20mg/d。一项前瞻性的队列研究还显示采用隔日10mg的模式,可以降低绝经后DCIS患者一半的复发风险。这一项Ⅲ期临床试验旨在评估他莫昔芬5mg/d连用3年是否可以降低乳腺上皮内瘤变患者DCIS、浸润性复发或对侧乳腺癌的发生风险,且这一治疗模式不会引发严重的毒性,影响患者生活质量。
研究方法
这是一项多中心、Ⅲ期研究,对比他莫昔芬5mg/d和安慰剂,连用3年。研究入组了年龄75岁或以下,ECOG PS 0~1分,HR阳性(ER或PR≥1%)或状态未知的乳腺上皮内瘤变患者(ADH、DCIS或LCIS)。高级别或粉刺/坏死的DCIS患者接受辅助放疗50Gy/25f。治疗的3年期间和之后随访的2年,患者每6个月随访1次,并每年复查钼靶和阴道超声。主要的排除标准为既往接受过抗肿瘤治疗,有他莫昔芬使用禁忌,合并精神障碍,怀孕,既往使用过抗雌激素药物等。所有入组患者均在手术后完成随机分组并开始治疗,在术后12~60个月入组的患者,放疗可以在开始他莫昔芬之前或同时进行。患者的服药依从性定义为每6个月随访时服用了至少85%的研究药物。主要研究终点为浸润性乳腺癌或DCIS的发生率;次要研究终点为ADH或LCIS、子宫内膜癌或其他第二原发肿瘤、深静脉血栓事件、冠心病、骨折、绝经期症状。患者随机1:1分配至两个治疗组,分层因素包括研究中心、诊断至随机的时间(12个月以内 vs 12~60个月)和组织学类型(ADH + DCIS + LCIS)。
研究结果
2008年11月1日至2015年3月31日,该研究共筛查了1160例女性患者,其中有500例年龄75岁或以下的女性。研究入组,两组患者的基线特征均衡,见表1。患者的平均年龄为54岁,55%的患者为绝经后。ADH、LCIS和DCIS的患者比例分别为20%、11%和69%。总体而言,33%的患者ER或PR状态未知,其中63%为ADH或LCIS,20%为DCIS。研究中未纳入ER阴性的DCIS患者。
表1 患者的基线特征
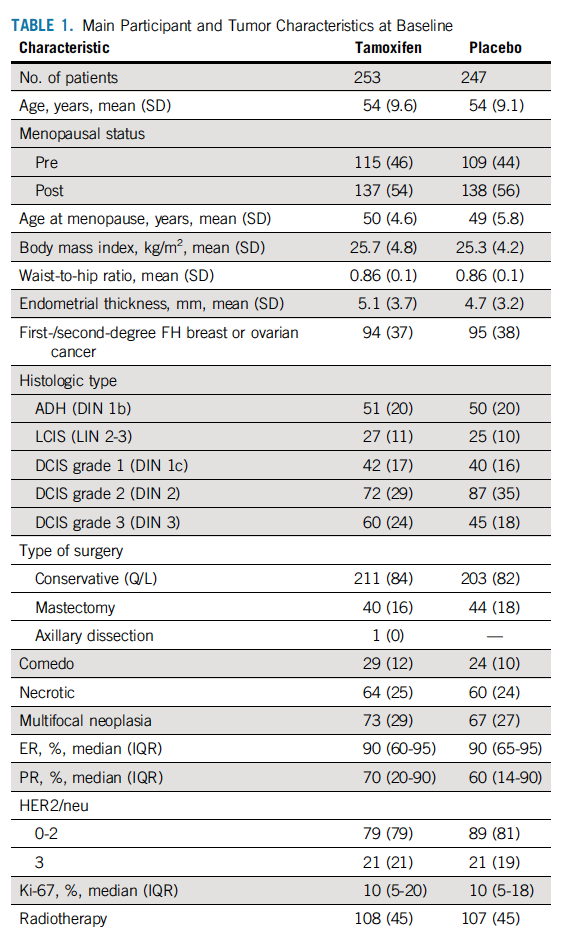
在中位随访5.1年后,他莫昔芬组和安慰剂组分别观察到14个乳腺癌事件(浸润性乳腺癌或DCIS,发生率为11.6/(1000人·年)和28个乳腺癌事件[(发生率为23.9/(1000人·年)],HR=0.48,95%CI 0.26~0.92,P=0.02。采用K-M法预估5年时乳腺事件的累积发生率,他莫昔芬组和安慰剂分别为6.4%和11.0%,导致需要治疗的人数为22例。进一步对比对侧乳腺癌发生率,他莫昔芬组和安慰剂组分别观察到3例和12例( HR=0.25,95%CI 0.07~0.88,P=0.02)。主要研究终点(浸润性乳腺癌或DCIS)和对侧乳腺事件的累积发生率总结见图1。表2总结了乳腺恶性事件的特征。大多数的复发为浸润性的,他莫昔芬组对比安慰剂组,未观察到肿瘤的生物学特征存在差异。在ADH患者中,他莫昔芬组对比安慰剂组分别有1例和2例复发(HR=0.50,95% CI 0.05~5.47);LCIS患者中,分别有1例和6例复发(HR=0.31,95% CI 0.06~1.51);DCIS患者中,分别有11例和20例复发(HR=0.53, 95% CI 0.25~1.11);既定的亚组分析中未观察到显著的异质性。
表2 乳腺恶性事件的主要特征
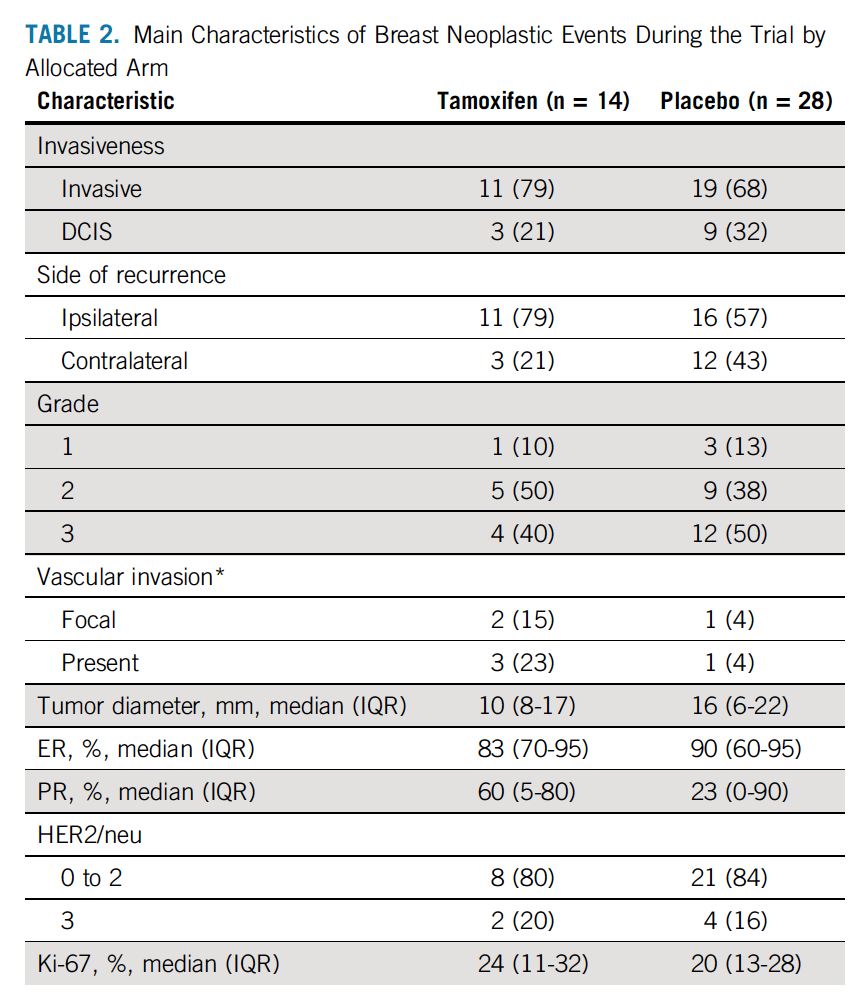
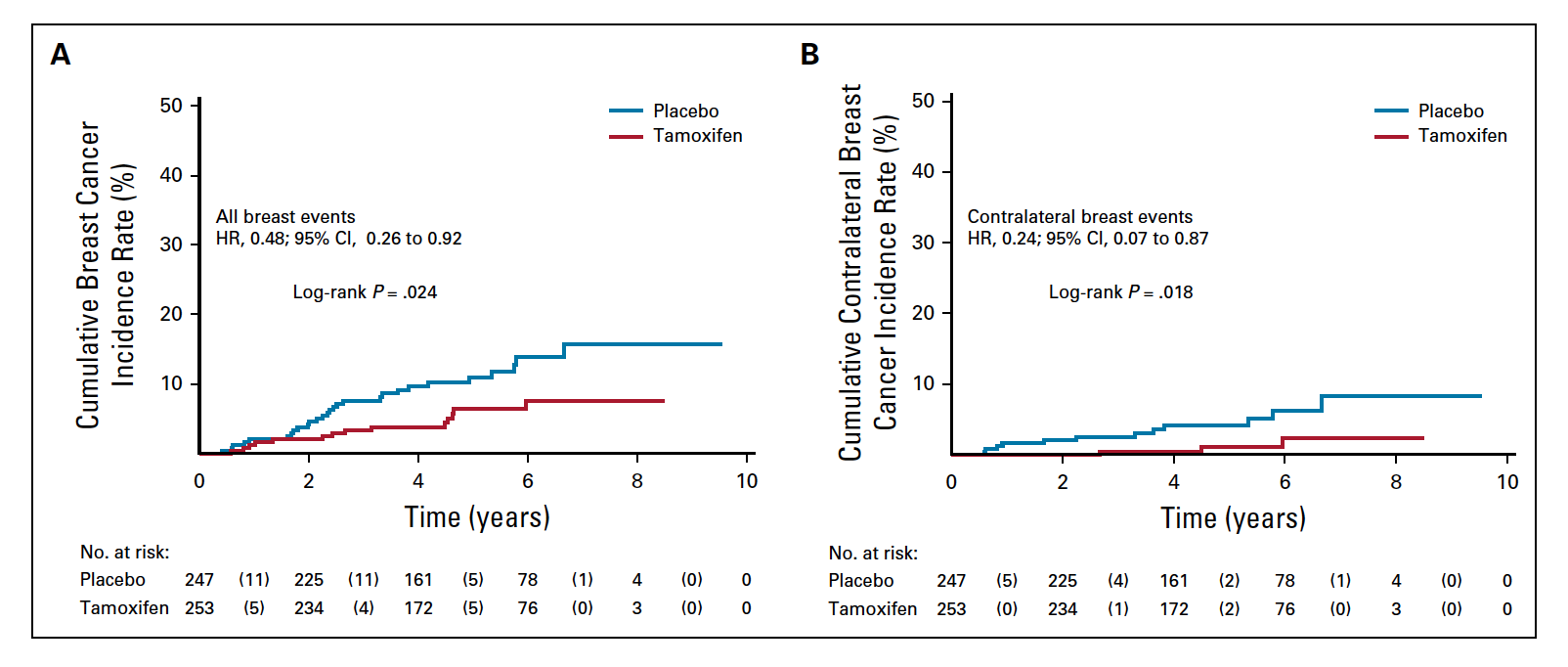
图1 累积乳腺癌事件发生率(浸润性乳腺癌或DCIS;A)及 ITT人群对侧乳腺癌事件发生率(B)
他莫昔芬组和安慰剂组分别观察到12例和16例严重不良事件,他莫昔芬组有1例深静脉血栓和1例Ⅰ期子宫内膜癌;安慰剂组有1例肺栓塞[发生率0.85/(1000人·年)]。考虑到5年累积发生率他莫昔芬组和安慰剂组分别为0.87%和0.41%,则他莫昔芬治疗后的获益远大于伤害,是其10倍以上(218 vs 22)。第二原发癌发生情况,他莫昔芬和安慰剂组分别为6例和4例。
安慰剂组有2例死亡,1例死于乳腺癌,另1例死于心机梗死;他莫昔芬组有1例死于乳腺癌。他莫昔芬组的潮热、阴道出血的发生率更高,头痛的发生率更低,但在子宫内膜息肉的发生率上,两组无显著差异,他莫昔芬和安慰剂组分别为2.8% vs 1.6%(表3)。
表3 两治疗组的严重不良事件
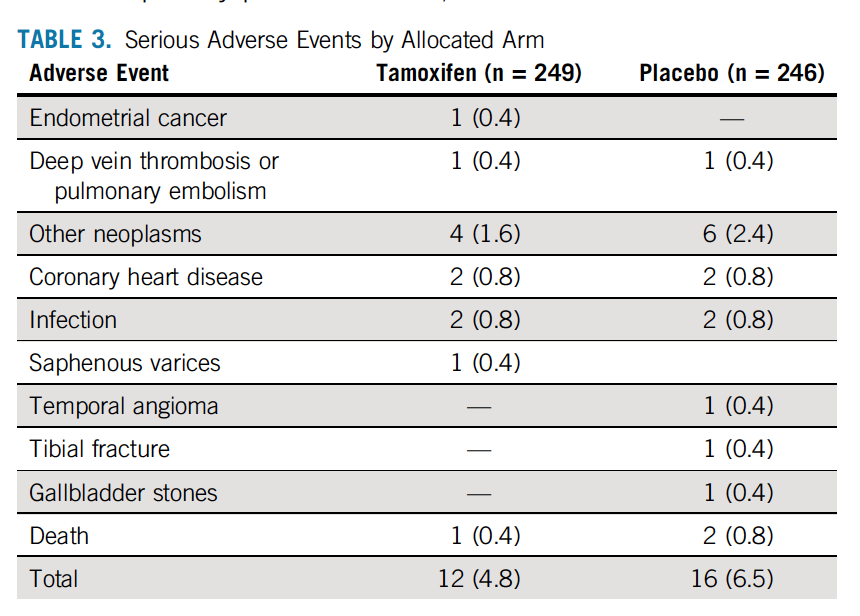
总体而言,3年治疗期间,每日患者报道的潮热频率他莫昔芬组显著高于安慰剂组(P=0.02;图2A),潮热平均发生率比,他莫昔芬组对比安慰剂组为1.46 (95%CI 1.05~2.00)。3年治疗期间,他莫昔芬组和安慰剂组平均每日潮热发生频率分别为2.1次和1.5次,然而两组的潮热评分无显著差异(P=0.16;图2B)。此外,两组患者性交时阴道干燥以及肌肉、关节疼痛发生率也无显著差异(图2C、2D)。
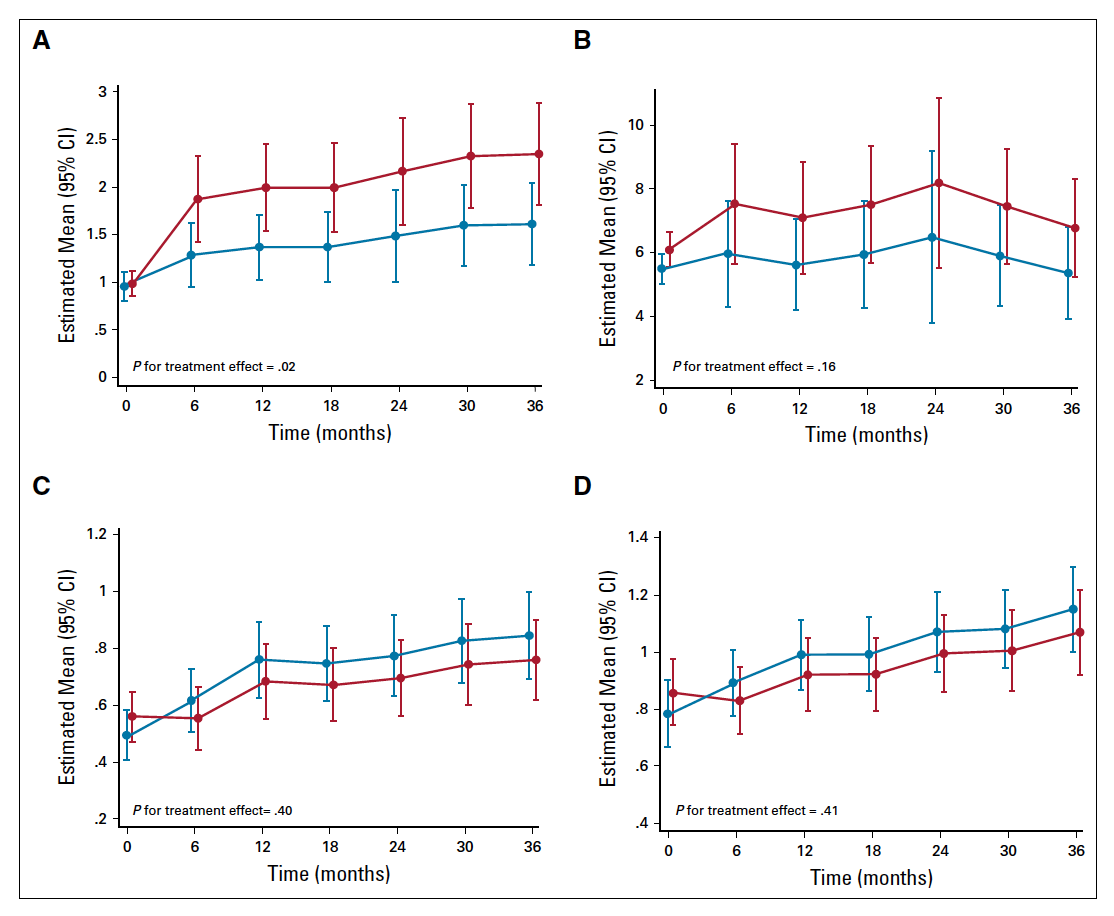
图2 双盲治疗期预测每日潮热发生频率(A)、潮热评分(发生率×强度;B)、性交时阴道干涩或疼痛(C)、肌肉或关节痛(D)
结论
这一前瞻性研究证实,在HR阳性或未知的上皮内瘤变患者中,低剂量他莫昔芬(5mg/d)和较短疗程治疗可以降低一半的新发乳腺癌发生风险。药物相关毒性,包括深静脉血栓、子宫内膜癌和绝经后症状,他莫昔芬组与安慰剂组仅有边缘统计学差异。因此,对于这类患者,低剂量他莫昔芬是一个新的治疗选择。
余科达教授点评

复旦大学附属肿瘤医院乳腺外科 行政副主任
复旦大学附属肿瘤医院乳腺外科 主任医师
国家优秀青年基金获得者
中华医学会肿瘤分会乳腺青年学组 主任委员
中国抗癌协会乳腺癌专委会 委员
中国抗癌协会肿瘤靶向治疗专委会 委员
中国抗癌协会青年理事会 理事
上海市抗癌协会青年理事会 副理事长
上海市抗癌协会乳腺癌专委会 常务委员/秘书长
上海市抗癌协会乳腺癌青委会 副主任委员
上海医学会肿瘤靶分子分会 秘书/委员
该项Ⅲ期TAM-01临床研究最早发布于2018年12月的SABCS大会,该研究发现,对乳腺导管原位癌(DCIS)、小叶原位癌(LCIS)和不典型增生(ADH)患者,每日低剂量5 mg他莫昔芬(TAM)3年治疗相对于安慰剂而言,能显著降低一半的疾病复发或新发乳腺癌风险。
本研究有其重要价值:
TAM每日5mg使用3年,是一种有效降低乳腺癌复发并预防新发的方式,可能改变此前TAM 20mg×5年的旧模式。
该新模式在获益度上并不逊色,相对安慰剂降低50%风险, 与高剂量5年TAM 20mg的疗效(也是降低50%左右)相媲美。
毒副反应上,除了潮热方面TAM 5mg较安慰剂组略明显外,其他如肌肉关节疼痛等发生率与安慰剂组相似。TAM 5mg的不良反应比TAM 20mg明显降低。
本研究也有所不足:
实际入组人数与预设样本量相差较大,原计划入组1400例,实际评估1160例,入组仅500例。但由于发生终点事件较多,研究提前中止并公布了结果。
本研究选择了安慰剂而非TAM 20mg作为对照。由于前期NSABP P-01等研究已证实TAM 20mg是DCIS、LCIS等高危人群的合理预防模式,本研究却选择安慰剂对照,有治疗不足之嫌,也未能头对头比较TAM 5mg与20mg间的差别。
通过本研究,我认为以下几个问题值得拓展性探讨:
第一,化学预防的应用人群问题。
虽然NASBP P-01等早已证实TAM 20mg×5年能较安慰剂显著降低乳腺癌发生,但依然少有医生推行化学预防。之所以如此,可能是两个重要问题。首先,NASBP P-01、P-02、MAP3等临床试验中的所谓高危人群,常采用Gail Model预测未来5年乳腺癌风险,若大于1.66%即为高危人群。这一标准有点宽泛,很多女性按Gail Model计算风险都接近1.66%,若都给予TAM 20mg×5年,则有点过度。不仅如此,中国人以及非欧美裔对Gail Model的适用性也不明确,故化学预防常会陷入“对象模糊且不确定”的困境。而本次TAM-01研究的对象不仅高危,而且清晰,直接就以乳腺上皮内瘤变(包括非典型导管增生、小叶原位癌和导管原位癌)为对象,这类患者发展为浸润性乳腺癌的风险比普通人群高5~10倍,故TAM-01结论更容易被接受和推广。其次,P-01证实,TAM 20mg×5年只能预防ER阳性乳腺癌,却不能预防ER阴性乳腺癌,这给化学预防的推广增加了不确定性。医生如何判断一个高危女性以后发生ER阳性还是阴性乳腺癌?若该女性罹患ER阴性乳腺癌,那岂不是5年TAM白吃了?而TAM-01研究也似乎很好地解决了这一问题,因为非典型导管增生、小叶原位癌和导管原位癌等病变高达80%~90%或以上都是ER阳性的,意味着后续浸润性病灶也极有可能ER阳性,由此进行药物防治,属于有的放矢、目标明确。
第二,预防性用药时长的问题。
按以前的标准是5年,TAM-01研究出来后,可以缩短到3年。但我想更深层次应该思考是5年更合理,还是3年更合理,还是说最合理的答案未知。预防性5年TAM,主要借鉴激素受体阳性乳腺癌的5年TAM治疗经验而来,这对预防复发转移事件,是合理的,因为3~5年是乳腺癌复发高峰,我们通过5年用药把风险降低。但是对于预防同侧乳房原发或者对侧乳腺癌,5年并非是一个合理的时间,因为第二原发不存在复发高峰,而是以每年较为恒定的风险逐渐上升,时间越久,累积发生率越高。所以不管是5年,还是3年,可能都不是最佳时间。以MA.17R为例,哪怕延长用药到15年,降低对侧乳腺癌也是有显著获益的。因此,合理的时长与预防用药的模式仍待我们继续探索。一个大胆的假设是,对每年并不高的累积性风险,可以采用间歇疗法。内分泌延长用药研究SOLE试验,似乎就验证了这个模式。SOLE试验中,5年用药后,要么继续全程延长5年,要么间歇性延长5年(每年吃药9个月,休息3个月),结果两者的疗效使一样的。因此,是预防性用药时长的问题上,3年、5mg只是一个新选择,而并非代表了最佳时间和最优剂量。
第三,选择TAM还是AI的问题。
虽然TAM-01研究的用药是TAM,但研究入组了大量年老患者,绝经后患者占到54%~56%,最年长者可达75岁。对老年患者,应用他莫昔芬带来更高的子宫内膜癌风险,而AI似乎是更佳选择。NSABP B-35研究在接受过保乳的绝经后DCIS患者中,比较阿那曲唑和TAM在乳腺癌复发方面的预防作用,结果显示阿那曲唑组和TAM患者10年生存率分别为93.5%和89.2%,阿那曲唑组的乳腺癌复发风险比TAM组降低27%,这种作用在<60岁的患者中更加显著。同理,是否AI相对TAM在乳腺上皮内瘤变中有更好的预防作用,值得进一步验证。低剂量AI的预防价值目前还一片空白。倘若能够验证低剂量AI在不良反应显著降低前提下,又具有一定的疗效,甚至还优于低剂量TAM,那将会成为更好的化学预防选择。
综上,TAM-01研究开启了很多思路和想法。在乳腺上皮内瘤变预防领域,目前还没有非常明确的最优方式,值得我们更多探索,探索最佳预防对象、最合理药物剂量,以及最准确预防时长。
DeCensi A,Puntoni M,Guerrieri-Gonzaga A, et al. Randomized placebo controlled trial of low-dose tamoxifen to prevent local and contralateral recurrence in breast intraepithelial neoplasia.[J] .J. Clin. Oncol., 2019.











 苏公网安备32059002004080号
苏公网安备32059002004080号


