中国抗癌协会肿瘤营养专业委员会主办的第七届全国肿瘤营养学大会于2019年4月15日-21日在北京隆重召开,北部战区总医院肿瘤科郑振东主任带领团队获评“全国规范化肿瘤营养治疗示范病房”,团队骨干杜成博士获得大会优秀壁报一等奖,并受邀在青委会专场作体重与肿瘤防治的专题报告。现将杜成博士的报告和郑振东主任的精彩点评全文发布,以期从体重管理角度加强广大医师对肿瘤营养的认识,真正树营养为一级预防,“还营养为一线治疗”。

医学博士,博士后
北部战区总医院肿瘤科秘书
中国抗癌协会肿瘤营养专业委员会青年委员
中国抗癌协会中西医整合肿瘤专业委员会青年委员
中国医药生物技术协会临床应用专业委员会青年委员
辽宁省营养学会肿瘤营养治疗专业委员会秘书
《肿瘤学杂志》青年编委
2019获中国抗癌协会肿瘤营养学大会优秀壁报一等奖
2018获中国抗癌协会肿瘤营养大会青年辩论赛二等奖
2017获中国抗癌协会肿瘤标志物大会优秀论文一等奖
2017获 CSCO 抗肿瘤血管靶向治疗病历大赛一等奖
获国家自然科学基金1项,中国博士后基金面上和特别资助各1项,辽宁省基金3项,参编专著5部,专利1项
一、体重与肿瘤发生风险
2018年底,国际顶级期刊《CA:A Cancer Journal for Clinicians》发布了一项重要综述:全球体重超重带来的癌症负担[1]。文中指出,1975年至2015年40年间全球成人超重人群增加1倍,已经占总人群40%左右,男性肥胖人群占比由4%增至12%,女性肥胖人群占比由7%增至18%(图1)。儿童超重和肥胖发展形势更为严峻,中国男性儿童超重和肥胖人群占比达到15%-20%,仅次于美国和俄罗斯。

图1.全球不同性别成人和儿童超重流行趋势(1975-2015)
据统计,2012年全球由肥胖引发的癌症占总癌症患者数的3.9%(544300例),在西方发达国家这一比例达到7%-8%。按照瘤种统计,超重或肥胖最常引发的前10种癌症:男性分别是食管腺癌(29%)、肾癌(18%)、肝癌(10%)、胆囊癌(10%)、胃贲门癌(9%) 、多发性骨髓瘤(7%)、胰腺癌(6%)、结直肠癌(6%)、甲状腺癌(6%)。女性则是子宫内膜癌位居第一(31%),乳腺癌和卵巢癌也居前列[1]。
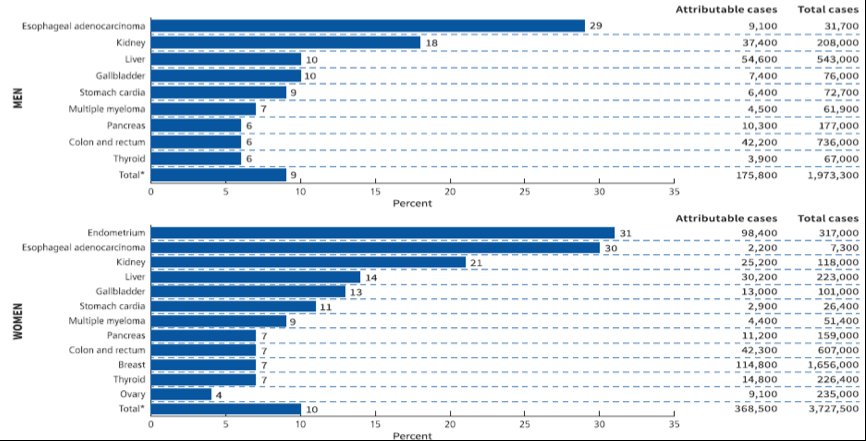
图2.超重和肥胖导致不同性别人群癌症发生的比率和例数(2012)
其实早在2014年英国公布的一项纳入524万人群的大规模队列研究结果显示,17种肿瘤的发生可归因于肥胖,其中关系最为密切的依然是子宫内膜癌(占比达41%),肥胖引发的胆囊癌、肾癌、肝癌、结肠癌占比都在10%以上,由于结肠癌和绝经后乳腺癌是常见癌种,人群基数较大,因肥胖引发的绝对例数最多[2]。
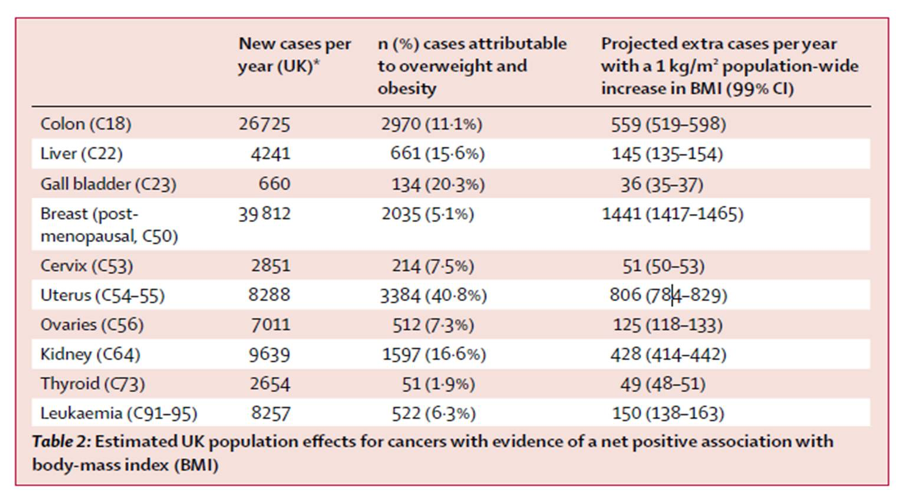
图3.英国每年因超重和肥胖引发的不同癌症占比和例数
来自美国的另一项研究探讨肥胖对年轻女性早发结直肠癌(CRC)的影响。所谓早发就是50岁以下患CRC。纳入的是全美8万多名25-42岁的女护士,共有114例早发CRC。相关分析显示,随着体重指数(BMI)逐渐增加,女性早发CRC风险明显增加。有意思的是,这些人在18岁时的BMI高低与早发CRC风险没有显著相关性。但后期体重与18岁时对比如果逐渐增加,那么早发CRC的风险会显著升高[3]。提示我们女性朋友18岁时胖瘦都不重要,重要的是现在还是否敢于面对18岁时的体重。

图4. 肥胖女性早发CRC(<50岁)发生风险增加
事实上,不光体重高低会影响肿瘤发生风险,即便是体重指数正常,身体脂肪含量高同样会增加患癌风险。来自美国的一项关于绝经后乳腺癌的多中心研究就证实了这一点。该研究最初纳入人群达16万之多,从中选择有双能X线体脂检测记录结果的患者,排除超重(BMI > 25)或低体重(BMI<18.5)的人群,最终有3460例纳入二次分析。1993-2016年纳入,中位随访16年,共182例患乳腺癌,146例为ER阳性乳腺癌,高体脂含量增加总乳腺癌风险(HR:总脂肪1.89,躯干脂肪1.88),多因素分析显示躯干脂肪含量高会增加ER阳性乳腺癌风险,四肢脂肪则与之无关[4]。这项研究告诉我们,对于那些体重正常的绝经后女性需要关注躯干脂肪含量,如果过高则应通过饮食和运动减脂,以降低乳腺癌发生风险。

图5.正常BMI绝经后女性高体脂肪含量增加乳腺癌发生风险
二、体重对肿瘤患者疗效和生存预后的影响
由以上几篇重要文献我们大致了解到,肥胖或超重是非常重要的致癌因素。对于已经患癌的患者,体重高低对治疗和预后有哪些影响呢?
我们首先看美国PLCO癌症筛查试验中前列腺癌的数据。该研究纳入了69873位男性,中位随访13年,共7822人患前列腺癌,其中255例因前列腺癌死亡。BMI与前列腺癌发生正相关(BMI增加5个单位,HR=1.27-1.32)。20岁时BMI正常或超重男性体重增至肥胖(BMI>30)后因前列腺癌死亡风险增加(HR分别为1.95和2.65)[5]。该研究表明肥胖对前列腺癌是预后不良因素。在其他瘤种,情况则有所不同。

图6. PLCO癌症筛查试验中BMI变化曲线对前列腺癌发生和死亡风险的预测
2016年,美国 Kaiser Permanente医疗集团汇总了25个转移性结直肠癌(mCRC)一线研究的数据,患者于1997-2012期间完成招募,共21149例mCRC。结果显示,BMI小于18.5的患者肿瘤进展风险较肥胖患者增加27%,死亡风险增加50%,特别是男性患者低BMI较肥胖者预后更差。该研究提示,晚期肠癌,特别是男性患者要避免出现低体重[6]。

图7.BMI是转移性结直肠癌的预测因子:来自ARCAD数据库中一线临床试验的荟萃分析
在早期结直肠癌患者,情况会否有所不同呢?2017年,同样来自美国Kaiser Permanente医疗集团的多中心研究,汇总了2006-2011确诊的2470例I-III期结直肠癌,中位随访6年,以确诊前2年内3次中性粒/淋巴细胞比值(NLR)的均值代表全身炎症状态,以CT评估第三腰椎肌肉量确定是否存在肌肉减少症。生存分析结果表明,NLR>3和肌肉减少均提示患者生存期缩短。当患者同时存在炎症状态和肌肉减少时,其CRC相关死亡风险较对照患者增加1.43倍( HR, 2.43; 95%CI, 1.79-3.29 )[7]。
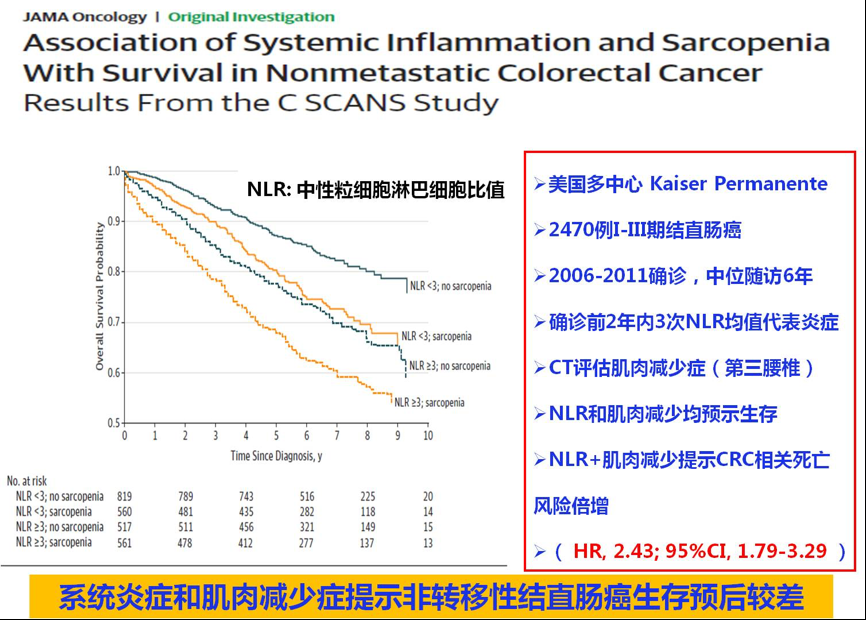
图8. 系统炎症和肌肉减少与非转移性结直肠癌生存预后的相关性:来自C SCANS研究的结果
2018年,美国Kaiser Permanente医疗集团报告了肌肉减少症与乳腺癌生存预后的数据。2000-2013年间纳入3241例II-III期乳腺癌患者,中位随访6年,CT评估肌肉质量、肌肉密度和总脂肪量。结果提示,有34%患者出现肌肉减少症,37%患者肌肉密度降低,肌肉减少症(HR, 1.41; 95%CI, 1.18-1.69)和高体脂含量(HR, 1.35; 95%CI, 1.08-1.69)显著增加早期乳腺癌患者的死亡风险[8]。
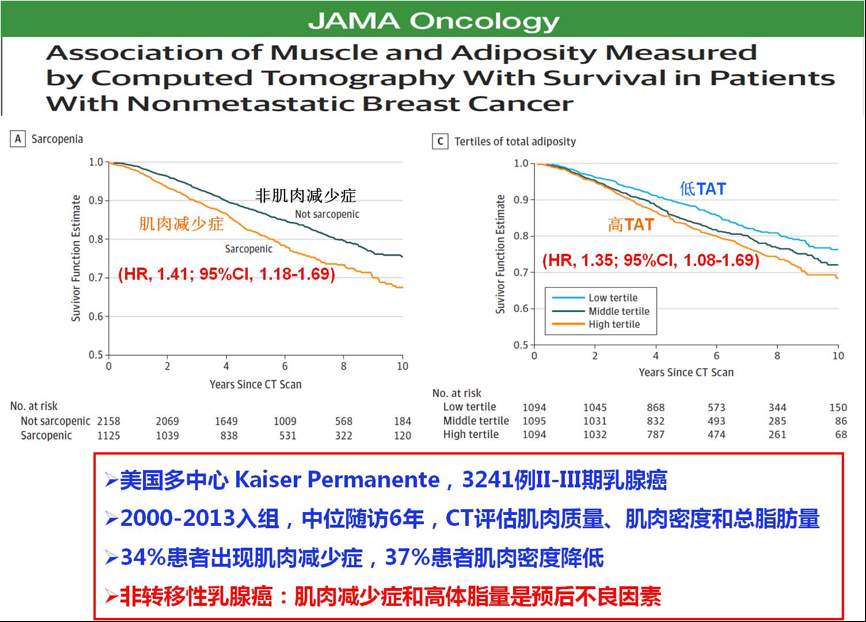
图9. CT检测的肌肉和脂肪含量与非转移性乳腺癌患者的生存预后
除了常见的结直肠癌和乳腺癌以外,体重和身体成分对其他肿瘤的生存预后也会产生影响。2016年,来自美国MD Adnerson的一项单中心研究纳入了2003-2013年间2840例接受放疗的头颈鳞癌,中位随访6年,其中190例可CT评估骨骼肌量(第三腰椎)。结果表明,放疗前低BMI和骨骼肌减少的患者因头颈部鳞癌导致的死亡风险增加,癌症特异性生存期明显缩短[9]。

图10.身体成分与头颈部鳞癌局部放疗患者生存预后的相关性研究
2019年,发表在JNCI杂志上的一项研究报道了肌肉减少对血液系统肿瘤患者造血干细胞移植后生存预后的影响。结果显示,造血干细胞移植前存在肌肉减少症的患者2年无复发死亡风险和总生存期均较非肌肉减少症患者更差[10]。

图11. 肌肉减少症对造血干细胞移植术后患者不良结局的影响
以上研究提示肿瘤患者不但要监测体重,还要关注身体成分,特别是肌肉和脂肪含量。在肿瘤患者中存在一种隐性肥胖:这类患者BMI正常,但是肌肉含量少,脂肪含量高,称为肌肉减少症性肥胖[11]。
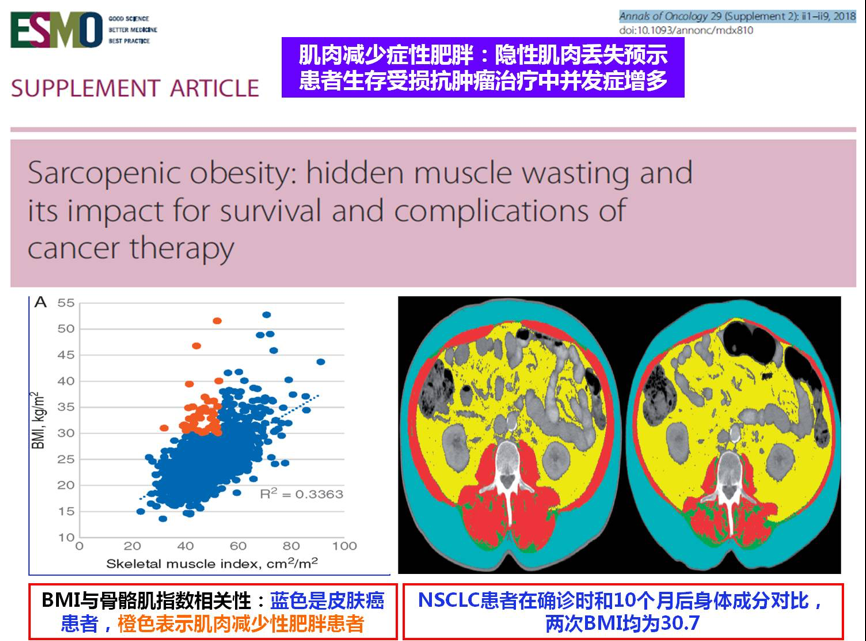
图12.肌肉减少症性肥胖
2018年发表在Annals of Oncology上的一篇文章汇总了肌肉减少症性肥胖对多种肿瘤患者预后和并发症的影响。结果显示,无论是胰腺癌或肝癌手术患者,还是晚期肺癌和胃肠癌解救治疗患者,存在肌肉减少症性肥胖的患者,死亡风险较无肌肉减少症性肥胖患者增加几倍甚至十几倍。另外,这类患者化疗剂量限制性毒性和手术并发症的风险也会增加数倍[11]。
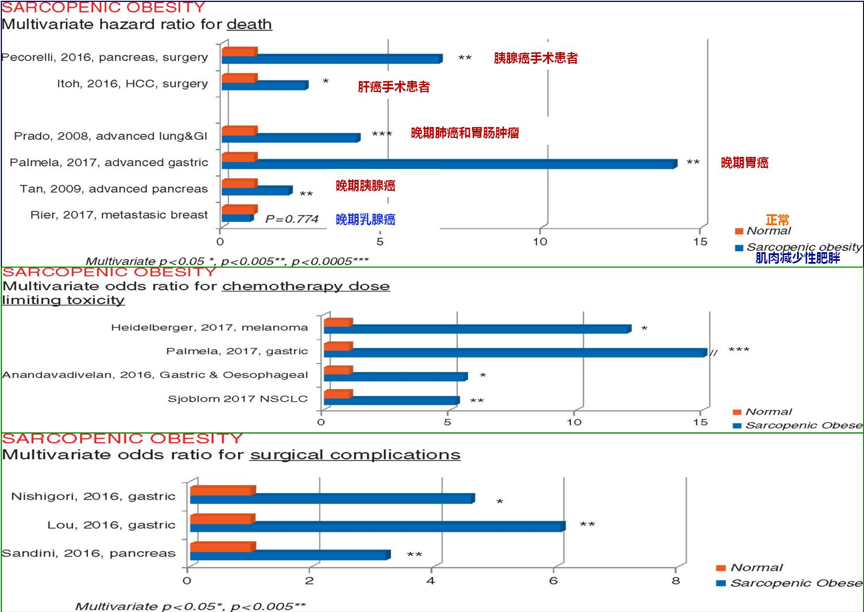
图13. 肌肉减少性肥胖影响生存与后和治疗相关并发症
2018年免疫治疗获得诺贝尔医学奖,目前已经成为抗癌药物的主力军,而营养状况特别是体重对免疫治疗疗效有重要影响。2018年Lancet Oncology上发布的一项回顾性研究分析汇总了全球6项关于黑色素瘤的临床试验,其中靶向、免疫和化疗各2项,共1918例患者,排除BMI<18.5人群(占比<2%),按照性别和治疗方案进行分层分析。结果显示,接受靶向或者免疫治疗且BMI>25的患者,PFS和OS较正常体重患者明显延长,肥胖(BMI>30)患者的生存获益更为显著。但BMI对接受化疗患者的生存预后没有预测意义。分层分析显示,仅男性肥胖患者接受靶向或免疫治疗才有明显获益,不同BMI的女性获益无显著差异[12]。
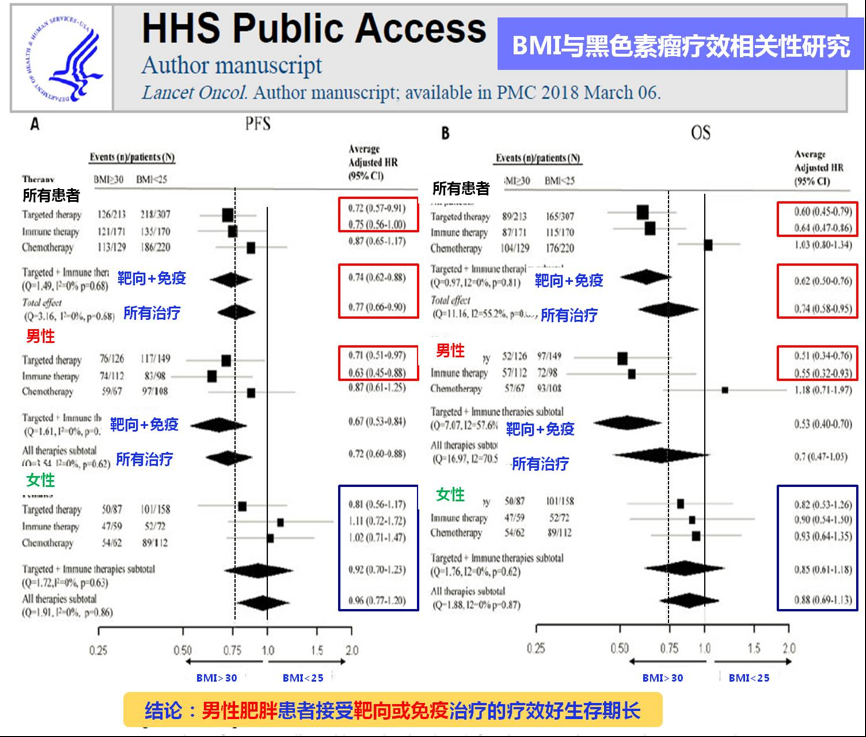
图14. BMI可影响黑色素瘤免疫治疗
2019年来自日本的另一项小样本研究分析了肌肉减少症对晚期非小细胞肺癌抗PD-1治疗疗效的影响,结果显示肌肉减少症患者的客观缓解率(40% vs. 9.1%, p=0.025)和1年无进展生存率(38.1% vs. 10.1%,)均低于非肌肉减少症患者[13]。
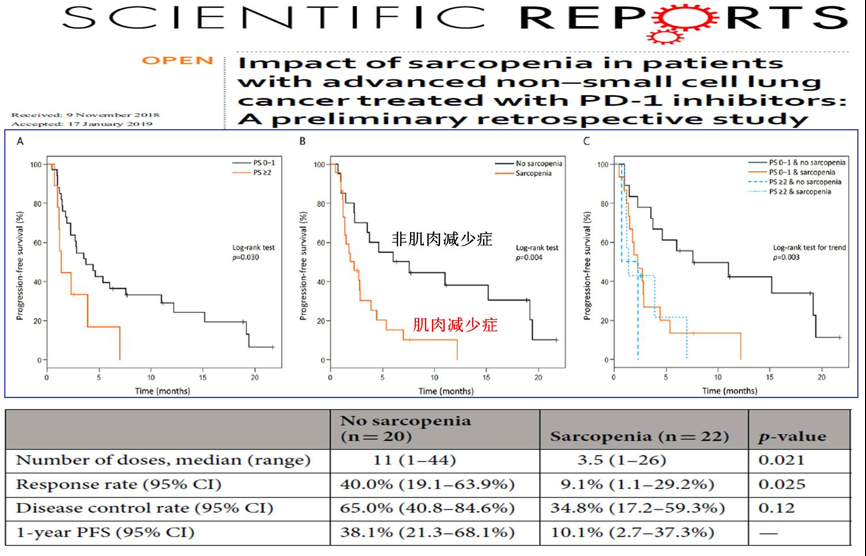
图15.肌肉减少症对晚期非小细胞肺癌抗PD-1治疗疗效的影响
综合以上研究报道,我们不难看出,肿瘤患者的体重和身体成分对多种肿瘤的生存预后、治疗疗效、毒副反应和并发症均有重要影响,特别要关注肌肉减少性肥胖这一不良预后因子。
三、营养在调控体重防治肿瘤中的关键作用
既然超重和肥胖是重要的致癌因子,而体重和身体成分对肿瘤患者生存预后有重要影响,应该如何科学管理自己的体重,以达到防癌抗癌的目的呢?通过下图可以看出,体重的两大决定性因素分别是饮食营养与体力活动。我们重点关注一下, 如何通过饮食营养调控体重达到预防癌症和改善癌症预后的目的。

图16. 癌症预防和生存预后:体重、饮食和运动
首先,2018年的JAMA内科学上发布了一项来自法国的前瞻性队列研究,评估有机食品摄入频率与患癌风险的相关性。该研究纳入了近7万例人群,随访时间跨度7年,结果显示:有机食物的摄入可以显著降低癌症发生风险(HR= 0.75)。这些有机食品主要包括:水果、蔬菜、豆制品、奶制品、鲜肉和鱼、谷物、燕麦、植物油、茶等16类,典型代表就是地中海饮食。多因素分析显示,有机食品摄入评分每增加5分,患癌绝对风险降低0.6%,特别是绝经后乳腺癌、淋巴瘤和皮肤癌风险下降更显著[14]。

图17.有机食品摄入频率与癌症发生风险的相关性
相反,如果饮食中摄入过量的致炎性食物(高盐、腌制、卤制、烧烤食品),癌症发生风险会显著增加。2018年JAMA Oncology上发布了一项研究,纳入了12万人群,随访时间从1986到2012,跨度达26年。最终有共2699例患CRC。结果显示,高促炎膳食增加CRC风险,总人群风险增加32%,男性风险增加44%,女性增加22%[15]。

图18.促炎膳食与结直肠癌发生风险的相关性
发表在美国JNCI杂志上的另一项多中心研究探讨低脂饮食与女性胰腺癌发生风险的相关性。研究纳入共46200位女性。低脂肪组和对照组分别发生92例和165例胰腺癌。根据BMI分层后,超重或肥胖的人群,采用低脂饮食其胰腺癌发生风险明显降低。正常体重人群则无统计差异。说明肥胖人群更应控制脂肪摄入[16]。
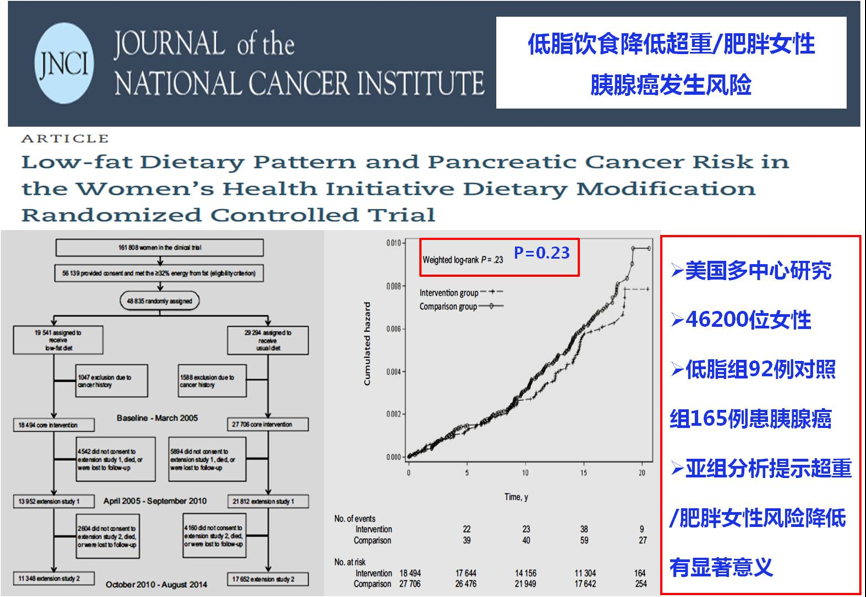
图19.低脂饮食与女性胰腺癌发生风险
以上报道的都是健康人群中营养防癌的研究。对于已经患癌的人群,饮食与营养有哪些影响呢?2018年10月JAMA Oncology上发表的一项研究显示,低脂饮食可以改善绝经后乳腺癌患者的总生存,乳腺癌死亡风险降低14%,其他癌症的死亡风险降低24%,心血管病疾病的死亡风险降低38%,可谓一举多得[17]。因此我们提倡在绝经后乳腺癌患者中限制脂肪摄入量。

图20. 低脂饮食与乳腺癌患者的生存预后
同年在JAMA Oncol上发表的另一篇文章探讨了合理膳食和运动对III期结肠癌患者生存预后的影响。该研究共纳入992例,中位随访7年以上。结果显示,如果能够遵循指南,合理饮食并适度锻炼,III期结肠癌死亡风险可降低42%[18]。

图21.遵循美国癌症协会营养与运动指南对结肠癌生存预后的影响
2018年JNCI上公布的一项研究进一步证实健康饮食可以改善癌症患者的总生存和肿瘤特异性生存。该研究纳入了1197例癌症幸存者,中位随访17.2年,根据膳食调查进行质量评分。高膳食评分可将癌症患者总死亡风险降41%,癌症特异性死亡风险降低68%。将膳食谱汇总分析后发现,高膳食评分最关键的因素是饱和脂肪酸的摄入量低,也就是要尽量减少动物性脂肪摄入[19]。

图22.膳食评分与癌症幸存者生存预后的相关性
在饮食指导的基础上,给予必要的营养干预会显著改善肿瘤患者的生存预后和生活质量。2018年JCSM杂志上发布的一项研究证实,结直肠癌患者术前口服营养素补充(ONS)可以降低切口感染和体重丢失的发生风险[20]。
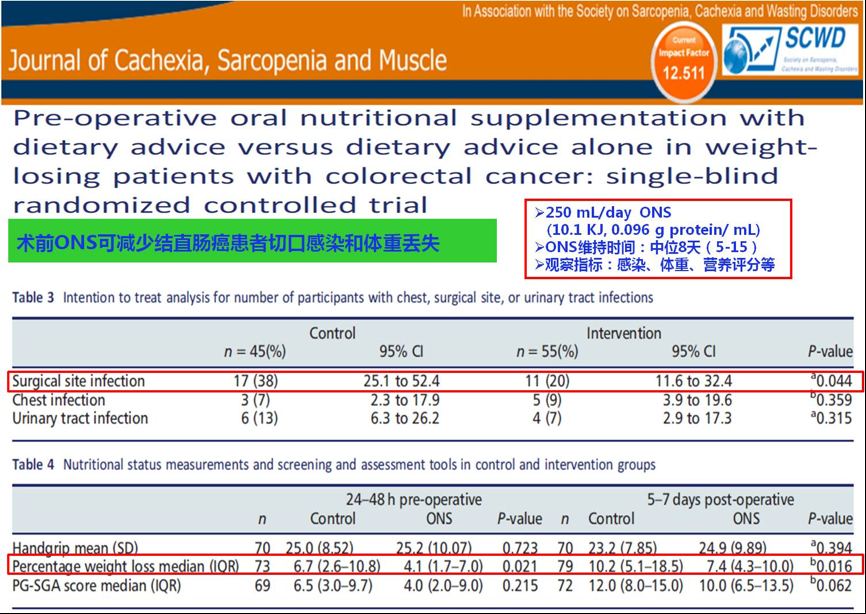
图23. 术前ONS联合饮食指导对比单纯饮食指导对结直肠癌患者体重丢失的影响
同年,在Annals of Oncology上发表的一项meta分析,探讨ONS对放化疗期间患者营养状况和预后的影响。结果显示,接受富含高蛋白和高不饱和脂肪酸ONS治疗的肿瘤患者,可以减少患者体重丢失,显著改善营养状况和生存预后,而单纯饮食指导或高能量ONS不具有此作用[21]。

图24. 放化疗期间ONS对肿瘤患者营养和临床结局的影响
除了饮食指导、营养支持以外,调整食欲的药物也能增加肿瘤患者的体重。2017年Annals of Oncology发布了一项阿拉莫林治疗NSCLC恶液质的三期安全性延长研究(前期研究结果已经发表在Lancet Oncology),结果显示阿拉莫林应用24周较安慰剂对比,可显著增加患者体重、改善厌食-恶液质症状[22]。
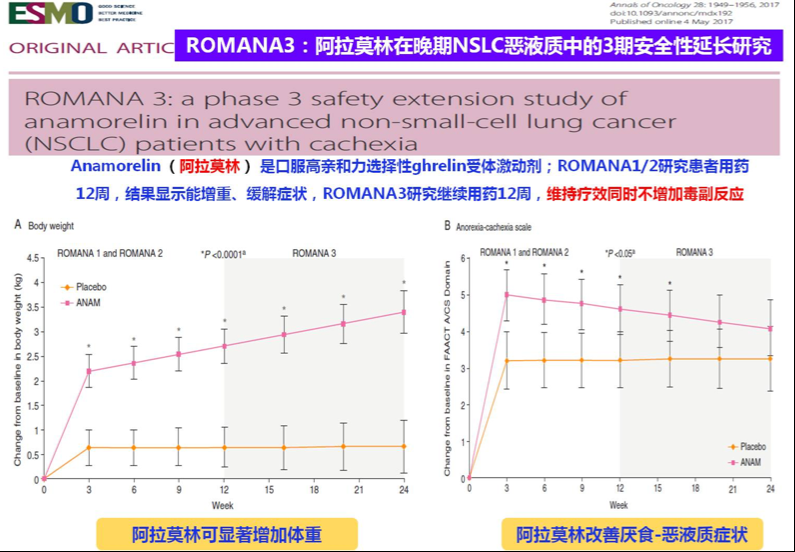
图25.阿拉莫林在晚期非小细胞肺癌恶液质患者中的3期ROMNAN3延长给药研究
综合上述研究结果,我们可以得到以下结论:
1. 肥胖是重要的致癌因素,特别要关注躯干脂肪含量,体重管理要从儿童抓起。
2. BMI/肌肉/体脂含量既可预测癌症患者生存预后,也会影响抗肿瘤治疗的疗效。
3. 健康饮食、运动、保持合适的BMI和身体成分可有效防治肿瘤。
4. 营养防癌是一级预防,营养抗癌是一线治疗,体重需做成分分析、动态评估、全程管理。
专家点评

北部战区总医院肿瘤科主任,医学博士,研究生导师
军队优秀专业技术人才岗位津贴获得者
中国生命关怀协会常务理事
中国抗癌协会肿瘤支持治疗骨髓保护专委会副主委
辽宁省肿瘤精准治疗与大数据管理分会主委
辽宁省营养学会肿瘤营养治疗分会主委
辽宁省抗癌协会靶向治疗专委会候任主委
辽宁省中医药学会淋巴水肿综合治疗专委会名誉主委
中国抗癌协会中西医整合肿瘤专委会常委
中国医促会肿瘤内科分会常委
获军队及辽宁省科技成果二等奖3项,荣立三等功1次 承担国家、军队和辽宁省科研基金8项,主编专著2部,获国家专利3项, 发表SCI及核心期刊论文50余篇
1. 关于肥胖与癌症的发生
人类千百万年的进化历程中,如何对抗饥饿延续生命是永恒的主题。从茹毛饮血到刀耕火种,基因进化让我们的身体习惯于”Stay hungry”,习惯于在极为有限的食物摄入情况下也能够完成为生存而必须进行的体力劳动。现代文明和科技的进步让吃饱肚子变得不再艰难。一个电话,就可以足不出户,坐等美食送上门。这种生活方式的急剧改变,已然超越了人类基因进化的速度,身体不出问题反倒是不正常了。能量摄入过多,活动消耗渐少,最终导致人类肥胖日渐流行,随之而来的则是肿瘤等疾病的发病率飙升。从某种意义上说,肥胖本身就是一种疾病。如何破解超重或肥胖带来的癌症负担?目前倡导的低碳饮食、运动健身就是济世良方。西方有一句名言叫”You are what you eat”,进餐时把这句颇有哲理的话在脑海中回想几次,或许能够增强我们合理膳食的自控力。
2. 关于体重与癌症治疗
癌症患者普遍存在体重丢失和身体成分改变,影响抗癌疗效和生存预后。因此毫不夸张的说,体重就是肿瘤患者的第5大生命体征。体重丢失发展到极端形式就是恶液质。2017年全球顶级期刊CA A cancer journal for clinicians上发表了一篇述评,指出广大医护人员对恶液质的的认知和重视程度远远不够。大约61%-77%的患者在IV期以前出现恶液质时得不到合理治疗,46%的受访医护人员在患者体重丢失>10%时才会诊断恶液质并开始治疗[23,24]。营养不良和体重丢失如此明显尚不能接受足够的诊治,更遑论那些体重正常但身体成分悄然发生改变的肿瘤患者了。如何破解体重或体成分改变导致的肿瘤疗效和预后不良?中华医学会肠外肠内营养分会、中国抗癌协会肿瘤营养专委会主任委员石汉平教授已然告诉我们答案——“还营养为一线治疗”。
1. Hyuna Sung et al. CA Cancer J Clin. 2019;69(2):88-112.
2. Krishnan Bhaskaran et al. Lancet 2014; 384: 755–65.
3. Liu PH et al. JAMA Oncol. 2019;5(1):37-44.
4. Premenopausal Breast Cancer Collaborative Group. et al. JAMA Oncol. 2018; 4(11):e181771.
5. Kelly SP et al. J Natl Cancer Inst. 2016;109(3).
6. Lindsay A. Renfro, et al, J Clin Oncol. 2016;34(2):144-50.
7. Feliciano EMC, et al. JAMA Oncol. 2017;3(12):e172319.
8. Caan BJ, et al. JAMA Oncol. 2018;4(6):798-804
9. Grossberg AJ, et al. JAMA Oncol. 2016;2(6):782-9.
10. Saro H. Armenian, et al. JNCI J Natl Cancer Inst. 2019; 111(8):djy231
11. Baracos VE et al. Annals of Oncology. 2018;29 (Supplement 2): ii1–ii9,
12. McQuade JL et al. Lancet Oncol. 2018; 19(3): 310–322
13. Shiroyama T, et al. Sci Rep. 2019;9(1):2447.
14. Baudry J et al. JAMA Intern Med. 2018;178(12):1597-1606
15. Feliciano EMC et al, JAMA Oncol. 2018;4(3):366-373.
16. Jiao L et al. JNCI J Natl Cancer Inst. 2018; 110(1): djx1
17. Rowan T. et al. JAMA Oncol. 2018;4(10):e181212.
18. Van Blarigan EL et al. JAMA Oncol. 2018;4(6):783-790
19.. Ashish A. Deshmukh et al. JNCI J Natl Cancer Inst (2018) 0(0): pky022
20. Sorrel T. Burden et al. Journal of Cachexia, Sarcopenia and Muscle 2017; 8: 437–446
21. de van der Schueren MAE et al. Annals of Oncology 2018;29: 1141–1153.
22. Currow D et al. Annals of Oncology. 2017;28: 1949–1956.
23. Barton MK et al,CA Cancer J Clin. 2017;67(2):91-92.
24. M. Muscaritoli et al, Ann Oncol. 2016; 27(12): 2230–2236.











 苏公网安备32059002004080号
苏公网安备32059002004080号


