
第35例
乳腺癌是女性发病第一的肿瘤,目前经过综合治疗后,早期乳腺癌5年生存率有较大的提高,但仍有30%~40%的患者会复发转移。HER2+的乳腺癌占所有乳腺癌的20%~25%,这类患者的预后较差。HER2+乳腺癌中有50%的患者为HR+。因此,HR+/HER2+的乳腺癌患者约占总体人群的10%。目前HR+/HER2+型晚期乳腺癌治疗方案尚无统一标准,此类患者的治疗方案强调个体化治疗,以使用化疗、靶向治疗、内分泌治疗等多种模式综合治疗为主,本文通过回顾一个HR+/HER2+型乳腺癌患者持续内分泌治疗联合抗HER2治疗长期获益的病例,介绍目前有关该类患者的临床治疗思路。

安庆市立医院甲状腺乳腺外科
安徽省卫计委第五周期学科带头人、青年领军人物
安徽省普通外科质控中心甲状腺乳腺外科质控专业组专家成员
安徽省乳腺专科医疗联合体第一届委员会常委
安徽省抗癌协会乳腺癌专业委员会副主任委员
安徽省老年医学学会乳腺专业委员会副主任委员
安徽省医学会外科分会甲状腺乳腺学组委员
安徽省医学会乳腺病学分会常委
安徽省医学会乳腺病学分会乳腺微创副组长
安徽省医师协会乳腺疾病专业委员会常委
中国医药教育协会乳腺疾病专业委员会乳腺癌多学科诊疗学组委员

安庆市立医院 甲状腺乳腺外科
主持安徽医科大学科研基金1项
2011年获浙江大学肿瘤学硕士学位,发表SCI论文1篇
安徽省抗癌协会甲状腺癌专业委员会青年委员会委员
基本情况
患者女性,34岁,于2010年5月因“发现左乳肿块3月余”首次就诊。
家族史:姐姐有乳腺癌病史。
月经史:绝经前,月经规则。
入院查体
左乳内上象限扪及一约10mm×15mm大小肿块,质硬,无压痛,边界不清,活动差,无乳头溢血溢液及皮肤皱缩等改变,右乳未及明显肿块,双侧腋窝及锁骨上未触及肿大淋巴结。
手术治疗
患者于2010年5月4日行左乳肿块切除术,术中快速冰冻提示左乳浸润性癌,更改手术方式为左乳癌改良根治术。术后病理示:左乳浸润性导管癌,Ⅲ级,大小15mm×10mm×10mm ,未见脉管内癌栓及神经累及,乳头、皮肤、基底未见癌累及,LN(+)0/24。免疫组化(IHC)示:ER(+),PR(+++),HER2(++),Ki-67(约40%+)。未行FISH检测。
术后诊断
左乳浸润性导管癌(pT1N0M0,Ⅰ期,HR+型)。
术后治疗
术后予以CEF方案6周期(环磷酰胺500mg/m2+表柔比星75mg/m2+氟尿嘧啶 500mg/m2)。他莫昔芬10mg,每天2次口服维持内分泌治疗,25个月后自行停药。未进行放疗。
第1次转移
2014年3月,患者复查胸部CT示:双肺多发结节及胸骨骨质破坏,考虑为乳腺癌转移。颅脑MR示:左侧小脑内异常强化小结节,转移瘤可能。原肿瘤蜡块加做FISH检测:阳性。
诊断:左乳浸润性导管癌术后化疗后肺、胸骨、脑转移(HR+/HER2+型),无病生存(disease free survival,DFS)为46个月。
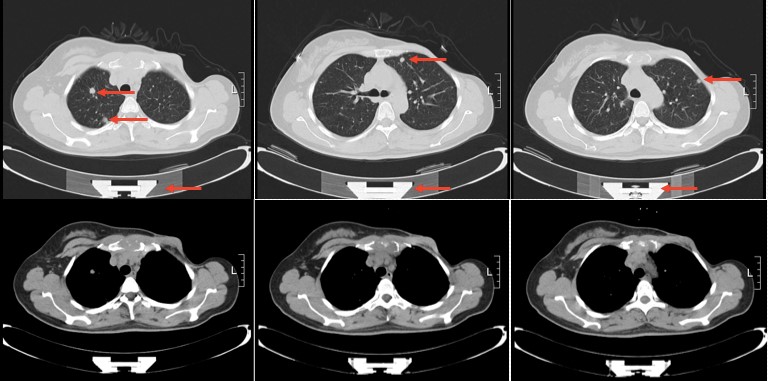
2014年3月胸部CT
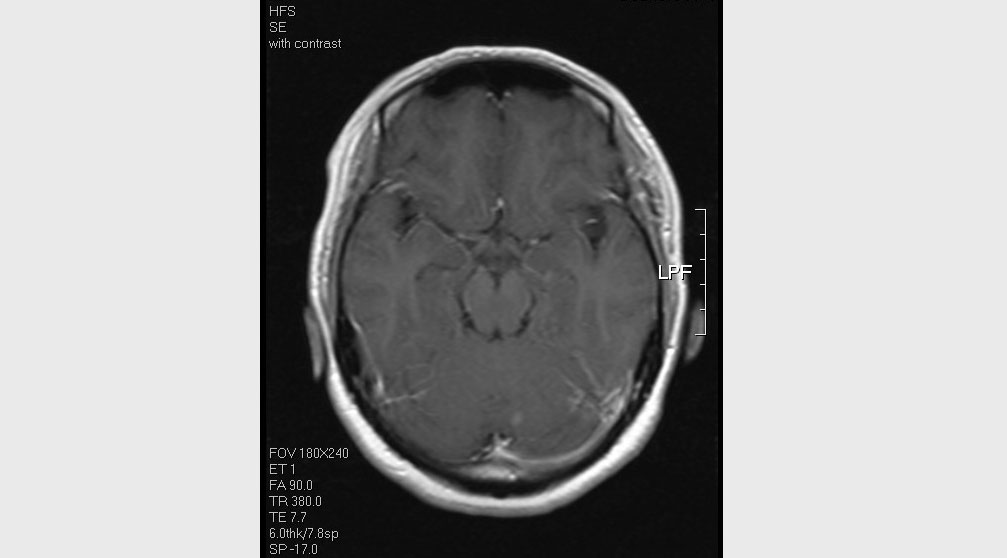
2014年3月颅脑MRI
一线治疗
予以靶向联合化疗:曲妥珠单抗8mg/kg静脉滴注,序贯6mg/kg静脉滴注,每3周1次;多西他赛100mg/m2静脉滴注,每3周1次,6周期。放疗:全脑30Gy/10F。骨转移治疗:唑来膦酸4mg静脉滴注,每4周1次。
疗效评价:部分缓解(partial response, PR)。
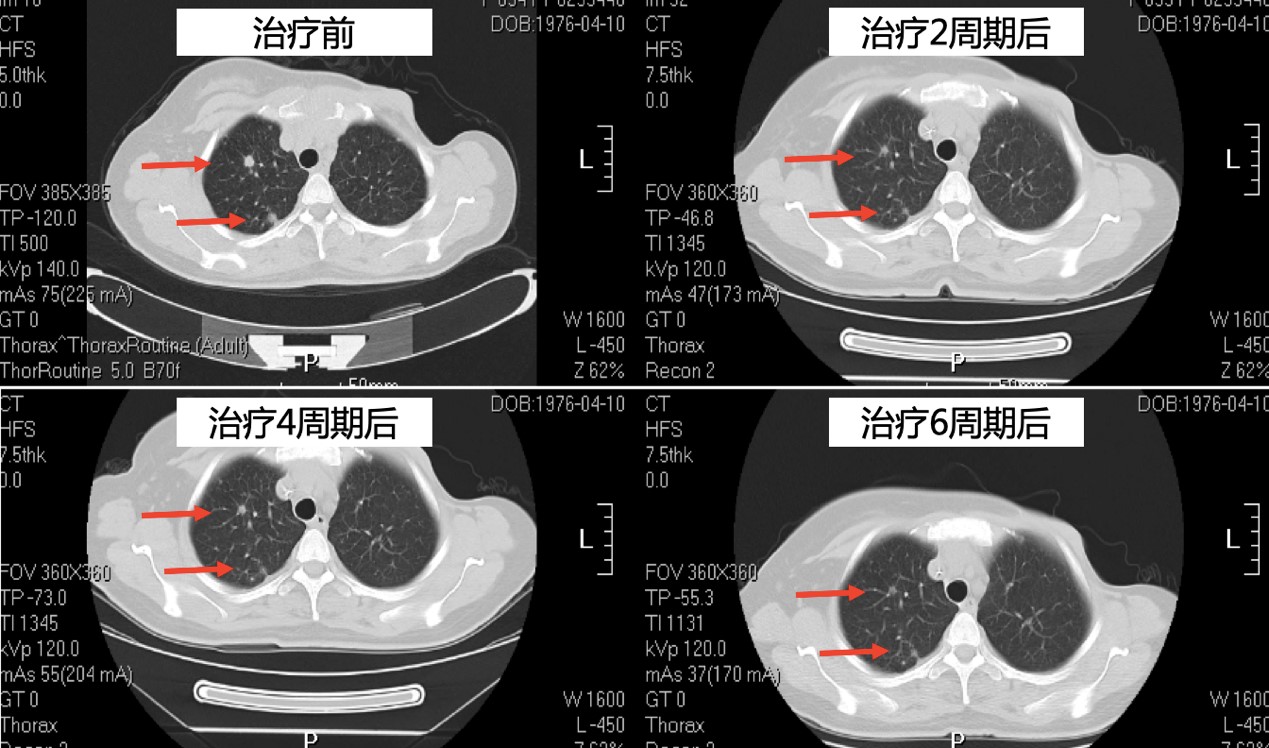
胸部CT
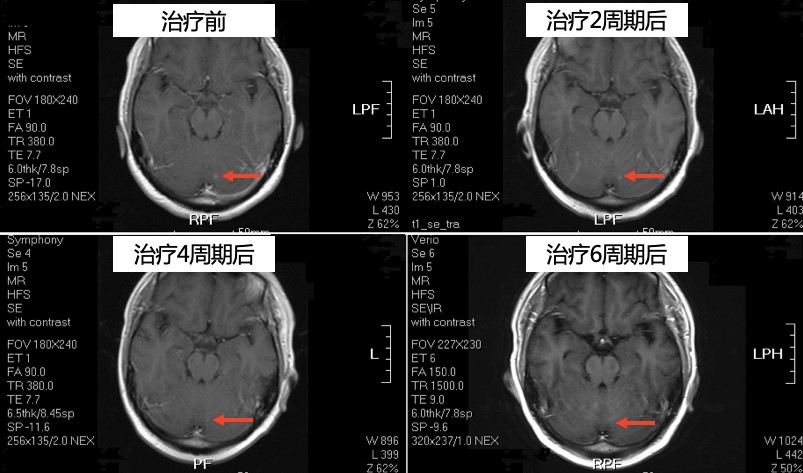
颅脑MRI
维持治疗(一线治疗有效后)
2014年9月至2016年3月,予以靶向治疗:曲妥珠单抗6mg/kg静脉滴注,每3周1次。内分泌治疗:戈舍瑞林3.6mg皮下注射,每4周1次;阿那曲唑片1mg口服,每天1次。骨转移治疗:唑来膦酸4mg静脉滴注,每4周1次,1年后改为每3月1次。
疗效评价:PR。
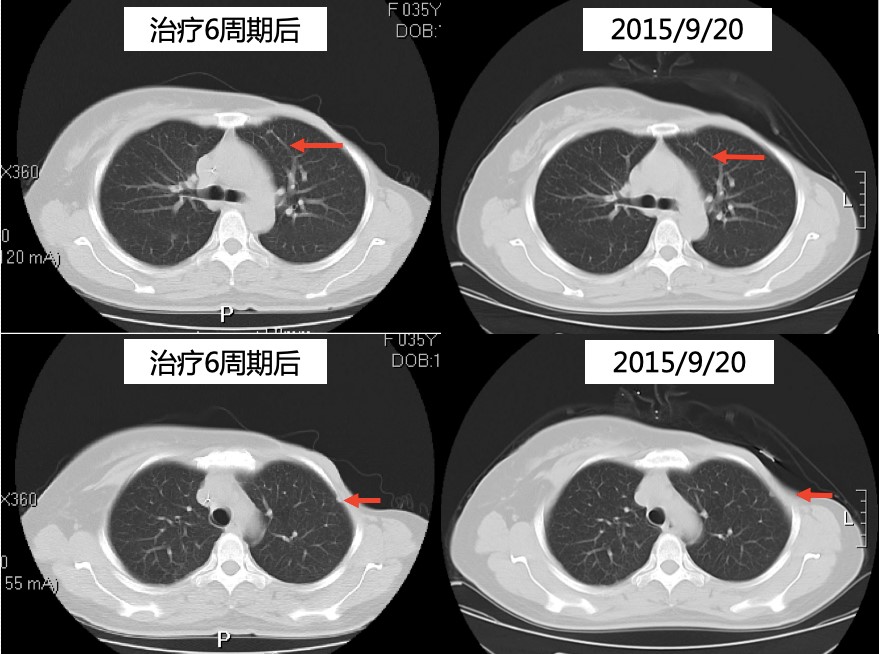
胸部CT
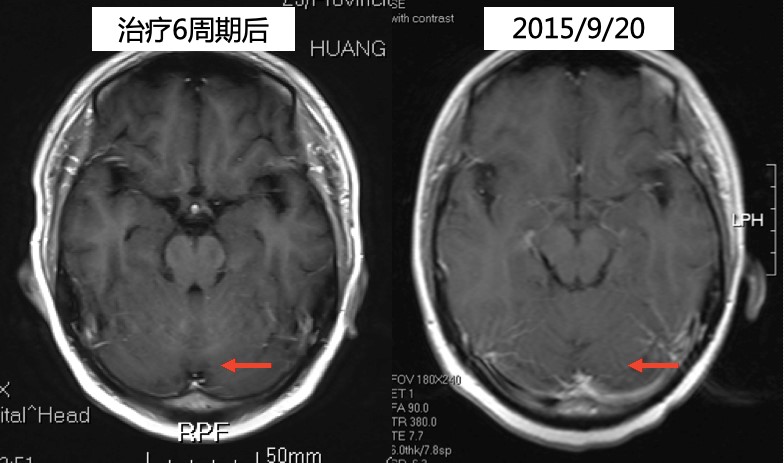
颅脑CT
第2次进展
2016年3月20日复查,胸部CT:右肺多发类结节灶,右肺上叶结节较前略增大。颅脑MR:未见明显异常。无进展生存(progress free survival,PFS)为24个月。
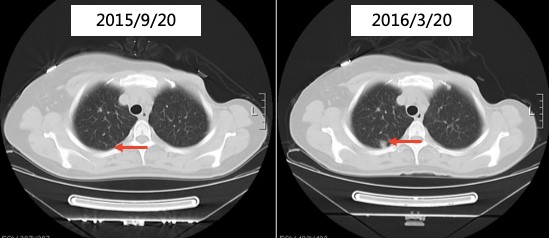
胸部CT提示进展
治疗方案
2016年4月至今,靶向治疗:曲妥珠单抗6mg/kg静脉滴注,每3周1次。内分泌治疗:戈舍瑞林3.6mg皮下注射,每4周1次;氟维司群500mg,第1、14、28天,肌内注射,序贯500mg,肌内注射,每4周1次。骨转移治疗:唑来膦酸4mg静脉滴注,每3个月1次。
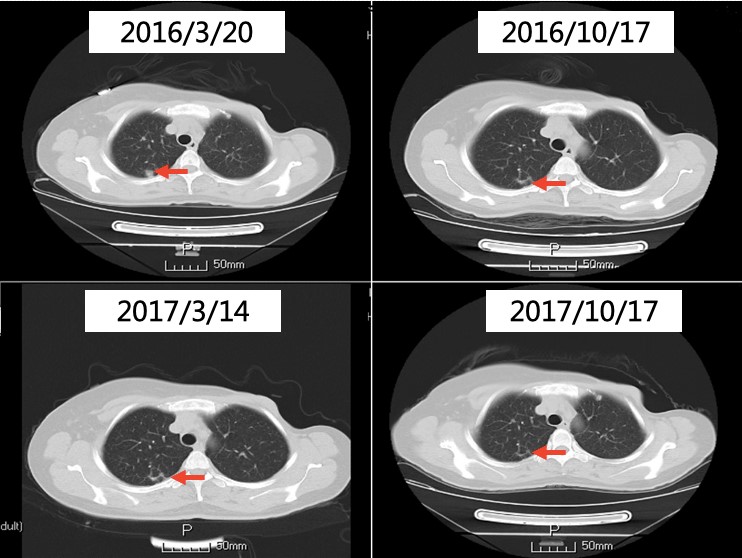
胸部CT
总结
患者发病年龄为34岁,年轻女性,有家族史(姐姐乳腺癌病史)。因“发现左乳肿块3月余”于2010年5月就诊。2010年5月4日行左乳肿块切除术,术中快速冰冻提示左乳浸润性癌,行左乳癌改良根治术。术后病理:左乳浸润性导管癌。IHC:ER(+),PR(+++),HER2(++),Ki-67(约40%+);未行FISH检测。术后诊断:左乳浸润性导管癌(pT1N0M0,Ⅰ期,HR+/HER2+)。术后予以CEF方案6周期辅助治疗,后TAM 10mg口服维持治疗25个月后自行暂停,未行放疗。
2014年3月复查胸部CT、颅脑MRI显示脑转移。原肿瘤蜡块加做FISH检测:阳性。复发诊断:左乳浸润性导管癌术后化疗后肺、胸骨、脑转移(HER2+/HR+)。DFS为46 个月。予以曲妥珠单抗联合多西他赛6周期,全脑30Gy/10F放疗,使用唑来膦酸控制骨转移。疗效评价:PR。2014年9月至2016年3月,予以曲妥珠单抗+戈舍瑞林+阿那曲唑维持治疗,继续予以唑来膦酸控制骨转移。疗效评价:PR。
2016年3月20日复查胸部CT发现疾病进展。PFS1达到24个月。予以曲妥珠单抗+戈舍瑞林+氟维司群联合治疗,继续唑来膦酸治疗骨转移至今,PFS2为 34个月。
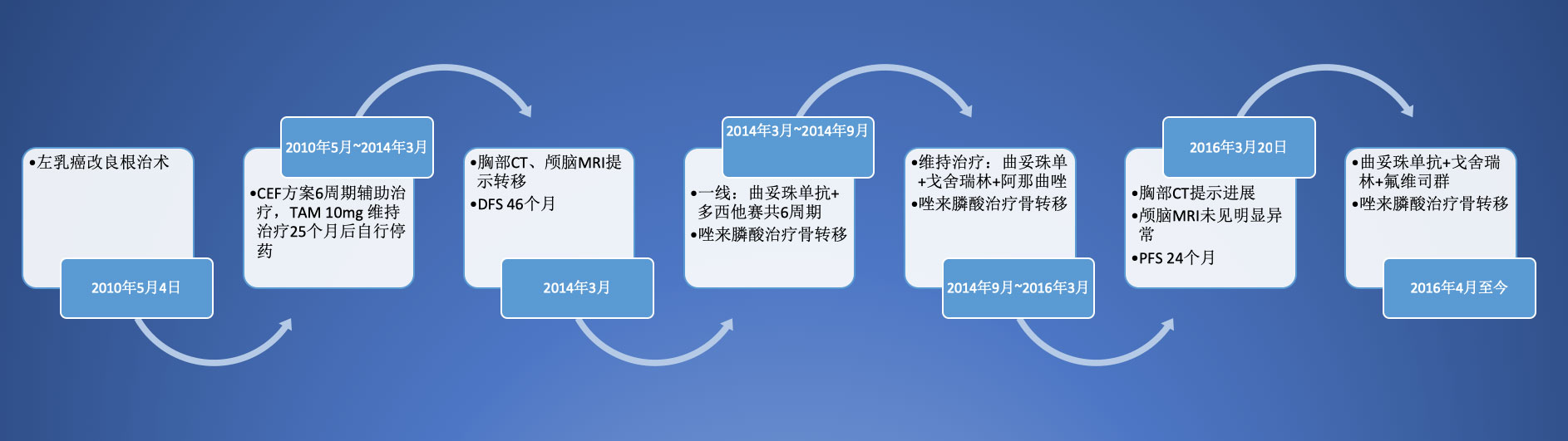
患者治疗历程图
点评专家

南京医科大学第一临床医学院副院长
中国临床肿瘤学会(CSCO)常务理事
CSCO乳腺癌专家委员会副主任委员
CSCO智慧医疗专家委员会副主任委员
中国医师协会精准医疗乳腺癌专业委员会副主任委员
中国医药教育协会肿瘤免疫治疗专业委员会副主任委员
中国抗癌协会乳腺癌专业委员会常委
中国抗癌协会肿瘤药物临床研究委员会常委
中国宋庆龄基金会肿瘤医疗及产学研联盟副理事长
吴阶平医学基金会肿瘤医学部常委
点评
患者为34岁绝经前年轻女性,有家族史(姐姐乳腺癌病史)。因“发现左乳肿块3月余”于2010年5月4日行左乳肿块切除术,术中快速冰冻提示左乳浸润性癌,行“左乳癌改良根治术”,术后诊断左乳浸润性导管癌(pT1N0M0,Ⅰ期,HR阳性型)。因未进行FISH检测未知HER2类型。术后辅助治疗予以化疗及内分泌治疗。患者使用TAM内分泌治疗未达到推荐使用年限自行停止,也增加了复发转移的风险。4年多后出现复发转移,进行FISH检测后明确分子分型,及时给予抗HER2靶向治疗。患者分子分型为HR+/HER2+型,出现转移的病灶为两肺、胸骨、左侧小脑。根据ECOG PS评分以及肿瘤转移灶的风险程度,予以抗HER2治疗、OFS+AI联合内分泌治疗、全脑姑息放疗、针对骨转移治疗等综合治疗手段,PFS达到24个月,超过中位生存时间,获益明显。可见,抗HER2治疗对于HER2阳性患者的重要性。
第二次进展,患者为肺内进展,脑内无明显病灶。结合病情,继续予以曲妥珠单抗持续抗HER2治疗,同时更换二线内分泌治疗方案为OFS+氟维司群,目前病情稳定,未出现进一步疾病进展,PFS已达34个月,持续抗HER2治疗后获益明显。
总体而言,该病例术后未及时明确分子分型,且内分泌治疗不足。出现复发转移后进一步明确分子分型,并予以持续抗HER2治疗、内分泌治疗、全脑姑息放疗、骨转移治疗等,获益明显。
1.分子分型应全面,避免出现治疗不足的情况
本病例患者为34岁绝经前年轻女性、有家族史(姐姐乳腺癌病史)、III级、HER2(++)、Ki-67(约40%+),按术后复发危险分组为中危组。临床分期为pT1N0M0,Ⅰ期。根据《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》2018V1指出:可考虑辅助化疗的因素(具备以下之一者)为腋窝淋巴结阳性、三阴性乳腺癌、HER2阳性乳腺癌(T1b以上)、肿瘤>2cm、 组织学分级为Ⅲ级。而腋窝淋巴结阴性的HER2阳性乳腺癌患者辅助治疗适应证应考虑:①T1c及以上患者应该接受曲妥珠单抗辅助治疗。②T1b患者可推荐曲妥珠单抗辅助治疗。③T1a患者可考虑曲妥珠单抗辅助治疗,尤其伴高危因素患者,如激素受体阴性、分级差、Ki-67高等。而HR阳性患者满足以下危险因素之一者:①G2或G3;②淋巴结阳性1~3个;③pT2及以上,建议予以OFS+TAM内分泌治疗5年。
HERA研究[1]证实曲妥珠单抗用于 HER2 阳性早期乳腺癌术后辅助治疗,显著提高HER2阳性早期乳腺癌治愈机会,显著降低复发和病死风险,因该患者未进行HER2基因FISH/CISH检测,未能明确HER2状态,辅助治疗未使用抗HER2治疗,导致了初始治疗的不足。目前未推荐淋巴结阴性改良根治术后患者进行预防性胸壁照射,故该患者未推荐进行放射治疗。因为TAM治疗停药以及未进行抗HER2辅助治疗等导致后续复发。
2.一线及时使用抗HER2治疗,延长生存时间
患者一线治疗予以曲妥珠单抗+多西他赛共计6周期,同时予以全脑30Gy/10F放疗,唑来膦酸骨转移治疗,疗效评价PR。后续予以H+OFS+AI靶向以及内分泌维持治疗。PFS达24个月。
HER2 阳性、激素受体阳性的复发转移乳腺癌,优先考虑曲妥珠单抗联合化疗。H0648g和M77001研究[2,3]证实在紫杉类基础上联合曲妥珠单抗治疗能够显著提高PFS和OS,确立了曲妥珠单抗联合紫杉类在一线标准治疗的地位。而CLEOPATRA研究[4]则证实,帕妥珠单抗+曲妥珠单抗的PH双靶一线治疗,延长了HER2阳性乳腺癌患者的PFS(分别为18.5个月和12.4个月)。目前帕妥珠单抗已在国内上市,未来一线治疗也可考虑双靶方案。而对于HR+/HER2+转移性乳腺癌HER2 靶向治疗联合化疗达到疾病稳定的患者,化疗停止后,可考虑使用 HER2 靶向治疗联合芳香化酶抑制剂维持治疗。PERTAIN研究[5]显示,使用帕妥珠单抗联合曲妥珠单抗和芳香化酶抑制剂进行维持治疗,比曲妥珠单抗联合芳香化酶抑制剂维持的PFS更长(分别为18.89和15.80个月,P=0.007)。本病例患者维持治疗PFS长达24个月,进一步说明抗HER2治疗联合内分泌治疗获益明显。
3.一线治疗进展后,二线持续抗HER2治疗依然获益
2016年3月20日患者复查胸部CT,发现肺部疾病进展。颅脑MRI未见明显异常。根据《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》2018V1指出:曲妥珠单抗治疗进展后,持续抑制 HER2 通路能够持续带来生存获益。改患者一线治疗PFS长达24个月,二线改为OFS+氟维司群内分泌治疗,同事继续给予抗HER2治疗,再次获得34个月的PFS。可谓是内分泌治疗联合抗HER2治疗完美控制的典型病例。
此病例为HR+/HER2+乳腺癌,术后未检测HER2状态,因此未行抗HER2治疗。这充分地警示我们HER2阳性乳腺癌往往比HER2阴性肿瘤更具侵袭性,更易发生复发转移,早期HER2阳性乳腺癌复发的可能性为HER2阴性乳腺癌的2~5倍,即使小肿瘤也可能复发转移。辅助抗HER2治疗则可以让这部分患者获得治愈机会。
1.CAMERON D, PICCART-GEBHART MJ, GELBER RD, et al; Herceptin Adjuvant (HERA) Trial Study Team. 11 years' follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial[J]. Lancet. 2017 Mar 25;389(10075):1195-1205.
2.BASELGA J, CORTÉS J, KIM SB, et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer[J]. New England Journal of Medicine, 2018,366(2), 109–119.
3. MARTY M, COGNETTI F, MARANINCHI D, et al. Randomized phase II trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer administered as first-line treatment: the M77001 study group [J]. J Clin Oncol, 2005, 23(19):4265-4274.
4. SWAIN S M, KIM S B, CORTÉS J, et al. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA study): overall survival results from a randomised, double-blind, placebo-controlled, phase 3 study[J]. Lancet Oncol,2013 ,14(6):461-471.
5.RIMAWI M, FERRERO J-M, DE LA HABA-RODRIGUEZ J, et al. First-Line Trastuzumab Plus an Aromatase Inhibitor, With or Without Pertuzumab, in Human Epidermal Growth Factor Receptor 2–Positive and Hormone Receptor–Positive Metastatic or Locally Advanced Breast Cancer (PERTAIN): A Randomized, Open-Label Phase II Trial[J]. J Clin Oncol. 2018;36(28):2826-2835.











 苏公网安备32059002004080号
苏公网安备32059002004080号


