
第28例

深圳市第二人民医院乳腺疾病诊疗中心主任
粤港澳大湾区乳腺专科医师联盟主任
广东省医师协会乳腺专科医师分会主任委员
广东省医学会乳腺病学会副主任委员
广东省抗癌协会乳腺癌专业委员会副主任委员
广东省深圳市医师协会乳腺专科医师分会会长
广东省深圳市医学会甲状腺乳腺外科专业委员会主任委员、外科学专业委员会副主任委员
广东省深圳市抗癌协会副理事长、乳腺癌专业委员会主任委员
中国医师协会乳腺外科专业委员会委员
亚洲乳癌协作组常务委员
美国乳腺外科医师协会会员

广东省深圳市第二人民医院乳腺疾病诊疗中心
美国佛罗里达医院微创外科访问学者。已取得基因健康管理师职业培训证书、美国佛罗里达州尼克森中心微创外科手术培训证书。在国内核心期刊发表多篇文章
基本病史
患者女性,48岁,围绝经期。2018年7月以“发现左乳肿物半年余”为主诉入院。既往体健,否认慢性病、传染病史。
▎入院查体:KPS 90分,左乳约6点钟方向乳头乳晕下方可触及一约6cm×5cm×4cm大小的肿物,质硬、形状欠规则,活动差,伴有局部皮肤轻度水肿和色素沉着。左侧腋窝可触及约2cm×1cm大小淋巴结,质硬,无压痛,活动度尚可。
▎辅助检查:①乳腺超声提示:左侧乳腺6点钟处见低回声团,大小约50mm×40mm,形态不规则,呈蟹足样改变,边界不清,内见血流信号,性质待定,BI-RADS 4级。左侧腋下低回声团,考虑淋巴结可能,大小约21mm×8mm。②乳腺MRI:左乳多发肿块及结节,最大约54mm×48mm×38mm,高度怀疑恶性可能,BI-RADS 5级。左侧胸大小肌间、左腋下淋巴结建议活检,不排除转移可能。③胸部CT:双肺下叶胸膜下小结节,双侧胸腔少量积液。④腹部CT平扫:未见明显异常。
治疗经过
1.穿刺活检
患者无明显禁忌,于2018年7月19日行超声引导下左乳肿物穿刺术,术后病理示:左乳腺浸润型导管癌,非特殊类型,SBR Ⅲ级。 免疫组化:ER(-),PR(-),HER2(2+),Ki-67 (35%)。FISH进一步检测提示HER2扩增。临床分期:cT4N1M0 ⅢB期。分子分型:HER2阳性HR阴性型。
2.新辅助化疗
结合患者自身状况和身体情况,于2018年7月行 nab-PCHP方案(白蛋白结合型紫杉醇+卡铂+曲妥珠单抗+帕妥珠单抗)术前新辅助治疗4个周期。 2周期后综合疗效评价为部分缓解(partial response,PR),4周期后综合疗效评价为完全缓解(complete response,CR),如图1所示。
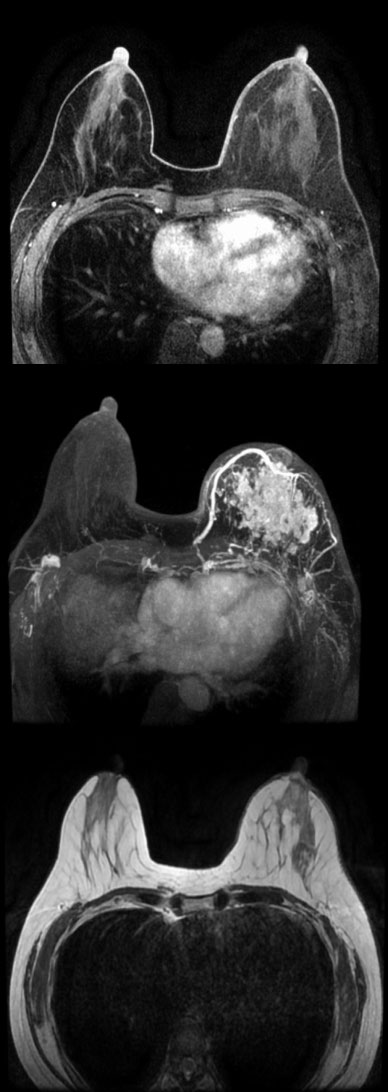
图1 患者乳腺MRI(上:治疗基线,中:2周期治疗后,下:4周期治疗后)
3.手术治疗
患者无明显禁忌,为最大程度改善预后,患者于2018年11月行保留乳头乳晕的左侧乳房皮下腺体切除+同侧腋窝淋巴结活检备腋窝淋巴结清扫术。术中快速冰冻提示:左乳头乳晕切缘下1、2、3点处及左乳晕皮肤活检均未见癌。术后病理示:左侧乳腺腺体新辅助化疗后,镜下见保留血管的间质纤维,上、下、内、外及基底切缘均为阴性。左腋窝淋巴结见纤维脂肪组织伴局部少许淋巴细胞浸润,未见癌(0/10)。术后分期:ypT0N0M0,R0。
4.术后辅助治疗
▎化疗:术后2周经与患者家属反复沟通交流,行PTH方案2周期,至今使用曲妥珠单抗联合帕妥珠单抗维持治疗,拟维持1年。
▎局部放疗:患者放疗后行同侧胸壁+锁骨上/下淋巴引流区、内乳+腋窝放疗。
至今定期复查未见明显复发或转移。
总结
患者于2018年7月行超声引导下左乳肿物穿刺,病理示:左乳腺浸润型导管癌,SBR Ⅲ级。免疫组化:ER(-),PR(-),HER2(2+),Ki-67 (35%),HER2扩增。初始予以nab-PCHP方案新辅助治疗4周期。后于2018年11月行保留乳头乳晕的左侧乳房皮下腺体切除+同侧腋窝淋巴结活检备腋窝淋巴结清扫术,病理未见癌组织,达到pCR。术后继续予以nab-PCHP方案辅助治疗2周期并序贯局部放疗,后PH方案(曲妥珠单抗联合帕妥珠单抗)维持治疗,截至目前未出现疾病复发或进展。
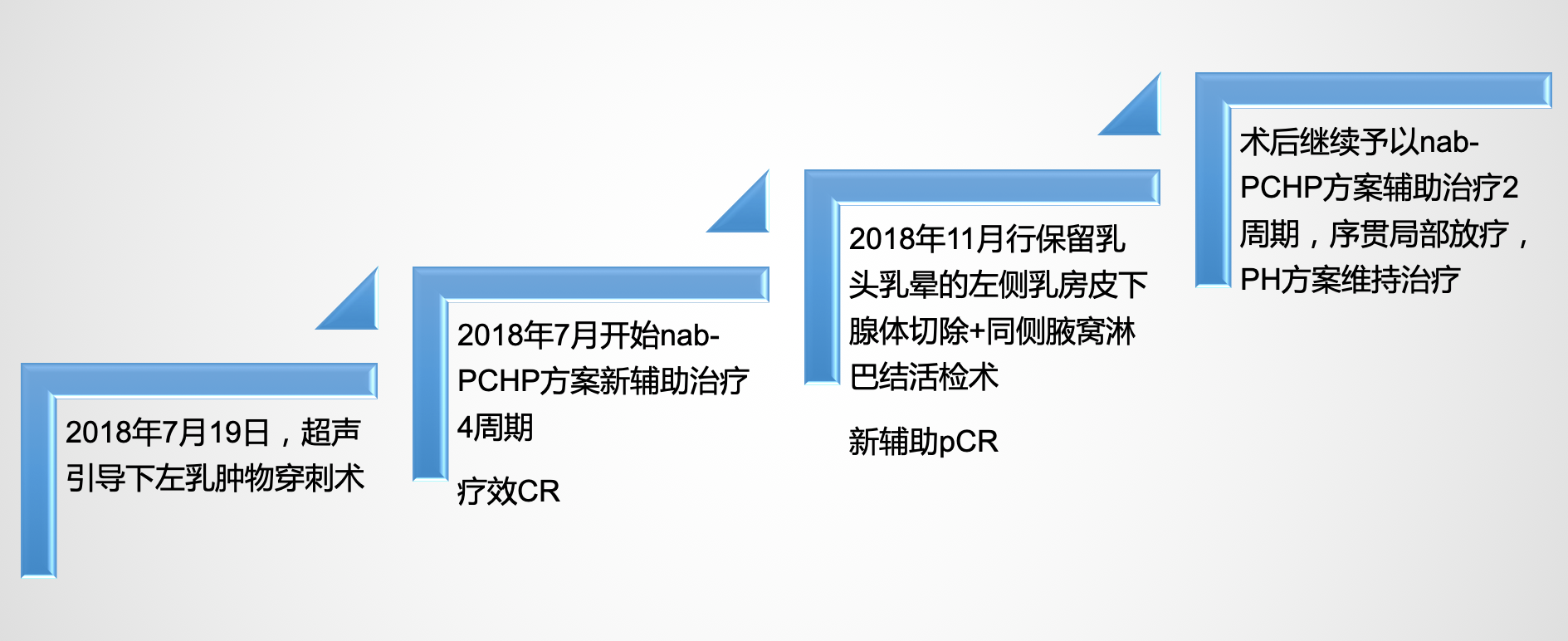
图2 治疗流程图
点评专家

北京大学肿瘤医院乳腺内科
参与或主持数十项抗肿瘤及其辅助药物的临床研究
SFDA新药评审专家,北京市医疗技术事故鉴定专家
北京肿瘤防治研究会乳腺癌分委会候任主委
北京乳腺病防治学会内科专委会副主委
中国性学会乳腺疾病分会第一届委员会副主委
北京乳腺病防治学会健康管理专业委员会常务委员
北京医学会乳腺疾病分会第一届委员会委员
首届中国研究型医院学会乳腺专业委员会委员
中国老年学会老年肿瘤专业委员会乳腺癌分委会副主任委员
点评
患者为中年女性,48岁。首诊予以穿刺活检,病理示:左乳腺浸润型导管癌,非特殊类型,SBR Ⅲ级。 免疫组化:ER(-),PR(-),HER2(2+),Ki-67 (35%)。FISH进一步检测提示HER2扩增。临床分期:cT4N1M0 ⅢB期。分子分型:HER2阳性HR阴性型。初治局部晚期HER2阳性乳腺癌患者适合新辅助治疗指征,新辅助治疗可以降级、降期,也可通过新辅助治疗筛选术后需要强化的患者,提高患者治愈率。HER2阳性晚期一线、新辅助以及术后辅助等多项研究证实曲妥珠单抗+帕妥珠单抗双靶联合较曲妥珠单抗单靶向治疗可以明显提高疗效。《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》2018 V1版指出,满足以下条件之一者可选择术前新辅助药物治疗:①肿块较大(>5cm);②腋窝淋巴结转移;③ HER2阳性;④三阴性;⑤有保乳意愿,但肿瘤大小与乳房体积比例大难以保乳者。该患者选用nab-PCPH方案新辅助治疗,取得pCR。截至目前未出现疾病复发或进展,患者的(术前与术后)辅助化疗、靶向治疗、放疗的序贯治疗是非常合适和有效的。乳腺癌中HER2阳性乳腺癌是一种凶险程度很高的乳腺癌类型,这类肿瘤绝大部分依赖于HER2通路来驱动肿瘤细胞的增殖,20%~30%的乳腺癌患者存在HER2基因的扩增及其编码蛋白的过表达,与肿瘤侵袭性强、复发率高有关,预后不良。曲妥珠单抗是目前应用最主要、最广泛的HER2靶向药物,既往以HERA、NOAH 等为代表的一系列研究已多次证实曲妥珠单抗用于HER2阳性早期乳腺癌的辅助治疗能够显著提高HER2阳性早期乳腺癌的治愈机会,显著延长HER2阳性晚期乳腺癌患者的总生存期(overall survival,OS),显著降低复发和病死风险,是HER2阳性早期乳腺癌辅助治疗的标准药物。值得警惕的是HER2阳性乳腺癌往往比HER2阴性肿瘤更具攻击性,早期乳腺癌复发的可能性为HER2阴性肿瘤的2~5倍,即使很小的肿瘤也可能复发转移。目前通过曲妥珠单抗1年标准辅助治疗,已显著提高了HER2阳性早期乳腺癌的治疗效果,75%的早期HER2阳性乳腺癌患者达到治愈,但同时仍有25%的患者在10年内出现复发或死亡,其中淋巴结阳性或激素受体阴性的患者具有更高的复发死亡风险,10年复发转移率超过30%。
该患者新辅助治疗后予以保留乳头乳晕的左侧乳房皮下腺体切除+同侧腋窝淋巴结活检术,术后病理提示:左乳腺浸润性导管癌,SBRⅢ级。免疫组化:ER(-),PR(-),HER2(2+),Ki-67 (35%),HER2扩增。白蛋白结合型紫杉醇较溶剂型紫杉醇在晚期乳腺癌治疗中可以提高反应率和PFS,在新辅助治疗阶段也可以提高pCR率。因此对于需要新辅助化疗的患者选择白蛋白结合型紫杉醇也是合理的选择。目前国际上对HER2阳性的患者推荐使用曲妥珠单抗联合帕妥珠单抗双靶+化疗治疗。既往NeoSphere研究结果显示,曲妥珠单抗+帕妥珠单抗双靶向联合化疗显著提高pCR率并改善患者生存。后续的APHINITY研究在辅助治疗上取得长足进步,该研究是一项随机、双盲、安慰剂对照、国际多中心的双臂研究,以评估帕妥珠单抗联合曲妥珠单抗加化疗的辅助疗法与帕妥珠单抗联合化疗相比的有效性和安全性。共入组4805名HER2阳性、可手术的早期乳腺癌患者,初步分析时中位时间为45.4个月,后期将继续随访达10年。双靶联合使早期HER2阳性乳腺癌患者的复发或死亡风险(无浸润性疾病生存,iDFS)显著下降19%(HR=0.81; 95% CI:0.66~1.00, P=0.045)。特别对于淋巴结阳性及激素受体阴性的高复发风险患者,帕妥珠单抗联合曲妥珠单抗的辅助治疗可以使患者复发或死亡风险降低25%。帕妥珠单抗治疗的安全性较好,心脏不良反应事件发生率低,无新的不良反应发生。故《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》2018 V1版推荐HER2阳性乳腺癌患者辅助治疗时,若患者具备高危因素,可考虑曲妥珠单抗+帕妥珠单抗的双靶联合治疗。目前,曲妥珠单抗联合帕妥珠单抗+化疗已被全球超过75个国家批准用于HER2阳性乳腺癌的新辅助治疗。
该患者为局部晚期HER2阳性乳腺癌,通过nab-PCHP方案新辅助治疗,获得较好的pCR率,再予以双靶向联合辅助治疗,近期治疗取得了很好的疗效,也启示HER2阳性乳腺癌抗HER2治疗的必要性与重要性。
1.Procter M , Suter TM , de Azambuja E, et al. Longer-term assessment of trastuzumab-related cardiac adverse events in the herceptin adjuvant (HERA) trial[J]. Journal of Clinical Oncology, 2010, 28(21):3422-3428.
2.Gianni L , Dafni U , Gelber R , et al. Treatment with trastuzumab for 1 year after adjuvant chemotherapy in patients with HER2-positive early breast cancer: a 4-year follow-up of a randomised controlled trial.[J]. Lancet Oncology, 2011, 12(3):236-244.
3. Von Minckwitz G, Procter M, De Azambuja E, et al. Adjuvant pertuzumab and trastuzumab in early HER2-positive breast cancer[J]. N Engl J Med, 2017, 377(2):122-131.
4. Baselga J, Swain S M. CLEOPATRA: a phase III evaluation of pertuzumab and trastuzumab for HER2-positive metastatic breast cancer.[J]. Clinical Breast Cancer, 2010, 10(6):489-491.
5. Rugo H, Brammer M, Zhang F, et al. Effect of trastuzumab on health-related quality of life in patients with HER2-positive metastatic breast cancer: data from three clinical trials[J]. Clinical Breast Cancer, 2010, 10(4):288-293.
6.Minckwitz C,Procter M, Azambuja E, et al.Adjuvant pertuzumab and trastuzumab in early HER2-positive breast Cancer[J/OL]. DOI: 10.1056/NEJMoa1703643
7. Gianni L, Pienkowski T, Im YH, et al.5-year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced, inflammatory, or early-stage HER2-positive breast cancer (NeoSphere): a multicentre, open-label, phase 2 randomised trial[J]. Lancet Oncol, 2016.











 苏公网安备32059002004080号
苏公网安备32059002004080号


