
第24例
对于HER2阳性乳腺癌患者而言,持续的抗HER2治疗是非常重要的治疗策略。对于目前已经上市的多种不同作用机制的抗HER2治疗药物,多项研究表明,不同作用机制的抗HER2药物联合使用可获得更好的治疗效益,患者生存获益更明显。本文通过对HER2阳性型复发晚期乳腺癌患者持续抗HER2治疗并获益,总生存时间5年余的病例,介绍目前有关该类患者的临床治疗思路。

西安交通大学第二附属医院 肿瘤科
中国肿瘤学会(CSCO)乳腺癌青年专家委员会委员
中国肿瘤学会黑色素瘤青年专家委员会委员
中国抗癌协会肿瘤标志专业委员会会员
陕西省抗癌协会热疗专业委员会秘书
陕西省抗癌协会化疗专业委员会委员
获得省、市级课题4项
病史简介
患者,女性,发病年龄58岁。既往史、个人史无特殊;无家族性遗传病史,无肿瘤相关家族史。初潮年龄13岁,绝经年龄51岁,适龄结婚生育,育有1子1女,子女及爱人体健。
主诉
发现右乳包块1个月。初诊时间:2013年4月。
入院查体以及辅助检查
查体:右乳外上象限3cm×3cm大小包块,质硬,活动度差。
2013.04.20 B超提示右乳外上可探及低回声结节,大小约35mm×30mm,边界欠清,形态不规则,其内可见强回声光点反射。腋窝淋巴结可探及数个低回声结节融合,较大约16mm×10mm大小,边界不清,形态饱满,皮髓质分界不清。
2013.04.21 乳腺增强MRI提示:右乳外上象限肿块,形态类圆形,边缘可见毛刺,内部不均匀强化,病灶最大直径35mm×30mm,腋窝可见肿大淋巴结。诊断意见:右侧乳腺外上象限肿块(BI-RADS 4C)。
2013.04.24 乳腺穿刺活检病理:右乳非特殊型浸润性导管癌Ⅱ级,右侧腋窝淋巴及纤维组织内可见癌细胞浸润,免疫组化:ER(-),PR(-),HER2(++),FISH(+), Ki-67 40%。
临床诊断
右乳浸润性导管癌(cT2N2M0 ,IIIA期),分子分型为HER2阳性HR阴性型。
新辅助治疗及评价
2013.04.26一2013.07.20予以EC-TH方案(表柔比星,100mg/m2,150mg×d1 + 环磷酰胺,600mg/m2,900mg×d1)4周期。
评价见表1。
表1 疗效评价
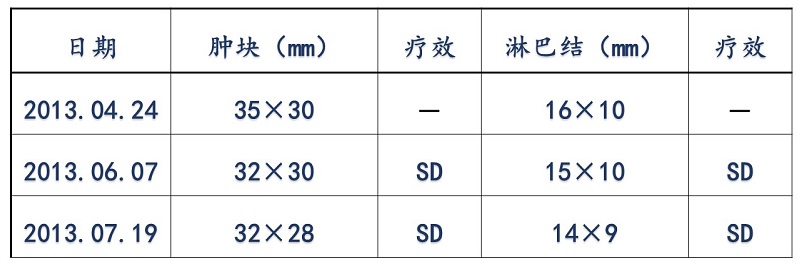
后续治疗及评价
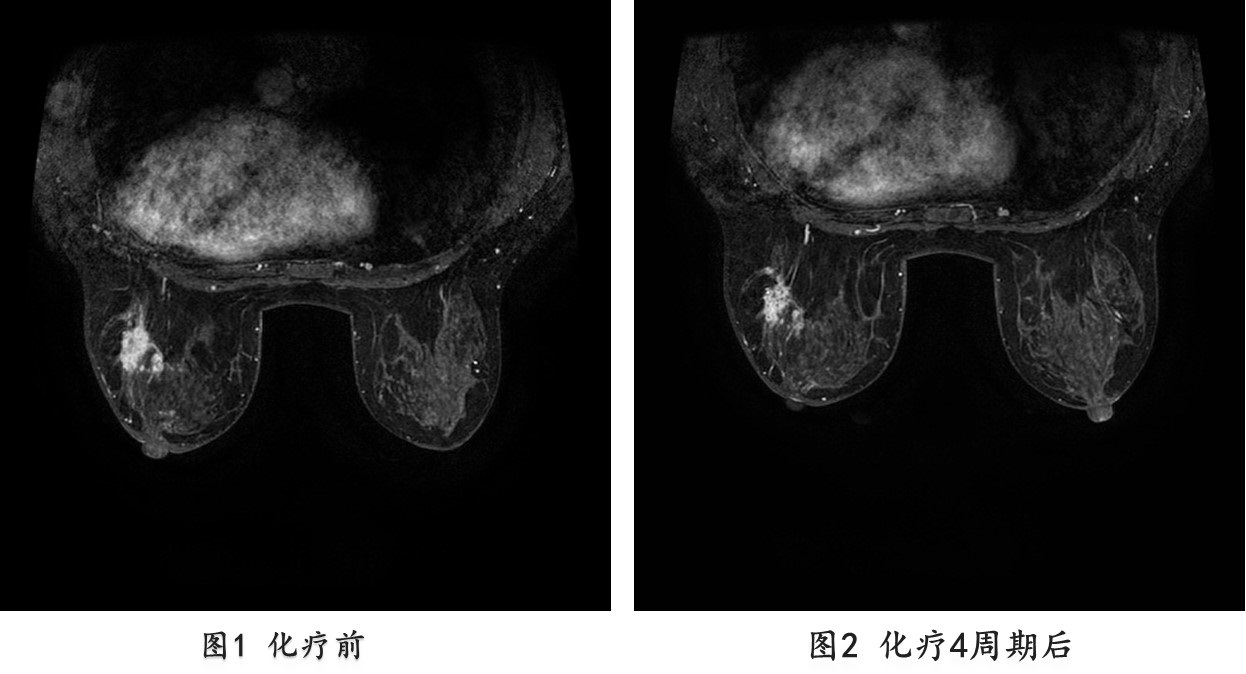
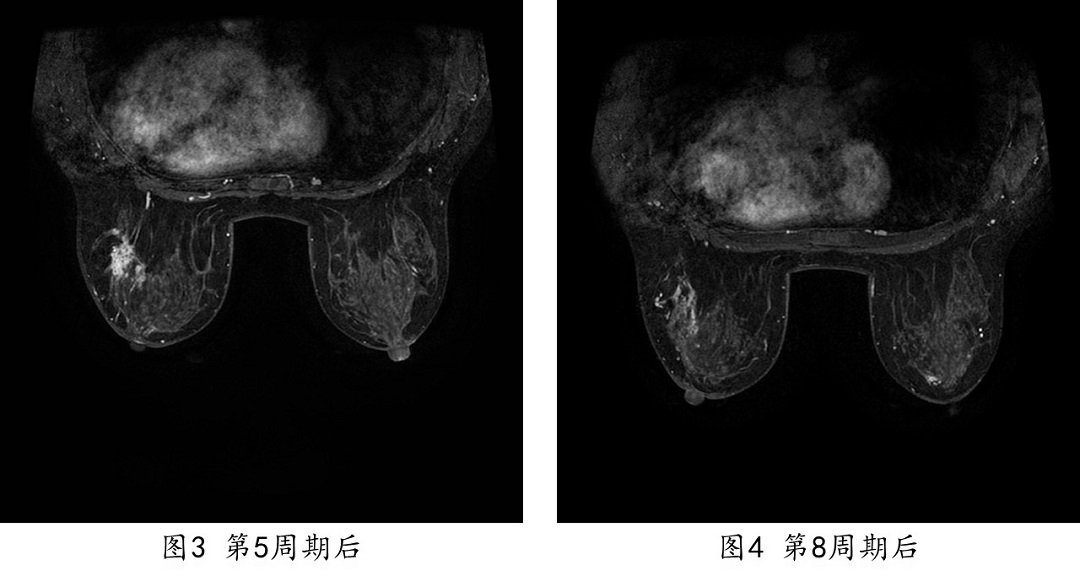
2013.08.10一2013.10.12 继续EC-TH方案(多西他赛,100mg/m2,150mg×d1 + 曲妥珠单抗8mg/kg,首次;后3周期 6mg/kg)4周期。
疗效评价PR,辅助检查如下:
2013.10.24 B超提示右乳外上可探及低回声结节较前明显缩小,大小约5mm×5mm,腋窝淋巴结可探及数个低回声结节,较大约10mm×6mm大小,边界不清,形态饱满,皮髓质分界不清。
2013.10.25 乳腺增强MRI提示:右乳外上象限病灶明显缩小,最大直径8mm×5mm,腋窝可见肿大淋巴结。
手术及术后病理
2013.10.27 行右乳腺癌改良根治术。
术后病理:乳腺病灶仅存少量癌细胞(G4),腋窝淋巴结9/16转移。腋窝淋巴结免疫组化: ER(-),PR(-),HER2(++),FISH(-),P53(-),bcl-2(-),CK5/6(-),Ki-67(+)30%。
术后诊断
右乳腺癌(ypT1N2M0,IIIA期)。
辅助治疗
曲妥珠单抗1年维持治疗。胸壁放疗2Gy/25次/50Gy。
第1次复发
2016.02.08自觉胸骨中下部疼痛。骨扫描提示:胸骨/髂骨多发高代谢影。腹部CT、脑MRI、浅表淋巴结B超未见明显异常。
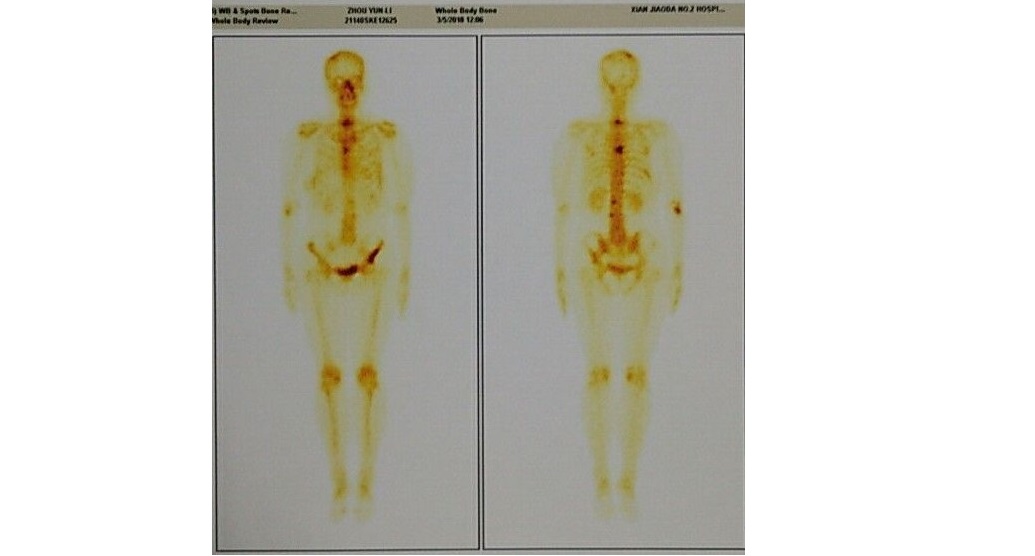
图5 骨扫描影像
诊断:右乳浸润性导管癌新辅助治疗后术后放疗后骨转移(HER2阳性HR阴性型)。
术后至复发 DFS=15个月。
一线解救治疗及评价
2016年2月开始予以卡培他滨+曲妥珠单抗方案,同时予以唑来膦酸治疗,患者骨痛较前缓解。疗效评价PR。后续予以卡培他滨+曲妥珠单抗维持治疗。
第2次复发
2018.01.23患者出现上腹部胀痛,纳差。肝功能:ALT 110 U/L,AST 90U/L,TBIL 34 μmol/L。CT增强提示肝转移瘤。肝脏穿刺活检病理:转移性浸润性导管癌。免疫组化: ER(-),PR(-),HER2(+++),Ki-67(+)40%。余检查未见明显异常。
诊断:右乳浸润性导管癌综合治疗后骨、肝转移(HER2阳性HR阴性型)。
PFS1=19个月。
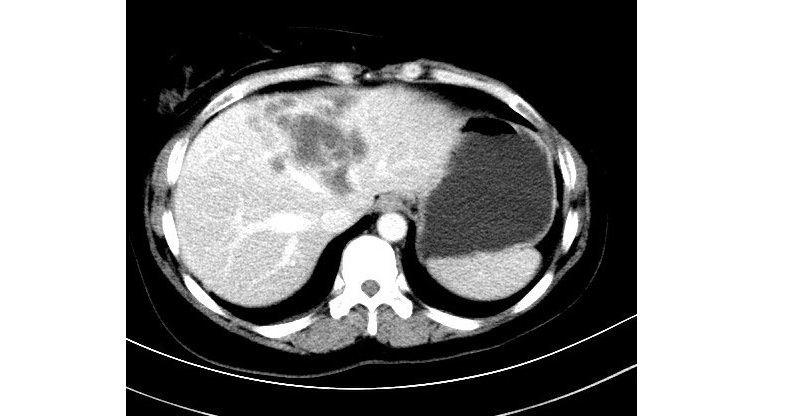
图6 CT增强影像
二线解救治疗及评价
保肝治疗后复查肝功能:ALT 50U/L,AST 40U/L,TBIL 22μmol/L。
治疗方案:曲妥珠单抗+拉帕替尼+白蛋白结合型紫杉醇6周期。疗效评价PR。
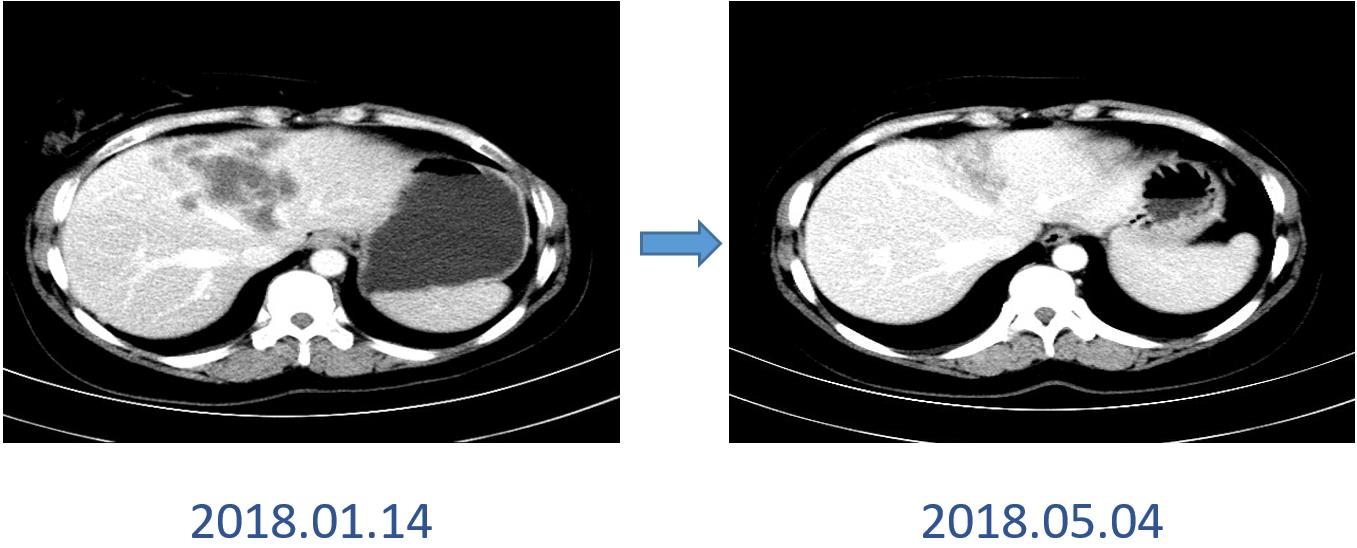
图7 2018年1月和5月CT影像
后续治疗
随后接受曲妥珠单抗6mg/kg×d2 + 拉帕替尼1250mg/日×d1-14维持治疗至2018年11月。
第3次复发
2018.11.10 复查脑MRI提示左侧枕叶囊实性异常信号,实性部分明显强化,囊性部分边缘强化,病变大小30mm×22mm,脑转移瘤可能。余病灶较前稳定,无新发病灶。
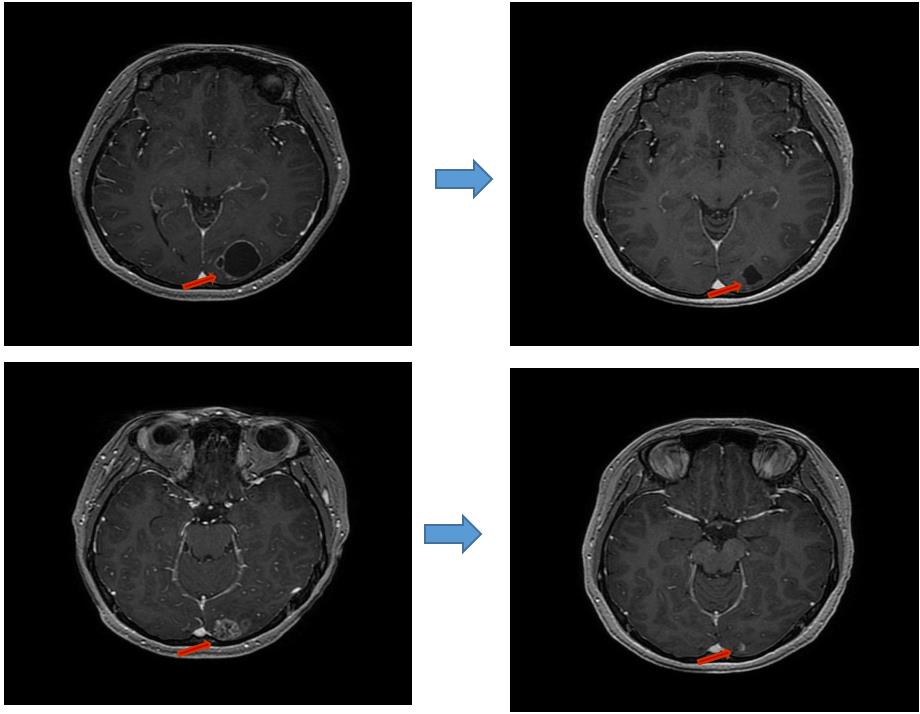
图8 2018年11月MRI影像
诊断:右乳浸润性导管癌综合治疗后骨、肝、脑转移(HER2阳性HR阴性型)。
PFS2=10个月。
三线解救治疗及评价
2018年11月开始予以伽玛刀治疗。评价:脑内病灶PR。
治疗历程回顾
表2 治疗历程回顾
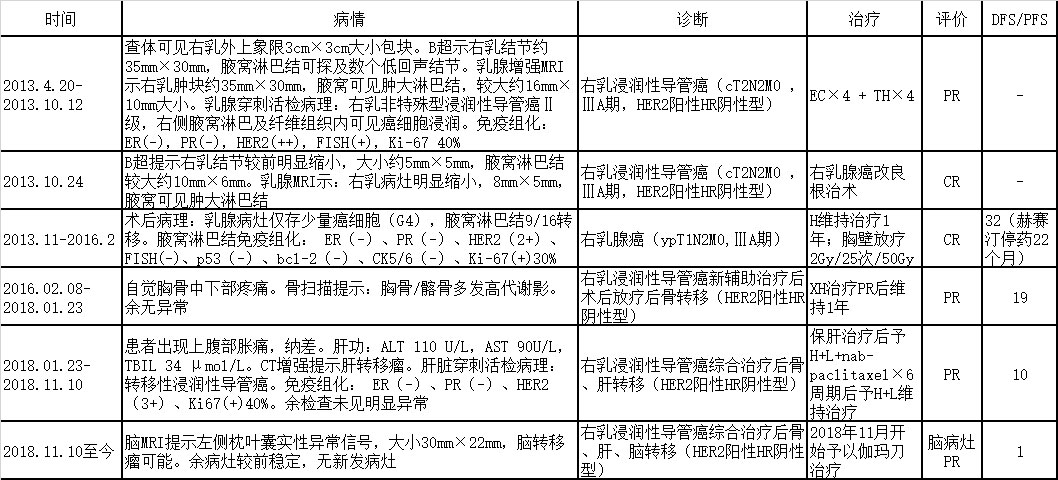
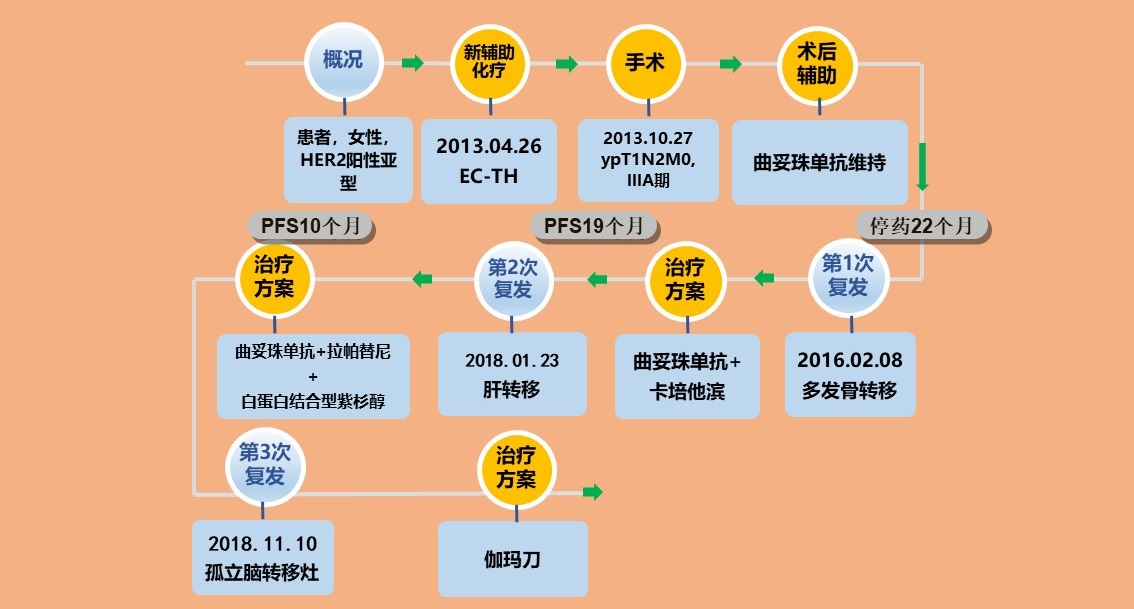
图9 治疗小结
总结
患者为中老年女性,发病年龄58岁。首诊右乳浸润性导管癌(cT2N2M0 ,IIIA期,HER2阳性HR阴性型)。2013.04.24—2013.07.19予以EC4疗程新辅助化疗,评价SD。NOAH研究[1]指出:曲妥珠单抗显著提高pCR率;新辅助曲妥珠单抗联合化疗显著改善EFS。2013.08.10—2013.10.12予以TH4疗程新辅助化疗,评价PR。可见对于HER2阳性复发晚期乳腺癌患者应用抗HER2新辅助治疗越早效果越好。2013.10.27行右乳腺癌改良根治术,术后诊断:右乳腺癌(ypT1N2M0,IIIA期)。病例评估未达pCR,目前《CSCO乳腺癌诊疗指南》2018V1版未推荐使用强化治疗,因此该患者术后予以胸壁放疗2Gy/25次/50Gy及曲妥珠单抗1年维持治疗。2016.02.08骨扫描提示:胸骨/髂骨多发高代谢影。DFS=33个月。根据CSCO指南推荐,予以一线治疗方案XH(卡培他滨+曲妥珠单抗)治疗PR后并维持,总评价PR。至2018年1月出现肝转移,PFS=19个月。研究显示[2],XH方案ORR为45%,中位PFS为6.7个月,而中位OS为28个月,该患者已获益。 2018.01.23患者患者出现肝转移。考虑诊断:右乳浸润性导管癌综合治疗后肝、骨转移(HER2阳性HR阴性型)。《CSCO乳腺癌诊疗指南》2018V1版、NCCN指南、《HER2阳性晚期乳腺癌的治疗策略》均提出曲妥珠单抗治疗进展后,持续抗 HER2 治疗能够带来生存获益。而针对一线使用H失败的患者,可选择TKI为基础的方案或者继续曲妥珠单抗为基础的治疗方案。EMILIA研究证实,相对于拉帕替尼联合卡培他滨,单药T-DM1治疗有显著的PFS和OS获益[3],因此该方案是国际上标准的抗HER2二线治疗方案,T-DM1目前尚未在国内上市,可以鼓励患者进入临床研究,以取得最佳生存获益。而对于无法耐受化疗的患者,EGF104900研究证实拉帕替尼单药联合曲妥珠单抗治疗也是可行的策略[4]。EGF104900研究指出:LH联合靶向治疗方案较L单靶向治疗方案延长了PFS (HR = 0.73; 95% CI, 0.57 ~ 0.93; P =0.008)以及CBR (HL联合组24.7% vs L单药组12.4%; P =0.01),以及观察到一个OS的延长趋势。目前国内上市的抗HER2靶向药物有曲妥珠单抗、吡咯替尼、拉帕替尼以及最近批准上市的帕妥珠单抗,结合多项研究结果,可予以不同抗HER2药物+化疗的联合使用有可能带来生存获益。2018.01.23至2018.11.10予以保肝治疗后,予H+L+nab-paclitaxel治疗6周期,评价PR,后予H+L维持治疗至2018年11月。PFS=10个月。2018.11.10发现颅内转移,诊断为右乳浸润性导管癌综合治疗后脑、肝、骨转移(HER2阳性HR阴性型)。2018年11月开始予以伽玛刀治疗。评价:脑内病灶PR。截至目前,经过系统治疗,患者已经获得了5年余的总生存时间,而疾病复发进展后,晚期乳腺癌治疗阶段也获得了2.7年的总生存时间,获益明显。目前疾病再次进展,未进行全身治疗,下一步治疗可根据患者ECOG PS评分情况,继续使用抗HER2+化疗。化疗药物可选择既往未曾使用过的长春瑞滨、吉西他滨、铂类等。抗HER2药物可选择二线治疗药物TDM-1或吡咯替尼或尝试多种不同机制抗HER2药物的联合使用。若不能耐受化疗,亦可单独使用靶向药物治疗。
该病例提示:对于HER2阳性乳腺癌患者应该强调抗HER2治疗重要性,在新辅助治疗阶段越早使用抗HER2药物治疗效果越好;而对于晚期HER2阳性乳腺癌患者而言,持续的抗HER2治疗是HER2阳性晚期乳腺癌治疗的关键;联合抗HER2治疗方案可获得生存的获益,H+L+化疗联合使用或许是晚期乳腺癌患者有效的治疗方案,期待未来的临床研究予以证实。
点评专家

复旦大学附属肿瘤医院
中国临床肿瘤学会(CSCO) 青年专家委员会副主任委员
中国研究型医院学会乳腺专业委员会常务委员
中国临床肿瘤学会乳腺癌专家委员会委员
中国抗癌协会肿瘤临床化疗专业委员会青年委员会委员
中国抗癌协会癌症康复与姑息治疗专业委员会青年委员
中国女医师协会临床肿瘤学专业委员会委员
中国女医师协会乳腺疾病研究中心委员
上海市抗癌协会癌症康复与姑息治疗专业委员会常委兼秘书长
上海市抗癌协会脑转移瘤专业委员会常务委员
上海市抗癌协会乳腺癌专业委员会委员
点评:
该病例是一个取得不错疗效的晚期HER2+乳腺癌病例。患者初始诊断为IIIA期,HER2+HR-型乳腺癌,予新辅助化疗EC-TH方案8周期,疗效评价为PR,后手术non-pCR,后放疗、曲妥珠单抗满1年。DFS32月后出现多发骨转移,使用曲妥珠单抗+卡培他滨+唑来膦酸治疗,PFS19个月出现了肝转移,重取活检仍然为HER2+HR-,后予曲妥珠单抗+拉帕替尼+白蛋白结合型紫杉醇6周期后改曲妥珠单抗+拉帕替尼维持,PFS10个月后出现脑M,行定向放射治疗后PR,拟下一步药物维持。
该患者新辅助治疗指征明确(HER2+、腋窝多个淋巴结肿大),根据2018V3版NCCN指南,HER2阳性患者的新辅助化疗首选方案推荐AC-TH,AC-TH+帕妥珠单抗或TH方案。考虑到药物可及性,CSCO指南也推荐TCbH或以TH为基础的化疗方案。该患者在随访心脏毒性的前提下选择EC-TH方案也未尝不可。手术后该患者病理non-pCR,辅助治疗可否强化?2018年SABCS最新发表的KATHERINE研究提示,在HER2+早期乳腺癌新辅助治疗未达pCR的患者中,使用T-DM1辅助治疗对比曲妥珠单抗可使患者的疾病复发或死亡风险降低50%以上,预期的3年iDFS率T-DM1组为88.3%,显著优于曲妥珠单抗组77%(P<0.001),且T-DM1的优势存在于无论HR状态、残余病灶大小及是否使用新辅助靶向联合治疗等各个亚组,尽管T-DM1组不良反应更多,但总体可耐受。因此,T-DM1可能使该患者获益。
该患者曲妥珠单抗停药后22个月出现多发骨转移,提示患者为曲妥珠单抗继发耐药的病人,对曲妥珠单抗相对敏感。根据NCCN、CSCO等指南推荐,晚期一线可选择曲妥珠单抗+帕妥珠单抗+紫衫类,考虑到药物可及性,曲妥珠单抗+单药化疗或拉帕替尼+卡培他滨都是可选的方案。该患者晚期一线治疗选择HX,疾病控制时间达19月,再次验证了该患者对曲妥珠单抗较敏感。出现肝转移后晚期二线治疗选择曲妥珠单抗+拉帕替尼+白蛋白结合型紫杉醇的方案。对于无法耐受化疗的患者,EGF104900研究证实拉帕替尼单药联合曲妥珠单抗治疗优于拉帕替尼单药,但是,目前曲妥珠单抗联合拉帕替尼的基础上再联合化疗的方案还缺乏循证医学的支持。若患者无法耐受化疗,可选择联合靶向维持治疗。患者出现脑转移后采用了立体定向放射治疗(SRS)治疗局部病灶。ASCO2018指南推荐对于HER2+脑转移的患者,可选择手术或SRS、WBRT等放射治疗,同时若其他部位病灶稳定,不应更换系统治疗。
1. Gianni L, Eiermann W, Semiglazov V,et al. Neoadjuvant and adjuvant trastuzumab in patients with HER2-positive locally advanced breast cancer (NOAH): follow-up of a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet Oncol,2014,15(6):640-7.
2. Schaller G, Fuchs I, Gonsch T,et al. Phase II study of capecitabine plus trastuzumab in human epidermal growth factor receptor 2 overexpressing metastatic breast cancer pretreated with anthracyclines or taxanes. J Clin Oncol,2007 ,25(22):3246-50.
3. Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med,2012 ,367(19):1783-91.
4. Blackwell KL, Burstein HJ, Storniolo AM,et al. Randomized study of Lapatinib alone or in combination with trastuzumab in women with ErbB2-positive, trastuzumab-refractory metastatic breast cancer. J Clin Oncol, 2010 ,28(7):1124-30.











 苏公网安备32059002004080号
苏公网安备32059002004080号


