近年来,嵌合抗原受体T细胞(CAR-T)疗法凭借出色的临床数据可谓是博足眼球,给研究人员带来了极大的振奋。随着有效性和安全性的提高,当前CAR-T细胞疗法的开发已逐渐步入正轨。但是,细胞因子释放综合征(CRS)和CAR-T相关性脑病综合征(神经毒性)等与CAR-T疗法相关的不良反应仍然是不可忽视的安全因素,具有显著的发病率,并且妨碍CAR-T疗法的广泛使用。据报道,严重CRS和脑水肿可引起治疗相关死亡。
细胞因子释放综合征(CRS)
CAR-T细胞疗法最常见的不良反应是CRS,背后的精确病理生理学仍有待确定。 CRS是由T细胞活化和随后细胞因子释放以及其他免疫细胞的募集和激活引起的一系列炎症症状。这些细胞因子包括白细胞介素(IL)-6、干扰素(IFN)-γ、IL-10和IL-2,并且可以由CAR-T直接产生或由其他细胞如单核细胞/巨噬细胞产生,以响应CAR-T产生的细胞因子。
最近的报道表明,宿主来源的单核细胞/巨噬细胞和CAR-T的相互作用在CRS病理生理学中起重要作用。在小鼠模型中,CAR-T通过CD40(树突状细胞/单核细胞/巨噬细胞)和CD40配体(T细胞)之间的直接细胞接触促进单核细胞的募集和增殖,后者又产生IL-1、IL-6、和一氧化氮(NO)。在用CD19 CAR-T处理的异种移植人白血病小鼠模型中,还证明了在CAR-T输注之前耗尽巨噬细胞促使CRS的消除。
无论是细胞因子驱动还是细胞接触介导的作用,进一步研究CAR-T与其他细胞之间的相互作用具有必要性。
临床表现
CRS通常表现为体征,其标志是发烧;然而,症状差异很大,可能影响任何器官系统,包括心血管、胃肠、肝、肾、呼吸、血液和神经系统。
CAR-T输注后发热的发作和高峰时间可指导CRS预防策略。例如,一项回顾性分析检查了133名接受了具有4-1BB共刺激结构域的CD19 CAR-T治疗的患者,发现4级CRS患者发热较早(CAR-T输注后中位天数为0.4,1-3级为3.9),发热峰值出现较快(CAR-T输注后2.8天,1-3级为5.7),最高温度较高(≥4级CRS在CAR-T输注36小时内温度≥38.9°C)。
此外,严重CRS患者的IL-6、IFN-γ、C-反应蛋白(CRP)和铁蛋白水平通常高于未经历严重CRS的患者,但是未证实这些标志物能够预测即将发生的毒性。对上述133名患者的生物标志物进行的评估显示,与经历≤3级CRS的患者相比,≥3级CRS的患者铁蛋白和CRP较高。此外,在CAR-T输注36小时内,≥4级CRS患者表现出较高浓度的IFN-γ、IL-6、IL-8、IL-10、IL-15、单核细胞趋化蛋白-1(MCP-1),肿瘤坏死因子受体p55(TNFRp55)和巨噬细胞炎症蛋白-1β(MIP-1β)。
严重的CRS也与较高的肿瘤负荷和CAR-T剂量相关。值得注意的是,还证明了CAR-T峰值扩展和曲线下面积与3级或更高级别的神经事件显著相关,而不是3级或更高级别的CRS。
然而,实时快速细胞因子水平测量目前尚不可行或广泛可用,必须使用可用的CRS替代指标。CRP已显示出与CRS进展的相关性,随着CRS的发作而增加,并且随着CRS解决返回基线。CRP是日常监测CRS的有效工具;然而,并非所有患者都检测到这种相关性,CRS的干预措施不应仅基于CRP。CRP升高并不总是充分地在CRS之前成为指导干预的可靠标记,因为CRP的升高似乎与 CRS临床症状同时发生。
CRS预测性生物标志物的验证仍然不完整,需要进行额外的确证研究。CRS管理的首要目标是防止危及生命的毒性。然而,阻断细胞因子释放的任何干预理论上都可以阻断CAR-T活性并损害抗肿瘤活性。目前的证据表明,在用托珠单抗和皮质类固醇治疗的患者中可以保持抗肿瘤活性。
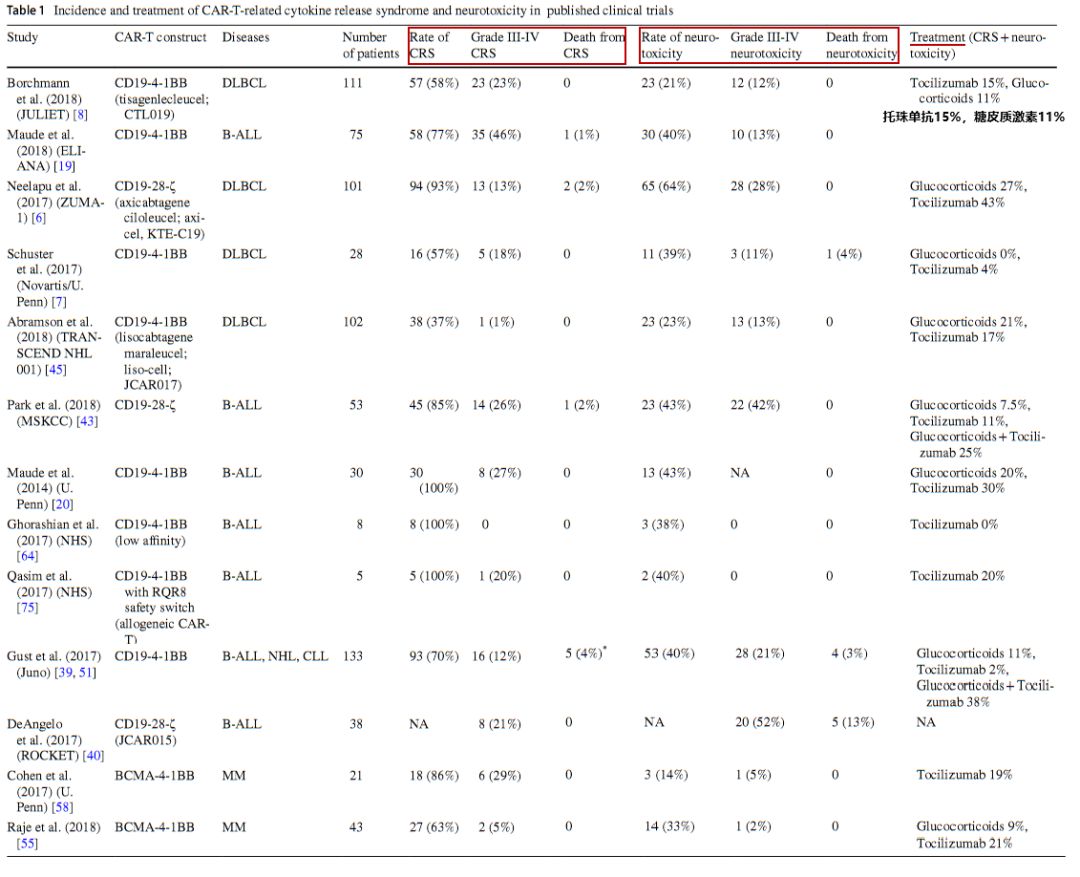
已发表的临床试验中CAR-T相关CRS和神经毒性的发生率和治疗(图片来源:Biodrug)
CRS分级
不良事件通用术语标准4.03版(CTCAE v4.03)用于评估许多CAR-T试验中的器官毒性。通常,与CRS相关的器官毒性按此标准分级,但CRS需要对整个综合征进行分级。CTCAE v4包含CRS的评分标准;然而,这不是为细胞疗法创造的,而是针对免疫疗法管理输液反应。该分级系统不足以用于CAR-T输注后数天发生的CRS症状。CAR-T治疗的单中心和关键试验使用了不同的标准,使得毒性严重程度的交叉比较很困难。
Lee等人创建了国家癌症研究所(NCI)共识标准,以确定与高风险免疫治疗相关的轻度、中度、重度和危及生命的CRS,并指导基于该评分的治疗建议。该分级系统用于ZUMA-1试验。值得注意的是,2017年11月发布的CTCAE 5.0版(CTCAE v5.0)修改了CRS的分级,与原来的Lee标准密切相关。
Neelapu及其同事(CARTOX集团)提出了对Lee评级系统的修改,以开发更一致的方法来监测、分级和管理成人患者的CAR-T相关毒性。CRS等级与Lee等人一致。
基于Porter等人创建的临床参数的替代分级系统用于ELIANA和JULIET试验。该分级量表最初创建并用于在宾夕法尼亚大学中接受CAR-T治疗的慢性淋巴细胞白血病(CLL)患者的CRS分类。
鉴于分级标准差异,PENN CRS评分量表可能导致3级和4级CRS评级的数量高于Lee等人的评级。为了统一CRS分级系统,美国血液和骨髓移植协会(ASBMT)正在开发用于CAR-T和相关疗法的免疫效应细胞CRS和神经毒性分级系统。


不同的CRS分级系统及其比较(图片来源:Biodrug)
CRS管理
CRS的临床表现和严重程度从轻度的体征到危及生命的严重毒性变化很大。通过准确、及时的评估和患者管理,可以避免不良后果。
CRS症状通常在CAR-T输注后2周内消退。该毒性可以是自限性的,仅需要对症治疗,或者可能需要用IL-6拮抗剂和/或糖皮质激素治疗。治疗CRS的目的是:避免有害毒性,同时最大化细胞疗法的抗肿瘤作用。
护理地点:对接受CAR-T治疗的患者住院治疗的需求尚未达成共识。
- ZUMA-1试验:所有患者均住院接受CAR-T输注,至之后至少7天;
- JULIET试验:26%的患者在门诊中接受了CAR-T输注,其中77%的患者在输注后仍然作为门诊患者≥3天;
- ELIANA试验:儿科和年轻成人患者也能够在门诊接受产品输注。
尽管这表明CAR-T疗法可以在控制良好的门诊患者中进行,但值得注意的是,这些治疗中心在CAR-T治疗方面具有丰富的经验,并且已经建立了良好的门诊造血干细胞移植计划。仍需进一步开发预测性生物标志物,以确定患有严重早期CRS风险的患者,以在严重症状出现之前进行密集监测和住院治疗。
支持性护理:患者需要从细胞输注后开始接受支持性护理措施,并贯穿在CRS的所有阶段。每日监测通常包括具有不同和完整代谢组的全血细胞计数。静脉输液用于维持水合作用;然而,由于体积超负荷和肺水肿的风险,流体平衡(包括每日体重)必须密切监测。由于存在心律失常的风险,从CAR-T细胞输注到CRS消退时应考虑遥测监测,特别是在患有其他心脏危险因素的患者中。
对于肝功能正常的患者,可以给予对乙酰氨基酚用于治疗发热;也可以使用冷却毯。非甾体抗炎药(NSAIDs)可作为替代药物;但是,在确定血小板减少症时必须谨慎。此外,NSAID可能导致出血、胃炎和肾功能不全。由于这些患者中有许多是中性粒细胞减少的,并且都接受过淋巴细胞清除,因此监测感染势在必行,包括血液和尿液培养以及胸片。还应开始使用广谱抗生素。
抗IL-6疗法:托珠单抗(Tocilizumab)是一种针对IL-6受体(IL-6R)的人源化单克隆抗体(mAb),去年8月被FDA批准用于CAR-T诱导的严重或危及生命的CRS。在大多数患者中施用托珠单抗后,已证实CRS的快速消退。
对于体重<30 kg的患者,托珠单抗以12 mg/kg的剂量输注60分钟;对于体重≥30kg的患者,输注8 mg/kg。FDA批准的给药策略包括如果CRS的体征和症状没有临床改善,最多可以给予三次额外剂量,连续给药至少相隔8小时。如果患者对治疗有反应且CRS症状不再发作,则可能无法进行额外的输注。虽然批准的适应症适用于严重或危及生命的CRS,但没有关于给药最佳时机的明确建议。
西妥昔单抗(Siltuximab, 嵌合型的IL-6 mAb)是另一种用于CRS标签外的药物,特别是在托珠单抗和类固醇难治性病例中。当用于不同的临床研究时,它可以快速逆转CRS症状。它以高亲和力直接与IL-6结合,因此与托珠单抗相比,具有更完全阻断IL-6活性的理论优势,其可阻断膜结合和可溶性IL-6R。
糖皮质激素:糖皮质激素具有抑制炎症反应的能力,但由于担心CAR-T疗效受到抑制,其仍然是对托珠单抗难治性CRS的二线治疗,除了极度快速发作的严重CRS病例外,不应用于其他非危及生命的适应症。
CAR-T相关神经毒性
神经毒性是与CAR-T疗法相关的第二常见毒性,典型表现的范围从轻微头痛到癫痫、严重脑病和死亡。最具特征性的表现是脑病,包括表达失语症和极端情况下的迟钝。早期迹象是语言和手写障碍,然后是混乱、激动、幻觉、震颤和头痛。在严重的神经毒性病例中可以看到癫痫发作、运动无力、无情、精神迟钝、颅内压增高、视乳头水肿和脑水肿[等级>2]。
神经毒性背后的精确潜在机制尚不完全清楚。由于大多数神经毒性先于CRS,因此一种假设认为,神经毒性是细胞因子在可渗透的BBB存在下被动扩散到大脑中的一种表现。CAR-T不太可能直接入侵中枢神经系统导致对神经细胞的毒性,因为大多数患者表现出完全的神经功能恢复。
由于CAR构建、CAR-T的输注剂量、淋巴清除化疗和适应症的差异,很难交叉比较不同临床试验中的神经毒性。目前大多数关于神经毒性的信息都是基于CD19 CAR-T产品,与非CD19 CAR-T疗法相关的CNS毒性尚未得到表征。还需要进一步改进共识神经毒性定义和分级量表,并且必须进行普遍适用于CAR-T临床试验的前瞻性验证。
神经毒性管理
CAR-T疗法相关的神经毒性管理由毒性分级指导,并且可以通过并发CRS的严重性来报告。
抗IL-6疗法和糖皮质激素:神经毒性可能在CRS之前、同时发生(大约第1-7天),和/或之后独立于CRS发生。神经毒性≥1级同时CRS≥2级的患者可以从抗IL-6疗法中受益。相反,独立于CRS发生的神经毒性不应用托珠单抗治疗,因为抗IL-6治疗不能穿过BBB并且与CAR-T相关性脑病的消退无关。对于无CRS的≥2级神经毒性患者,应考虑使用类固醇进行初始治疗而不是抗IL-6治疗。最佳剂量、持续时间和类固醇药物的选择仍有待标准化。
神经毒性治疗反应通常比对CRS症状的反应慢。到目前为止,已公布的不同CD19 CAR-T疗法的临床经验表明,抗IL-6疗法和类固醇的使用与CAR-T疗法的疗效之间可能没有相关性。
抗癫痫和支持治疗:通常,神经毒性/CRS高风险的患者在接受CAR-T治疗前30天口服或静脉注射左乙拉西坦750mg/12h以预防癫痫发作,特别是使用CD19与CD28 CAR-T和BCMA CAR-T疗法。
预防策略
CAR-T治疗相关毒性的预防策略,一方面可以通过CRS和神经毒性的预测性生物标志物来进行检测,通过密集的监测及时做出反应;另一方面是设计更加安全的CAR-T细胞疗法,而目前已经达成共识的策略是给CAR-T装上“安全开关”,在人为可控下进行治疗,且在不良反应发生前及时踩刹车。
给CAR-T装上“安全开关”
Bellicum
Bellicum公司基于其自主研发的GoCAR-T技术,使CAR-T细胞包含两个共刺激信号结构域活化开关。为了更好地控制CAR-T细胞的抗原激活,Bellicum将双协同刺激组件从抗原识别组件上分离,移至一个单独的分子开关上,该分子开关可以通过小分子药物Rimiducid控制。这样的设计保证了GoCAR-T细胞在抗原不存在的条件下存活、在抗原存在的条件下增殖,并且只有当肿瘤细胞和Rimiducid同时存在的情况下T细胞杀伤功能才会被激活。
12月中旬,该公司公布了其在研CAR-T产品BPX-601在晚期胰腺癌1/2期剂量递增研究中第1部分的初步结果。给药后7天,4名患者T细胞显著扩增3倍至20倍,3名患者T细胞存活时间超过3周,有2名患者肿瘤缩小率超过20%。BPX-601耐受性良好,在初始细胞剂量递增时未报告CRS或神经毒性。
Cellectis
法国Cellectis公司不仅拥有全球临床进展最快的通用CAR-T(UCART),还在打造新一代更安全的CAR结构。今年6月, Nature旗下的《Scientific Reports》期刊上公开报道了一款集合了抗癌效力、安全性“自杀开关”以及纯化和检测能力的一体化CAR架构— —CubiCAR技术,由Cellectis和辉瑞共同参与研发。
Autolus Therapeutics
Autolus Therapeutics的候选产品AUTO2是同时靶向BCMA和穿膜蛋白活化物或TACI的CAR-T细胞疗法,不仅如此,还携带了RQR8安全开关,允许用单次高剂量的利妥昔单抗(rituximab)消除T细胞。去年9月,Autolus宣布在其针对MM(多发性骨髓瘤)的首例双重靶向CAR-T细胞疗法已经完成了1/2期临床试验中的第一剂量队列研究。
Poseida Therapeutics
Poseida公司拥有专有的下一代非病毒基因工程技术piggyBac™转座子系统,其在研CAR-T疗法P-PSMA-101靶向前列腺特异性膜抗原(PSMA),并将传统的scFv结构替换成了全人源的Centyrin结构域,为产品加上了一个安全开关。
Ziopharm Oncology
Ziopharm是Intrexon公司和德克萨斯大学MD安德森癌症中心的全资子公司,正计划进行I期临床试验,以评估用睡美人(Sleeping Beauty, SB)技术制备的CAR-T细胞能否应用于复发或难治性CD19 +白血病和淋巴瘤患者。睡美人技术的设计原理是在T细胞上共同表达CD19特异性CAR、膜结合IL-15和一个安全开关,其产生的基因修饰的CAR和TCR可以靶向血液癌症中的特定抗原和实体瘤中的新生抗原。
Precigen
近日,Intrexon的全资子公司Precigen宣布FDA批准其多基因CAR-T细胞疗法PRGN-3006 UltraCAR-T的IND申请。PRGN-3006 UltraCAR-T利用睡美人技术平台共表达CAR、膜结合IL-15以及针对复发或难治性AML和更高风险MDS的控制开关。这一项人体1期临床剂量递增研究将评估PRGN-3006 UltraCAR-T的安全性和最大耐受剂量,将与Moffitt癌症中心合作进行。
不同研究中的CAR-T产品的副作用特征存在显著的异质性,因此需要前瞻性干预研究以制定毒性分级和管理的标准化指南。就目前而言,在不同的CAR-T产品中系统地研究托珠单抗和糖皮质激素在管理CRS和神经毒性中的最佳时间和剂量迫在眉睫。同时,下一代CAR-T细胞疗法迈向更安全、有效的2.0时代已经离我们不远。











 苏公网安备32059002004080号
苏公网安备32059002004080号


