2018年12月1-4日,第60届美国血液学年会(ASH)将于美国·圣地亚哥隆重召开。作为全球最顶级的血液学术会议之一,每年的ASH无疑是众咖齐聚、精彩纷呈。恶性淋巴瘤作为最常见的血液系统肿瘤之一,病理分型复杂,每种亚型具有不同的生物学行为、治疗方案及预后。近年来,淋巴瘤病理学、影像学研究及靶向研究进展迅速,在新的背景下,会刷新我们对淋巴瘤的传统认知。那么,本次ASH将公布哪些重磅研究呢?小编带您先睹为快!

80岁以上原发中枢神经系统弥漫大B细胞淋巴瘤:来自法国眼脑淋巴瘤(LOC)网络的110例患者分析
时间:2018年12月3日 PM 6:00-8:00
讲者:Alizee Maarek
类型:Oral and Poster Abstracts(627)
地点:Hall GH (San Diego Convention Center)
链接:https://ash.confex.com/ash/2018/webprogram/Paper117331.html
研究详情
在非选择人群中,原发中枢神经系统淋巴瘤(PCNSL)患者中位发病年龄约70岁。在美国一项大于65岁PCNSL患者的注册临床研究中,14%的患者年龄超过80岁。无论是临床表现,还是治疗管理、治疗毒性和预后,这些患者均有独特的特点。
我们回顾性分析了法国眼脑淋巴瘤(LOC)网络数据库中的80岁以上的PCNSL患者。从2011年1月开始,法国的22个专业中心前瞻性地记录了新诊断的PCNSL患者。本研究中,分析了年龄大于80岁且组织学确诊弥漫大B细胞淋巴瘤(DLBCL)的110例患者,回顾了所有患者的医学记录,包括临床和生物学特征、治疗手段和支持治疗、毒性和结局。
对于年龄大于80岁且诊断为原发中枢神经系统DLBCL的110例患者,其确诊时间跨度从2011年1月至2018年1月,患者数量占LOC数据库的8%。临床特征如下:63%为女性患者;中位年龄83岁(80-92岁);EORTC体力状态(PS)评分:24%患者为1分,21%为2分,55%为3-4分。23.6%患者CIRS-G评分3或4级(至少一个条目),40.9%患者CIRS-G累积评分大于6分。诊断手段中穿刺活检比例87%,肿瘤切除5%,玻璃体切除4%,脑脊液细胞学4%。在诊断时,可评估患者中9/69(13%)有眼部受侵,13/61(21%)脑脊液受侵,79/110(72%)脑深部结构受侵,35/86(41%)患者LDH升高。中位肌酐清除率70ml/min(24-102)。35%及65%患者的首次治疗分别由神经肿瘤科团队和血液科团队给予。自首次症状出现到延迟治疗的中位时间是60天。85例(77%)患者的一线治疗是高剂量甲氨蝶呤(HD-MTX)为基础的化学治疗,13例(12%)患者一线采用其它化疗方案,12例(11%)患者接受姑息治疗。中位化疗周期数3次(1-11),MTX中位剂量3.0g/m2(0.5 -5.0g/m2)。有趣的是,三组患者之间主要的临床和生物学特点分布没有差异(包括中位年龄、PS评分、症状、肿瘤位置、血清白蛋白水平、肌酐清除率)。53/98(54%)患者采用美罗华联合化疗。一线诱导化疗后,85例可评估患者的治疗反应如下:CR率37%,PR率9%,54%SD或PD。最后,27例患者(32%)在接受HD-MTX后给予高剂量阿糖胞苷(HD-AraC)巩固治疗。85例患者的351次MTX为基础的化疗输注中,3-4级毒性包括:任何事件46%,感染15%,血细胞减少13%,急性肾功能衰竭10.5%,转氨酶升高8%。13%患者因治疗毒性死亡。中位PFS和OS分别为3.9个月和7个月。与不含MTX方案和姑息治疗相比,HD-MTX为基础方案的PFS和OS明显延长(Figure 1A, 1B)。HD-MTX治疗的85例患者进行的单变量分析中,临床和生物学特点(包括中位年龄、PS评分、症状类型、CIRS-G、肿瘤位置、血清LDH水平、血清白蛋白水平、血红蛋白水平、淋巴细胞计数、肌酐清除率)均未能影响PFS和OS。初始的MTX剂量不会影响治疗结局,而静脉美罗华的一线使用明显改善了PFS和OS(Figure 1C, 1D).
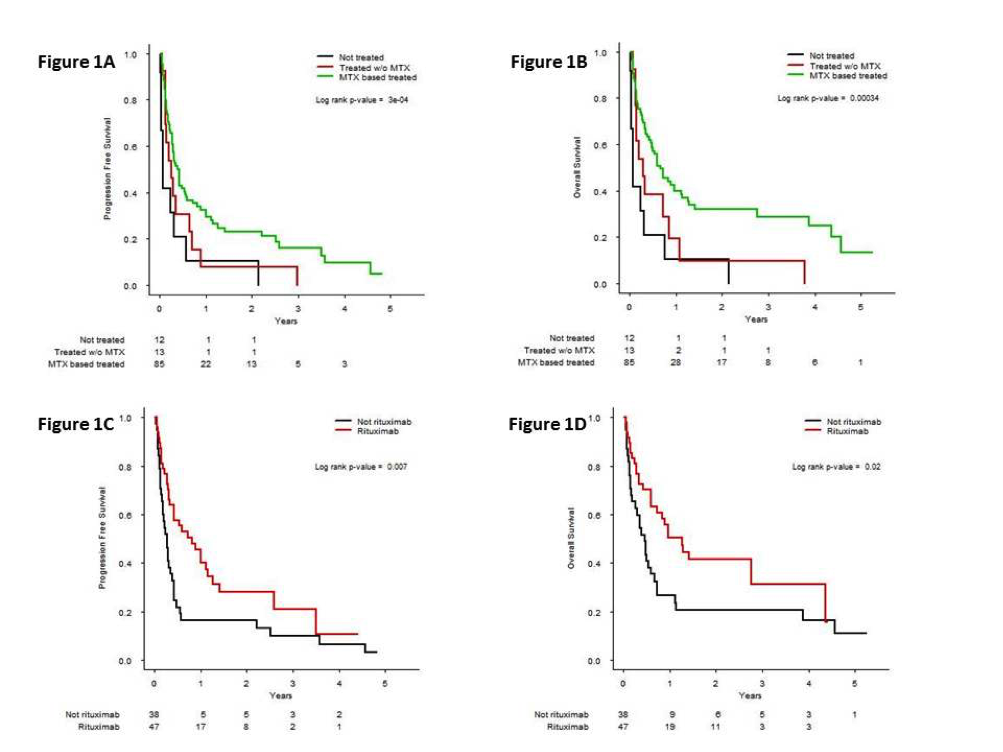
研究结论
据我们所知,这是国家数据库中关于年龄大于80岁PCNSL患者持续记录的最大系列样本。本研究显示,此类患者预后很差,传统治疗毒性明显。在本研究中未发现明确生存预测因素,但一线HD-MTX联合静脉美罗华可改善预后。此类患者需要发现新靶点和采取新的治疗措施以改善其预后。
18F-FDG PET-CT分期时代I-II期滤泡淋巴瘤的研究结果:一项来自澳大利亚淋巴瘤联盟的国际合作研究
时间:2018年12月3日 PM 6:00-8:00
讲者:AyalewTefferi
类型:Oral Abstract(578)
地点:Hall GH (San Diego Convention Center)
链接:https://ash.confex.com/ash/2018/webprogram/Paper114097.html
研究详情
I/II期滤泡淋巴瘤(ESFL)应用放疗具有潜在治愈可能。放疗能够成功控制>90%的病例,但超过半数的患者会在10年内发生放疗野外复发。最近一项随机对照试验(TROG 99.03)显示,在早期FL患者中,与单纯放疗相比,联合治疗(序贯放疗和全身化疗)能够显著改善PFS,但OS未得到改善。然而,入组患者中仅半数应用PET/CT分期,并且应用联合治疗的患者中有58%未应用利妥昔单抗。同时与CT分期相比,应用PET-CT检查后20%-60%的病例分期上调。这就限制了这项研究结果在现代人群中的应用。
尽管目前的指南支持,临床实践中仍仅有1/3患者接受放疗。在PET-CT时代,这就要求更好地理解其他治疗方法的地位,包括观察等待。我们的目的是比较在真实世界里不同治疗方法在严格分期为局限期FL中的效果。
我们进行了一项国际多中心回顾性研究,研究对象为经骨髓活检和PET-CT检查确认为I/II期FL。患者入组条件为:>18岁,新诊断1-3A级FL;随访≥3个月。主要观察指标是客观缓解率(ORR)、疾病无进展生存期(PFS)、总生存期(OS)及转化危险因素。生存曲线采用Kaplan-Meier法估计,单因素和多因素分析采用Cox回归模型。
该研究共纳入了2005-2017期间就诊患者共387例,这些患者在13个澳大利亚和3个加拿大中心就诊。中位随访时间45个月(3.1-164.0),5年PFS和OS分别为73.5%(95% CI 66.0-78.5)和94.4%(95% CI 89.4-93.6)。22例IE期十二指肠FL5年PFS和OS均为100%,这些病例未纳入后续分析。
365例患者的治疗方法包括:观察等待(定义为自诊断6月内未行治疗)占23.2%,放疗占46.8%,免疫化疗占17.2%,联合治疗占12.6%。治疗方案如下:R-CHOP (48.1%), R-CVP (24.4%), BR (9.9%), 其他(17.6%)。对于积极治疗的患者,一线治疗产生了类似的客观缓解率:放疗95.6%、免疫化疗96.7%、联合治疗95.9% (P=0.94)。总体而言,18.2%的患者出现远处复发,88.2%的患者复发。
各治疗组具有不同的临床特征。观察等待组患者年龄明显较大(P=0.007),但在其他方面与积极治疗组患者相当。与化疗或联合治疗组患者相比,放疗组患者具有更有利的特征:较少的B症状(4.2% vs 11.2%,p=0.029), 大肿块 (≥7cm) (6.8% vs 25.3%,p<0.001), 受累淋巴结区 (≥3) (1.9% vs 9.5%,p=0.005) ,I期患者比例更高 (73.1% vs 42.1%,p<0.001)。
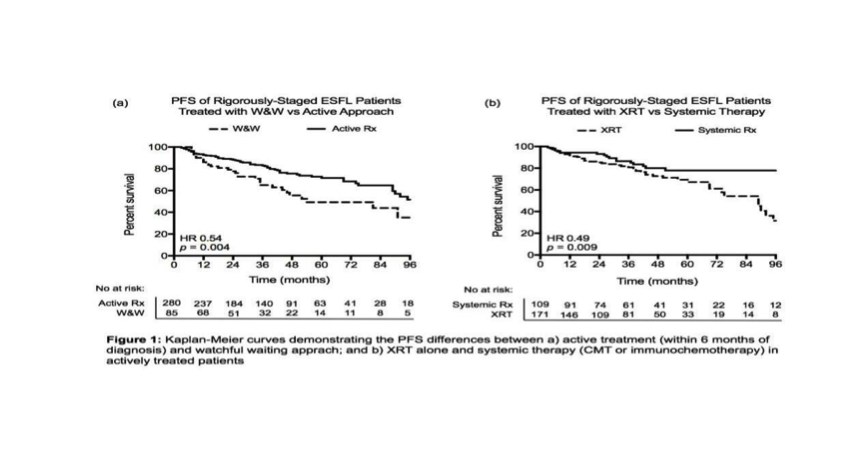
不同治疗方法疗效不同。积极治疗组PFS优于观察等待组(HR 0.54,p=0.004),然而, 49.4%的观察等待组患者5年后仍未治疗 (Fig 1a)。经单因素分析,对积极治疗的患者来说,免疫化疗或联合治疗组PFS优于放疗组(HR 0.49, p=0.009) (Fig 1b)。经对大肿块、B症状、受累淋巴结区数和分期多因素调整分析后,这种相关性仍然存在(HR 0.41,p=0.002)。免疫治疗组和联合治疗组具有相似的疾病PFS(p=0.2)。全身化疗结束后,应用利妥昔单抗维持的患者PFS优于观察组(HR 0.24,p=0.017)。各治疗组间OS无差别(p=0.734)。放疗组与全身治疗组相比,放疗组患者具有更高的病理转化率(6.4% vs 1.6%,p=0.046)。
研究结论
在PET-CT时代,这是对严格分期为局限期FL患者的最大规模的评估。虽然治疗方案并非随机,全身治疗组(化疗或联合治疗)PFS优于放疗组,同时具有更低的病理转化率。这些发现与临床试验TROG 99.03类似,对局限期滤泡淋巴瘤仅行单一放疗的治疗策略提出挑战。观察与等待组患者经5年随访观察仍未行治疗,这提示观察与等待对特定的患者是合适的。
新型SYK/JAK抑制剂cerdulatinib 在复发/难治的外周T细胞淋巴瘤和皮肤T细胞淋巴瘤的2a期研究中显示出了良好的耐受性和临床反应
时间:2018年12月3日 PM 7:15
讲者:Steven M. Horwitz, MD
类型:Oral and Poster Abstracts(624)
地点:Hall GH (San Diego Convention Center)
链接:https://ash.confex.com/ash/2018/webprogram/Paper119944.html
研究详情
临床前试验数据显示,SYK和JAK信号通路在外周T细胞淋巴瘤(PTCL)和皮肤性T细胞淋巴瘤(CTCL)中作为致癌因子发挥作用。一项已发表的研究显示,17%的PTCL发生了SYK- ITK融合蛋白,SYK的激酶域构成性活化。这种融合蛋白在小鼠T细胞中转基因表达,导致一种致命的T细胞增殖疾病,而它在B细胞中的表达并不导致克隆扩增。在PTCL中常见的是SYK野生型。此外,基因表达分析显示JAK/STAT信号通路在PTCL中通过频繁的激活AK1,JAK3或STAT5b共同的γ链发挥作用。
蕈样霉菌病是CTCL最常见的变种,SYK在蕈样霉菌病(MF)中也有表达。而且,CTCL患者的恶性T细胞克隆可分泌大量Th2细胞因子(IL3、IL4、IL5、IL6、IL10和IL13),并显示出IL2受体信号通路的异常。这些细胞因子主要经JAK/STAT通路作用,促进T细胞增殖和存活,是瘙痒的潜在介质。总的来说,数据表明,SYK和JAK的双重抑制可能扰乱了PTCL和CTCL患者的多种独立的存活机制。
Cerdulatinib是SYK和JAK家族的一个小分子的可逆ATP竞争性抑制剂。在一项针对B细胞恶性肿瘤患者的1期研究中,给出的2期推荐剂量具有良好的安全性,并对临床实践提供了初步证据。随后,开展了针对特定疾病的2a期扩展队列研究。PTCL和CTCL中扩增队列的结果如下所述。
选择至少接受1次以上全身治疗后的复发/难治性PTCL或CTCL患者,口服cerdulatinib 30mg 2/日。这些扩增队列分为两个阶段:第一阶段为初始治疗组20例患者,如果有大于3例患者对治疗有反应,第二阶段队列扩大到40例患者。PTCL和CTCL试验队列均已完成第一阶段。主要终点是客观反应率,PTCL组参照Lugano标准,CTCL组参照全球评估标准。入组的患者,直到病情进展、无法耐受或达可以行干细胞移植(SCT)为治疗终止。所有患者均接受抗菌药物预防性治疗。
截至7月26日,38例PTCL患者和22例CTCL患者已接受cerdulatinib治疗。患者特征:中位年龄:PTCL: 65(34-84)岁,CTCL: 63(24-39)岁;中位系统治疗:PTCL: 3 (1-10),CTCL: 3 (1-12);21%的PTCL患者和5%的CTCL患者可行SCT;出现耐药:PTCL: 53%,CTCL: 50%。在PTCL队列中:26例患者对治疗有反应,12例患者尚未达到首次评估。ORR是35%(9/26),CR 31%(8/26)。7例对治疗有反应的患者持续用药3-12个月,1例患者在达到CR后进入异体SCT, 1例患者在15个月后进展。在AITL、PTCL-NOS和gamma-delta TCL患者中治疗均有反应。在CTCL队列中:10例患者对治疗有反应达到治疗评估标准,12个尚未评估。ORR 50% (5/10) ,CR 10% (1/10)。所有对治疗有反应的患者和2例稳定的患者仍在接受药物治疗中。在MF和Sezary综合征的患者中也有治疗反应。瘙痒症患者中也得到明显改善。
在所有患者中,最常见的AEs是腹泻(30%)、脂肪酶增高(20%)、淀粉酶升高(18%)、恶心(13%)和中性粒细胞减少(12%)。大于3例患者发生大于3级AEs :脂肪酶增加(n=9),中性粒细胞减少(n=6),淀粉酶增加(n=6)。在没有发生胰腺炎的情况下,淀粉酶和脂肪酶增加的患者,通过减量或停药可恢复正常。
研究结论
正在进行的2期扩增队列研究显示,cerdulatinib在PTCL和CTCL中均表现出良好的耐受性和足够的活性,可进入第二阶段研究。在PTCL和CTCL亚型中也显示出了完整、持久、显著的疗效。相关研究旨在确定有效的预测因子。这项2a期研究将为T细胞淋巴瘤相关试验的设计提供重要依据。
一线应用阿托珠单抗联合伊布替尼治疗滤泡性淋巴瘤:德国低度恶性淋巴瘤研究组(GLSG)的一项替代研究
时间:2018年12月2日 PM 5:15
讲者:Christian Schmidt
类型:Oral and Poster Abstracts(623)
地点:Hall AB(San Diego Convention Center)
链接:https://ash.confex.com/ash/2018/webprogram/Paper111692.html
研究详情
滤泡性淋巴瘤(FL)临床进展缓慢,初期治疗效果良好,但仍会反复复发。中位生存期为10-15年以上。需治疗患者的标准治疗包括抗CD20抗体联合化疗以及后续抗CD20抗体维持治疗。在GLSG-2000试验中(Hiddemn等,BLood 2005),其1年PFS为93%。由于化疗存在感染、继发恶性肿瘤和干细胞储备功能受损等较严重的副作用,新的“非化疗”治疗方法可大大提高FL患者的耐受性。BTK抑制剂伊布替尼在iNHL、CLL和MCL患者中具有良好的效果。鉴于最近关于阿托珠单抗在GALLIUM试验中优于利妥昔单抗的报道(Marcus等,NEJM 2017),GLSG启动了一项伊布替尼联合阿托珠单抗二期临床试验,以探讨这种“非化疗”替代方案的有效性和安全性。
这项替代研究为前瞻性多中心II期研究,在98例既往未经治疗且肿瘤负荷高(改良GELF标准)需要治疗的FL患者中,联合使用阿托珠单抗和伊布替尼。诱导期治疗:阿托珠单抗应用6周期(第1周期:阿托珠单抗1000mg 静脉用药 d1、8、15;第2-6周期:阿托珠单抗1000mg 静脉用药 d1,每21天为一周期),同时口服伊布替尼560mg 1次/日。诱导治疗结束后疗效达PR(Cheson Response Criteria 2007)的患者,继续使用阿托珠单抗(1000mg 静点,q8w)联合伊布替尼(560mg po qd)维持治疗24个月。在30个月残留MRD的患者中,继续口服伊布替尼12个月。主要研究终点为1年后PFS。次要研究终点为诱导结束时、1年后和维持结束后的有效率、应答持续时间、诱导和维持过程中的进展百分比、TTF、OS,MRD阴性患者的分子缓解时间和安全性。
该研究共纳入了98例进展期FL患者,中位年龄59岁(29-81岁),男60%,高危FLIPI评分患者40%,III/IV期90%,高肿瘤负荷II期患者10%。
诱导有效率90%(87/97),PR 85%(82/97),CR 5%(5/97)。诱导期进展5例(5%)。诱导治疗结束后82例患者达PR,其中的8例患者在维持治疗的前6个月内达CR。可评价1年PFS(主要终点)的共95例患者,其中76例(80%)在当时仍存活且无进展。第一年进展18例,其中2例因进展死亡,另有1例死于非淋巴瘤相关事件。65例患者发现MRD标记物。在诱导结束时对63例患者的MRD进行了评价,MRD阴性44例(70%)。登记1年后,35(83%)例患者MRD呈阴性。
治疗具有良好耐受性。最常见的不良反应分别为腹泻30%,皮疹25%,疲劳和鼻咽炎(普通感冒)分别为23%和20%。在血液学毒性中,3-4级中性粒细胞减少为8%、血小板减少为4%。严重(≥3级)感染性并发症少见(6%肺炎/支气管炎,2%脓毒症,7%其他感染)。
研究结论
阿托珠单抗联合伊布替尼治疗具有较高的抗淋巴瘤活性,总反应率(ORR)和1年MRD转阴率高。虽然联合使用阿托珠单抗和伊布替尼具有低毒性,但在主要研究终点(1年PFS)方面,不如既往报道的常规免疫化疗疗效。
进一步研究需要阐明是否存在更加获益于这种低毒方案的临床亚组。
撰稿组员:河北大学附属医院肿瘤内科淋巴瘤专业组(臧爱民,贾友超,韩贵良,焦婷,王坤杰)
号外!号外!!号外!!!2018 ASH征稿啦!如果你在2018 ASH现场,如果你发现了重磅研究,如果你擅长文字撰写……欢迎给【良医汇-肿瘤资讯】投稿!投稿邮箱oncologynews@163.com,肿瘤资讯小编-Amiee期待您的来稿!












 苏公网安备32059002004080号
苏公网安备32059002004080号


