2018 ASCO最重要的一个研究,就是通过21基因检测来指导乳腺癌患者的化疗。乳腺癌作为最早开始依据靶点区分病人类型和药物选择的肿瘤,尽管其靶向药物的数量没有像肺癌那样突飞猛进。但是依据biomarker选择化疗药物,这些年来还是取得了不俗的进展。
虽然近20年来,无论是在乳腺癌筛查还是治疗方面都已经取得了长足的发展,但乳腺癌依然是全球范围内导致女性死亡的头号杀手。大约有30%的早期乳腺癌患者最终会复发,而晚期乳腺癌的5年生存率也只有25%左右。
对于晚期乳腺癌患者来说,治疗的主要目标依然是姑息治疗,目的是为了控制症状,改善生活质量并延长生存。诚然,乳腺癌是最早应用biomarker指导治疗的肿瘤之一。上世纪90年代,FDA就批准靶向作用于表皮生长因子受体家族HER2的曲妥珠单抗用于HER2阳性乳腺癌患者;但无论患者的HER2状态如何,化疗依然是晚期乳腺癌治疗的基石,那么化疗能否通过biomarker甚至基因检测来精准地指导不同的治疗方案?答案一定是肯定的。
无论是联合还是单药治疗,紫杉类药物一直被认为是在治疗晚期乳腺癌最有效的细胞毒药物之一。但是紫杉醇水溶性差,导致它需要氢化蓖麻油作为溶剂,因此它在使用前需要通过预处理来有效降低过敏反应发生率。因为这一点的局限性,白蛋白紫杉醇作为新一代的化疗药物孕育而生。白蛋白紫杉醇采用纳米技术,将疏水性紫杉醇药物结合于人血白蛋白形成直径为130nm的颗粒,利用白蛋白天然的独特转运机制,使得紫杉醇更多分布于肿瘤组织,从而达到更高的肿瘤细胞内药物浓度,这也从根本上解决了紫杉醇的过敏反应问题。
但是,白蛋白紫杉醇是不是真的如其设计的那样可以靶向肿瘤细胞,从而相比紫杉醇更加高效低毒呢? 这就是CALGB 40502这个研究要回答的问题之一。
CALGB 40502/NCCTG N063研究是一项随机三期临床研究,比较紫杉醇、伊沙匹隆、或者白蛋白紫杉醇联合贝伐珠单抗一线治疗局部复发或转移性乳腺癌的疗效和安全性1。
该研究于2008年10月至2011年11月共入组了799例患者,其中72%的患者 (n=573) 为激素受体阳性 (HR+) ,25% (n=201) 是三阴性乳腺癌 (TNBC) 患者,另有2%的患者 (n=20) 为HER2阳性。
入组患者随机被分入3个治疗组:紫杉醇组 (90mg/m2, 每周1次) 、白蛋白紫杉醇组 (150mg/m2, 每周1次) 和伊沙匹隆组 (16mg/m2, 每周1次) ,给药3周停药1周。3组均加用贝伐珠单抗 (每2周1次) (贝伐珠单抗在2011年3月之后在方案中更改为可选)。患者在治疗6个周期之后若疾病缓解或稳定,可以停止化疗但继续贝伐珠单抗单药维持治疗。
在第一次中期分析时,因为伊沙匹隆的疗效超过了无效假设的下限,所以数据安全委员会在2011年7月建议停止伊沙匹隆那一组的入组。
从CALGB 40502研究结果看,白蛋白紫杉醇并未在疗效上超越紫杉醇。
紫杉醇组的中位无进展生存期(PFS)为11个月。事后分析表明,白蛋白紫杉醇组的中位PFS也有劣于紫杉醇的趋势,为9.2个月,但P值未达到统计学显著差异(HR=1.20,95%CI 1.00-1.45,p=0.054)。
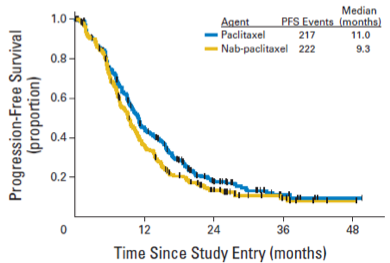
在中位随访5.5年之后,紫杉醇组和白蛋白紫杉醇组的中位OS时间分别为27.1个月和24.2个月。有趣的是,作者在多因素模型中发现,激素受体状态是紫杉醇vs.白蛋白结合性紫杉醇疗效的影响因子,交互检验p值有显著性差异。
因此作者对三阴性乳腺癌亚组和激素受体阳性亚组的患者分别做了回顾性分析。
对于三阴性乳腺癌患者,紫杉醇和白蛋白紫杉醇治疗的PFS和OS分别为:6.4 vs. 7.4m,15.3 vs. 21m,交互检验p=0.0018。而对于激素受体阳性亚组患者,紫杉醇治疗的PFS和OS分别为12.1个月和33.2个月,明显高于白蛋白紫杉醇组的9.6个月和26.6个月(交互检验p=0.0073)2。
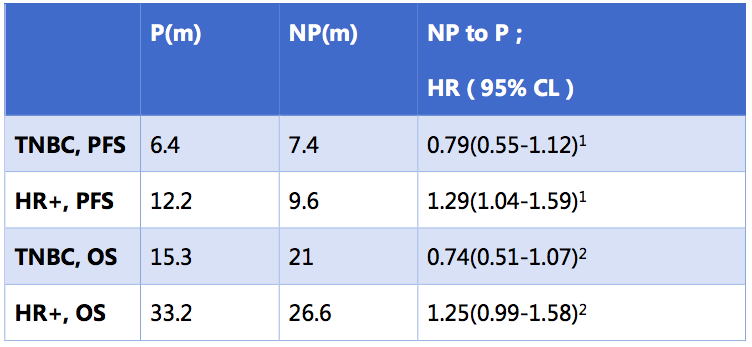
交互检验: 1. p=0.0018; 2. p=0.0073;
P:紫杉醇;NP:白蛋白紫杉醇;
而毒性方面,与紫杉醇组相比,白蛋白紫杉醇组的血液学毒性和非血液学毒性更高。
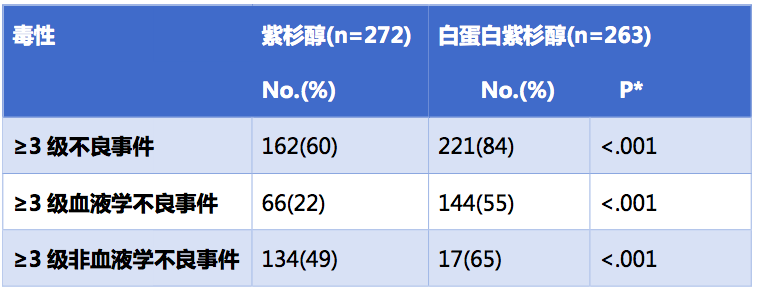
*Fisher检验对比紫杉醇组
由于不良事件而导致的终止治疗和剂量调整,白蛋白紫杉醇组的发生率也明显高于紫杉醇组。
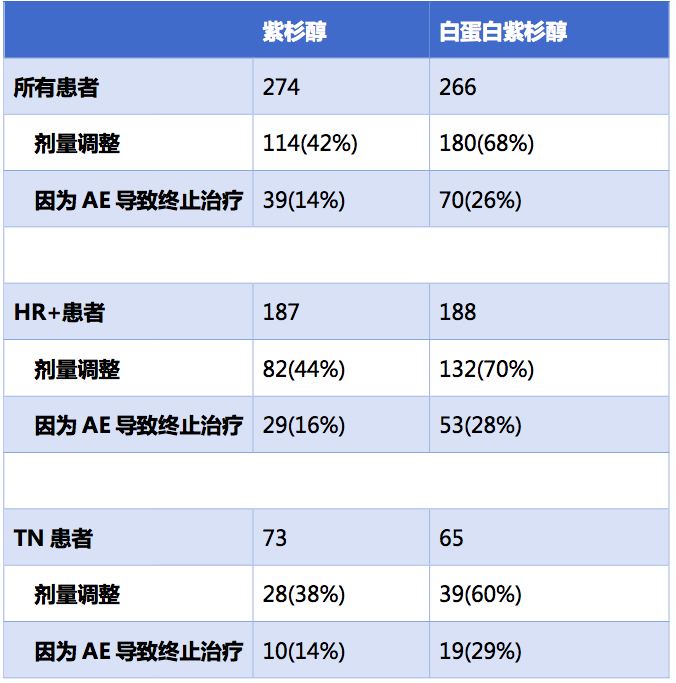
因此该研究的结果表明,对于化疗初治的晚期乳腺癌患者,紫杉醇每周方案依然是优选的治疗方案。回顾性亚组分析提示,对于激素受体阳性的患者,相比白蛋白紫杉醇,紫杉醇的治疗效果更好,可显著延长PFS和OS。仅在三阴性乳腺癌亚组,白蛋白紫杉醇相比紫杉醇存在延长PFS和OS的可能性。
虽说亚组分析的结果仍需要得到更多前瞻性研究的确认,但是同为紫杉类药物,紫杉醇和白蛋白紫杉醇在不同乳腺癌亚组中的疗效差异的原因值得思考,如果我们仔细研究激素受体阳性乳腺癌的生理特点以及白蛋白紫杉醇的作用机制,也许能够尝试做出解释。
白蛋白紫杉醇依赖gp60-CAV-1-SPARC完成转运
白蛋白紫杉醇以人血白蛋白作为药物载体,利用细胞膜上的白蛋白受体gp60及细胞膜窖蛋白(Caveolae)、肿瘤组织中富含半胱氨酸的酸性分泌性蛋白(SPARC)的作用,促进药物进入肿瘤细胞内,将更多的药物聚集在肿瘤部位,提高肿瘤间质中的紫杉醇浓度,进而提高抗肿瘤活性。
Caveolin-1 (Cav-1)是 Caveolae (胞膜窖)的主要结构成分和标志性结构蛋白,广泛存在于终末分化的组织中。在胆固醇转运、细胞膜组装和信号转导等方面起着重要的生理作用,同时也负责调控乳腺上皮细胞的转化。
研究发现,在正常乳腺导管上皮细胞中 Cav-1 具有较高的表达,而在乳腺癌组织及转化的乳腺上皮细胞系(如 MT-1,MCF-7,ZR-75-1 等)中不表达或低表达。Elsheikn发现乳腺癌中CAV1和CAV2的表达分别为13.4%和5.9%,其表达与高组织学分级、HR受体(ER和PR)缺失以及基底标记物表达(基底细胞角蛋白、P63、P-钙黏蛋白)密切相关3。
正因为白蛋白紫杉醇是通过白蛋白载体与gp60受体结合,激活Cav-1形成的囊泡穿过肿瘤血管内皮细胞,之后与SPARC结合进入肿瘤细胞,使紫杉醇在肿瘤组织中累积并诱导肿瘤细胞凋亡。而在激素受体阳性乳腺癌中,Cav-1表达很低,从而可能会影响白蛋白紫杉醇的转运,这可能是可以解释白蛋白紫杉醇在该人群中疗效差强人意的原因之一。
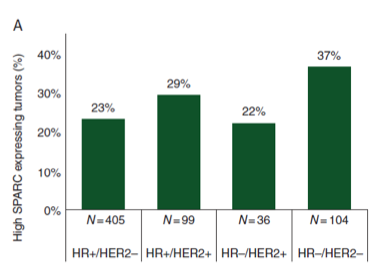
同样,SPARC的表达以及它和白蛋白之间的相互作用可能也是影响白蛋白紫杉醇疗效的分子标记之一。在新辅助GeparTrio研究中发现,SPARC表达与HR状态和乳腺癌分子亚型密切相关。与激素受体阳性(HR+/HER2- 23%)和HER2阳性亚型(HR+/HER2+ 29%; HR−/HER2+ 22%)相比,SPARC在三阴性乳腺癌中表达更高(37%)4。因此激素受体阳性乳腺癌因SPARC表达水平低,也是可能影响白蛋白紫杉醇转运继而影响其疗效的原因之一。
随着对于药物作用机制与乳腺癌生物学特性的深入认识,其实化疗也正步入精准治疗的理念和应用。CALGB 40502研究告诉我们,对于既往未接受过化疗的局部复发或转移性乳腺癌女性患者,白蛋白紫杉醇和伊沙匹隆这两种较新且昂贵的乳腺癌治疗药物的有效性和安全性并未超越1992年获批的经典药物紫杉醇。而对于激素受体阳性乳腺癌和三阴性乳腺癌,因其不同的生理特点以及白蛋白转运通路相关蛋白的表达水平的差异,同为紫杉类药物,白蛋白紫杉醇和紫杉醇的疗效差异很大。
在精准医学时代,化疗方案的选择依然可以做到精确订制,激素受体这个在乳腺癌治疗中最早被应用的biomarker,不断地在体现着其新的诊断价值。因此对于转移性乳腺癌,我们需要重视分析病人肿瘤的分子特征,再充分考虑疗效、安全性以及性价比,包括患者的意愿,个体化选择治疗方案,这样才能使现有治疗手段的临床效益最大化。
1. Rugo HS et al, J Clin Oncol. 2015 Jul 20;33(21):2361-9
2. Rugo HS et al, SABCS 2017, GS3_06
3. Elsheikh SE et al, Br J Cancer. 2008 Jul 22;99(2):327-34.
4. Lindner JL et al, Ann Oncol. 2015 Jan;26(1):95-100.











 苏公网安备32059002004080号
苏公网安备32059002004080号


