欧洲血液学协会(EHA)成立于1992年,是全球血液学领域规模最大的国际会议之一。2018年6月14日-6月17日,第23届EHA将于瑞典-斯德哥尔摩举行。本次EHA会议将报道“淋巴瘤联合治疗”相关的诸多研究进展,【肿瘤资讯】特别汇总了这一领域的重磅EHA摘要,让您先睹为快!

I/II期临床研究:ATEZOLIZUMAB联合R-CHOP在晚期初治DLBCL中CR率高达87%(Abstract: S803)
背景
利妥昔单抗(R)联合CHOP(R-CHOP)是DLBCL一线标准治疗。虽然多数患者可获得长期获益,但约40%的患者疗效欠佳或出现复发。Atezolizumab(atezo)是一种PD-L1抗体,具有与R互补的作用机制。该I/II期研究(NCT02596971)旨在评估atezo联合R-CHOP在初治的DLBCL中的疗效及安全性。
方法
研究对象为初治的晚期DLBCL(Ann Arbor III / IV期或II期伴有巨大肿块[至少1个病变≥7cm],国际预后指数[IPI]评分≥2,年龄≥18岁,ECOG PS 0-2)。给予R-CHOP联合atezo诱导治疗,具体给药方法:R 375mg/m2 ,第1-8周期D1;atezo 1200mg,第2-8周期D1;CHOP共6-8周期。诱导结束(EOI)达到CR的患者在第9-25周期Atezo 1200 mg 的巩固治疗,21天为一个周期,共持续12个月。主要终点是安全性和疗效,由独立评审委员会(IRC)根据Lugano2014标准计算的EOI CR率。次要终点包括研究者(INV)根据Lugano2014标准计算的EOI CR率和INV+IRC根据Cheson2007评效标准计算的EOI CR率。数据截止日期为2017年11月20日。
结果
该研究共纳入42例患者并接受治疗(安全性队列)。截至数据截止时,20例患者仍在进行诱导治疗,5例已停药。17例已完成诱导治疗,其中14例已进入巩固治疗阶段。诱导治疗的中位数观察时间为5.3(0.7-7.2)个月,巩固治疗仅1.6(0.7-5.1)个月。因此,本次报告仅对诱导治疗的初步数据进行分析。在15例完成EOI疗效评估的患者中,根据Lugano 2014,IRC和INV判定13例(87%)CR,2例(13%)PR。根据Cheson 2007标准,INV和IRC判定,11例(73%)CR,2例(13%)PR和2例(13%)PD。诱导治疗的初步安全性数据显示,所有患者均出现≥1级AE,27/42(64%)的患者出现3-4级 AE。最常见的3-4级AEs为中性粒细胞减少和粒缺性发热。13例出现严重AE,8例因Aes而减量,3例退出试验。3例出现atezo相关的AE(为3级脂肪酶、转氨酶增加)。
结论
数据表明,一线R-CHOP联合atezo在初治的DLBCL患者中显示出令人鼓舞的疗效和可接受的毒性。
1+1>2!苯达莫司汀联合NIVOLUMAB在既往NIVO治疗失败的复发/难治HL中有效(Abstract: PS1174)
背景
在ASCT和brentuximab vedotin(BV)治疗失败的复发/难治霍奇金淋巴瘤(r/r HL)中免疫检查点抑制剂治疗可能带来高反应率。但仍有部分患者无法从中获得客观反应,或达到客观反应却出现临床症状的加重。有研究者认为化疗药物引起的淋巴细胞清除和肿瘤微环境变化可能增强免疫检查点阻滞效果。 苯达莫司汀(benda)是一种双功能烷化剂,与BV联合给药在r/r HL患者中展现出一定疗效。
目的
本研究探讨了nivolumab(nivo)单药治疗失败的r/r HL中nivo+benda的疗效。
方法
该研究共纳入30例患者,其中20例男性,10例女性。给药方法为:benda 90mg/m2,D1-2,nivo 3mg/kg,D1,14;28天为一个周期,共给药3周期。3周期后通过全身PET-CT扫描进行疗效评估。
结果
中位年龄30岁(21-60),既往治疗中位数为6(线)(范围3-11)。所有患者均接受nivolumab治疗,中位次数为18(8-27)。20例(67%)因疾病进展开始联合治疗,10例因 nivolumab单药治疗期间疗效不显著开始联合治疗。中位随访时间为9个月。安全性分析显示,共27(90%)例出现药物相关不良事件(AE),最常见的为疲劳、恶心和发热;6例(23%)例出现3-4级不良事件,包括肺炎、葡萄膜炎、结肠炎和严重输液反应,1例因AE中止治疗。疗效方面,根据LYRIC标准,26例(86%)观察到客观反应,16例(52%)出现完全代谢缓解,1例稳定,1例进展,2例不确定反应。在达到CR的患者中,10例(63%)既往接受含benda方案并且失败,9例(56%)既往接受BV治疗并且失败,4例既往接受异基因移植。中位观察时间9个月,29例(97%)患者存活,22例(73%)无疾病进展。1例由于移植并发症死亡。
结论
研究结果表明,虽然观察到不良事件发生率升高,但该方案的毒副反应目前看来是可控的,而benda+nivo的联合治疗可能是r/r HL患者的有效挽救治疗。对于Benda和nivo治疗失败的患者,两药联用可能发生协同效应,该结论有待于扩大患者样本量、延长随访时间以进一步确证。
毫不逊色:NIVOLUMAB联合BRENTUXIMAB VEDOTINNIVO在NIVO单药治疗失败的复发/难治HL中CR率达70%(Abstract: PF431)
背景
目前霍奇金淋巴瘤(HL)一线接受化疗,约60%-80%的患者可获得持续缓解。在复发/难治霍奇金淋巴瘤中(r/r HL),大剂量化疗继之以自体造血干细胞移植(auto-HSCT)可带来50%的客观反应率,但一些患者仍有抗药性。Brentuximab vedotin(BV)是auto-HSCT后用于HL复发的高效药物,PD-1单抗nivolumab(nivo)在auto-HSCT和BV后的r/r HL患者中表现出显着的活性。有数据表明,nivolumab和BV可能具有协同作用并改善治疗效果。
目的
评估nivolumab+BV联合方案在nivo单药治疗失败的r/r HL的安全性和疗效。
方法
目前纳入分析的共10例患者(6例男性,4例女性),中位年龄28岁(23-35)。所有患者既往均接受过单药nivo治疗,中位次数为18(12-27)。40%的患者既往接受过auto-HSCT,70%的患者接受过BV治疗。nivolumab + BV治疗开始前,根据LYRIC标准,80%的患者在出现疾病进展,2例患者为不确定反应。具体给药方法为:BV(1.8mg/kg)和nivolumab(3mg/kg),D1;21天为一个周期,共4(3-6)周期。治疗完成后,进行PET-CT扫描并根据LYRIC评估反应。
结果
中位随访时间10.8个月(7.4-13),所有治疗患者的客观缓解率为70%,CR率为30%;2例(20%)反应不确定,1例疾病稳定。90%的患者观察到SPD下降。达到CR后1例患者复发,出现肿瘤体积和代谢活性增加。6例患者在nivo+BV治疗后接受nivo+苯达莫司汀后续补救联合治疗,1例患者进行异基因造血干细胞移植。9例(90%)出现治疗相关不良事件(AE),其中最常见的是恶心和周围神经病变,1例(10%)出现3级皮疹。截至分析时,9例(90%)存活。 1例因nivo治疗前的继发性骨髓增生异常综合征转化为化疗耐药性急性髓系白血病而死亡。
结论
本研究表明,nivo+BV组合有望成为nivolumab单药治疗失败的r/r HL的有效挽救方案。不良反应可接受。Nivo和BV联用可能存在协同作用,对单药耐药的患者也可能有效。
另辟蹊径:BTK(ACALBRUTINIB)联合PI3K抑制剂ACP-319在复发/难治性B细胞恶性疾病中疗效几何?(Abstract: PS1011)
背景
Bruton酪氨酸激酶(BTK)B细胞恶性肿瘤的靶点之一。Acalabrutinib是BTK的选择性共价抑制剂。临床前研究显示在B细胞淋巴瘤中BTK和PI3K抑制剂联合存在协同作用。
目的
评估Acalabrutinib与PI3Kδ抑制剂ACP-319联合用于复发/难治性B细胞恶性肿瘤的疗效。
方法
研究对象为复发/难治的B细胞恶性肿瘤,既往接受过≥1线治疗,ECOG PS≤2分。给药方法:口服acalabrutinib 100 mg bid,ACP-319剂量递增(25/50/100 mg bid [每剂量n = 6次];队列1)或50mg bid(扩展队列)直至疾病进展或出现不可耐受的毒性。主要研究终点是安全性(包括第1部分的剂量限制性毒性[DLT])。次要终点是药代动力学/药效学,总体反应率(ORR),反应持续时间(DOR)和无进展生存期(PFS)。
结果
队列1共纳入18例患者,其中慢性淋巴细胞白血病/小淋巴细胞白血病(CLL / SLL)8例,滤泡性淋巴瘤3例,套细胞淋巴瘤3例,弥漫性大B细胞淋巴瘤(DLBCL)3例,瓦尔登斯特伦巨球蛋白血症1例。平均年龄为65岁(范围48-77),ECOG PS均≤1分。一例患者在ACP-319 50-mg组中出现DLT(皮疹),在100-mg组中有2例出现DLT(皮疹,发热性中性粒细胞减少,腹泻和肺炎)。最大耐受剂量定义为acrabrutinib 100mg bid的ACP-319 50mg bid。2016年CLL/SLL患者从该治疗方案中获益欠佳,改为接受acalabrutinib单药治疗。
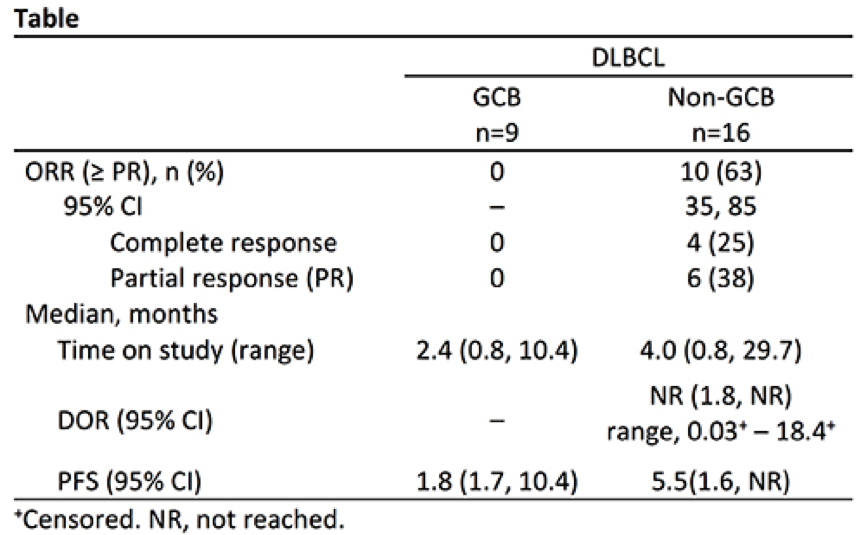
该研究中共25例DLBCL患者(队列1:n = 3,队列2:n = 22),免疫组化检测发现9例为生发中心型(GCB),16例为非GCB DLBCL。中位年龄为70岁(55-90),既往治疗的中位线数为2(1-5)。最常见AEs为AST/ALT升高、腹泻、疲劳和皮疹。22例患者停药(由于AE而5例停用acalabrutinib,7例停用ACP-319)。ORR显示在表中。
表 25例DLBCL行Acalabrutinib + ACP-319联合治疗的ORR
结论
Acalabrutinib + ACP-319联合治疗AEs可耐受,非GCB DLBCL患者的缓解率高。
ORR达61%:IBRUTINIB,来那度胺和利妥昔单抗联合治疗(IR2方案)在复发/难治的非GCB-DLBCL中的前景可期(Abstract: PF262)
背景
复发难治的弥漫大B细胞淋巴瘤(r/r DLBCL)特别是不适合进行造血干细胞移植(SCT)的患者,预后很差。Ibrutinib(ibr)是一种Bruton酪氨酸激酶抑制剂,被批准用于治疗各种B细胞恶性肿瘤。该研究为一项开放性多中心研1b / 2期研究,究旨在评估ibr联合来那度胺(LEN)、利妥昔单抗(RTX)在不适合进行SCT的r/r DLBCL患者中的安全性和有效性。经过1b期研究中的剂量爬坡试验,LEN 20mg,D1-21,ibr 560mg 每日1次,RTX 375mg/m2 D1;28天为1个周期,该方案(iR2)被推荐用于2期临床试验(RP2D)。在整个1b期试验中,iR2显示出良好的抗肿瘤活性,总体应答率(ORR)分别为43%(GCB)和61%(非GCB);中位反应时间(DOR)为16个月。
目的
评估iR2方案在≥18岁组织学确诊、既往接受过≥1次治疗的r/r非GCB DLBCL的安全性和活性。
方法
Ibr、LEN和RTX在RP2D中以28天为一周期给药(如图)。2期临床试验的主要研究终点是ORR。次要终点包括完全缓解率,DOR,无进展生存期(PFS),总生存期和安全性。对于严重皮疹和中性粒细胞减少症,酌情予以口服皮质类固醇和抗组胺药或造血生长因子。
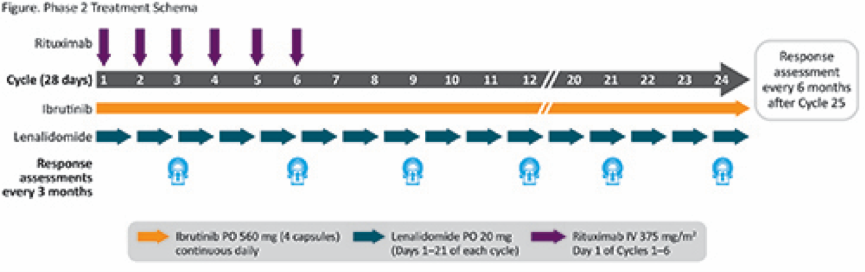
图 IR2方案给药方法
结果
2期试验中共纳入42例患者,中位年龄为63岁,62%是男性,IV期疾病占62%,26%有原发性难治性疾病,既往中位DLBCL系统治疗的中位数为2(1-5)。iR2方案显示出良好抗肿瘤活性:在最初入组的28例患者中,17例患者出现客观反应(9例CR[32%]; 8例PR[29%]),ORR为61%,2例(7%)SD,中位DOR为10个月。截至本次分析,42例患者的中位PFS为5个月,其中57%仍在接受治疗。 79%的患者出现≥3级TEAE,57%的患者出现与研究药物相关的≥3级TEAE。所有患者中3-4级TEAE发生率≥5%的有中性粒细胞减少症、贫血症和皮疹。
结论
该2期试验证明了ibr,LEN和RTX在不适合SCT的r/r非GCB DLBCL中显示出值得期待的疗效和可控的安全性。
[1].https://learningcenter.ehaweb.org/eha/2018/stockholm/214450/anas.younes.atezolizumab.plus.r-chop.shows.encouraging.activity.and.acceptable.html?f=menu=6*ce_id=1346*ot_id=19046*media=3
[2].https://learningcenter.ehaweb.org/eha/2018/stockholm/215483/kirill.lepik.bendamustine.in.combination.with.nivolumab.in.patients.with.html?f=menu=6*ce_id=1346*ot_id=19058*media=3
[3].https://learningcenter.ehaweb.org/eha/2018/stockholm/214894/luibov.tsvetkova.nivolumab.in.combination.with.brentuximab.vedotin.in.patients.html?f=menu=6*ce_id=1346*ot_id=19058*media=3
[4].https://learningcenter.ehaweb.org/eha/2018/stockholm/215335/paul.m.barr.acalabrutinib.in.combination.with.the.pi3k.inhibitor.acp-319.in.html?f=menu=6*ce_id=1346*ot_id=19046*media=3
[5].https://learningcenter.ehaweb.org/eha/2018/stockholm/214747/radhakrishnan.ramchandren.the.combination.of.ibrutinib.lenalidomide.and.html?f=menu=6*ce_id=1346*ot_id=19046*media=3
欲了解更多血液肿瘤、淋巴瘤相关资讯,与全国各地血液肿瘤、淋巴瘤医生交流与讨论,请扫描以下二维码,添加肿瘤资讯小助手-Dinna微信,备注“血液肿瘤”!












 苏公网安备32059002004080号
苏公网安备32059002004080号


