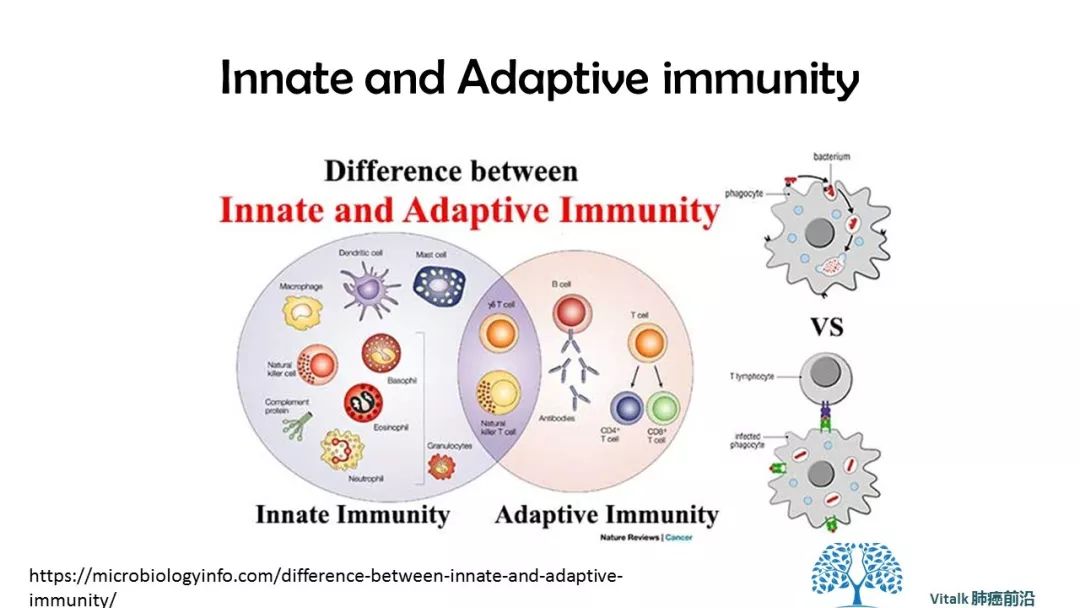
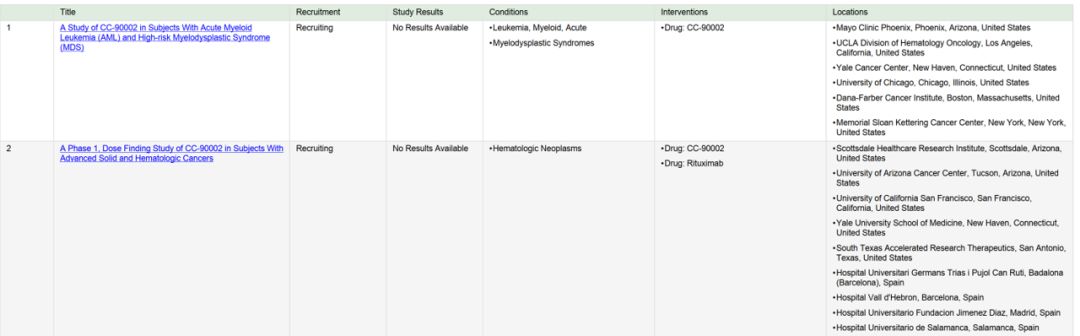
 随着对肿瘤免疫反应机制的深入洞察和理解,肿瘤免疫策略蓬勃发展,但迄今为止的主要策略是针对T细胞的checkpoint inhibition,这是适应性免疫应答的中心调节器。 这种方法是抗原特异性的。但免疫系统的另外一只上帝之手—innate immune 也扮演着重要角色
随着对肿瘤免疫反应机制的深入洞察和理解,肿瘤免疫策略蓬勃发展,但迄今为止的主要策略是针对T细胞的checkpoint inhibition,这是适应性免疫应答的中心调节器。 这种方法是抗原特异性的。但免疫系统的另外一只上帝之手—innate immune 也扮演着重要角色
https://microbiologyinfo.com/difference-between-innate-and-adaptive-immunity/
 癌细胞必须躲避适应性和先天性免疫应答的效应细胞的攻击,先天免疫应答在癌症发展和进展中起重要作用-可能是治疗上互补的作用。
癌细胞必须躲避适应性和先天性免疫应答的效应细胞的攻击,先天免疫应答在癌症发展和进展中起重要作用-可能是治疗上互补的作用。
巨噬细胞是先天性免疫应答的关键效应细胞,它们的主要功能是巡视人体寻找损伤的,老的或外来的细胞,并通过吞噬作用从身体中清除它们以维持细胞稳态。
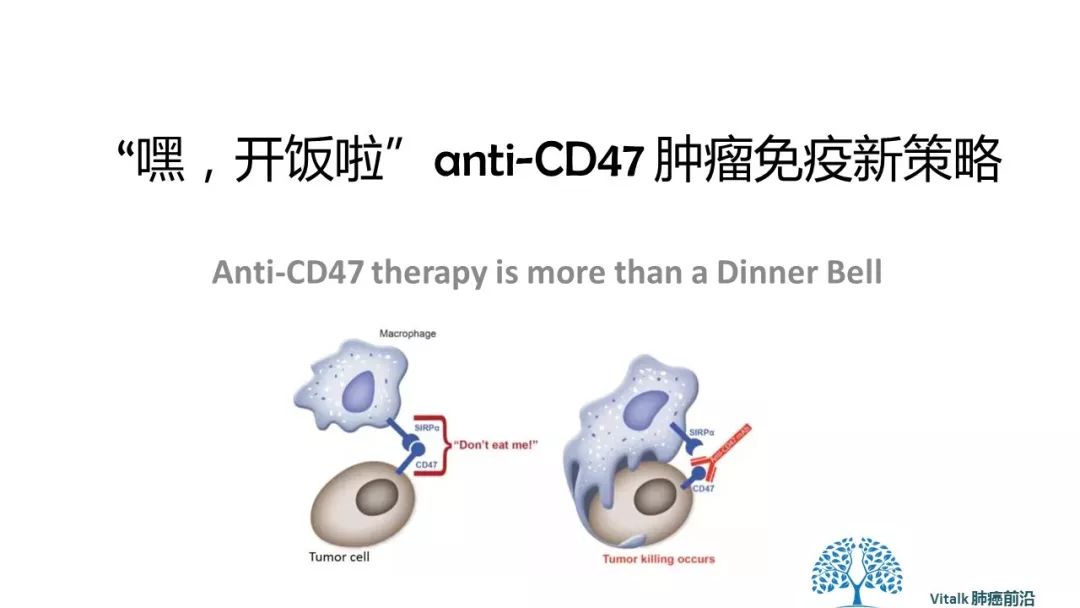
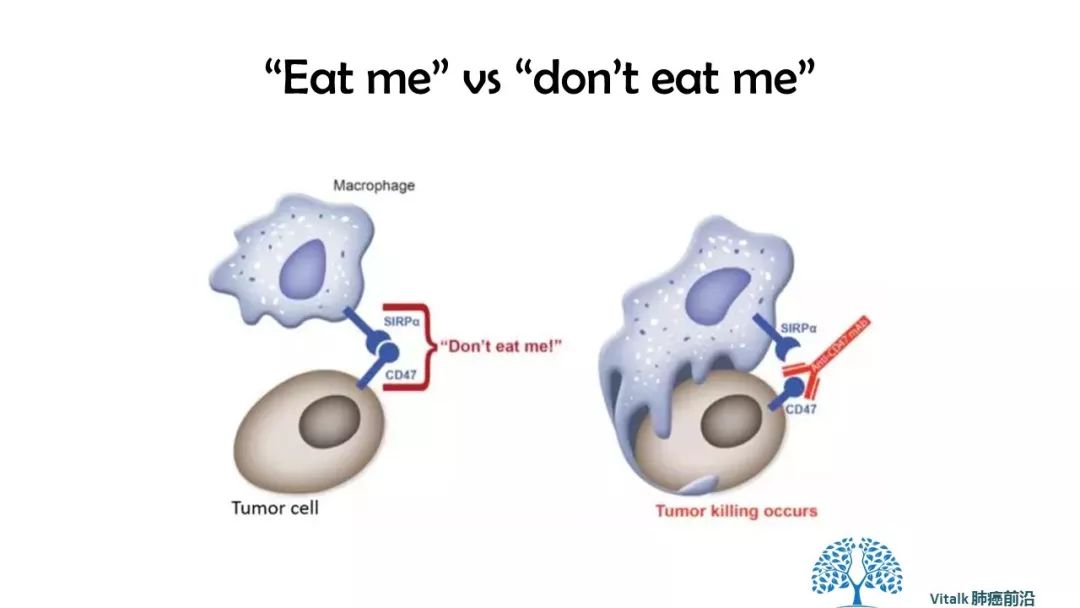
吞噬作用似乎受到细胞表面蛋白表达的微妙平衡的调节,所述细胞表面蛋白作为吞噬吞噬效应物的“吃我”或“不吃我”信号。 与T细胞激活类似,接通巨噬细胞似乎是一个两步过程,既需要上调“吃我”信号,又需要下调“不吃我”的信号。
CD47是跨膜蛋白,属于免疫球蛋白超家族,几乎在体内每个细胞表面都有表达。 细胞表面CD47与吞噬细胞上的信号调节蛋白α(SIRPα)的结合抑制吞噬功能,巨噬细胞对癌症的攻击:吞噬作用需要“吃我”信号的协调激活以及“不吃我”信号的同时中断,单独的事件都不足以触发针对癌症的吞噬性链式反应。
由于CD47在各种癌症类型中广泛表达,包括诸如卵巢癌,急性髓细胞性白血病(AML)和非霍奇金淋巴瘤的血液恶性肿瘤以及诸如乳腺癌,膀胱癌和头颈癌的实体瘤。
因此它代表了一种潜在的广泛的抗肿瘤免疫靶点。 antiCD47肿瘤特异性抗体一端结合癌细胞,另一端接合吞噬细胞Fc受体。尽管大多数健康细胞表面也表达CD47,但它们缺乏足够的“吃我”信号(‘第二钥匙‘)。所以阻断CD47启动innateimmune的phagocytosis作用被认为是安全有效的抗肿瘤策略。
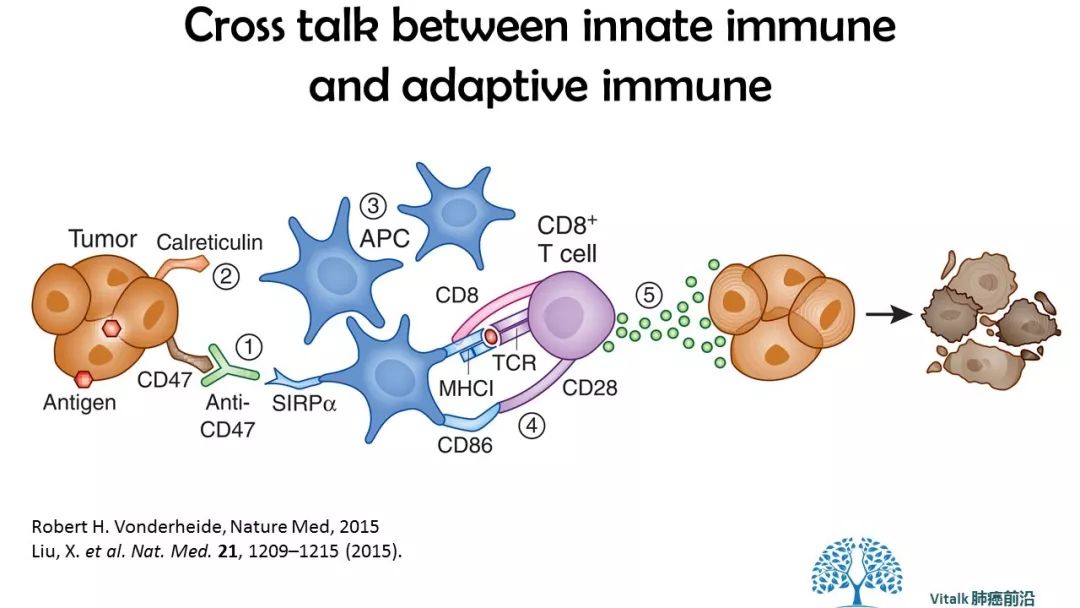
2015年的Nature Medicine,CD47 blockade triggers T cell-mediated destruction of immunogenic tumors.
Liu,et al揭示了CD47阻断桥接先天免疫DC激活和T细胞启动的证据(图1)。图1 CD47免疫检查点。 CD47阻断抗体(1)和促吞噬细胞分子如钙网蛋白(2)协同增强APC对肿瘤的吞噬(3),使肿瘤抗原的加工和呈递成为MHC I类分子凹槽中的肽(4 )和启动肿瘤抗原特异性的CD8 + T细胞(5)。 MHC,主要组织相容性复合物; TCR,T细胞受体。
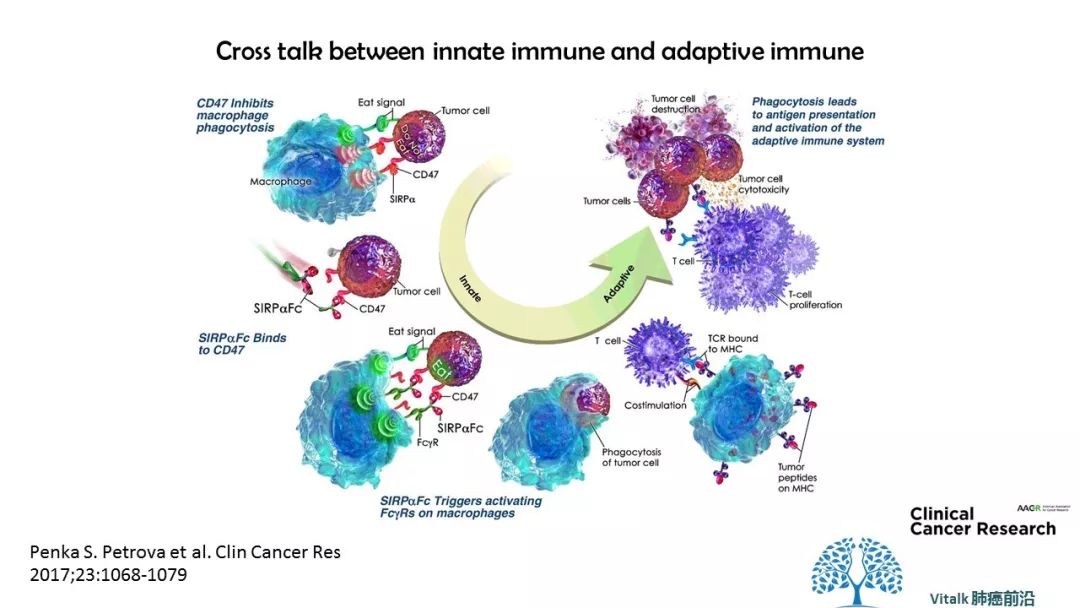
The proposed mechanism of action of TTI-621–mediated CD47 antitumor activity. A, CD47 sends an inhibitory signal to macrophages by binding to SIRPα. B, TTI-621 binds to CD47 on tumor cells and blocks this interaction, (C) while engaging FcγR on macrophages, (D) leading to macrophage-mediated phagocytosis of tumor cells. E, Macrophages that have phagocytosed target cells can present tumor peptides in the context of MHC to tumor-specific CD8+ T cells, (F) activating the adaptive immune response and leading to the destruction of tumor cells by cytotoxic CD8+ T cells.
使用同基因小鼠癌症模型,而不是移植瘤模型,Liu等人首先证明CD47阻断介导的抗肿瘤作用具有CD8 +细胞毒性T细胞依赖性 - 因为CD47抗体的功效在T细胞缺陷型或CD8 +细胞缺失型的肿瘤宿主模型中不起作用。 由于CD8 + T细胞活化需要通过主要组织相容性复合体(MHC)I类分子上呈递肿瘤抗原,因此作者接下来研究DC和/或巨噬细胞 在CD47阻断剂作用下如何影响对CD8+T细胞的抗原呈递。研究结果表明提示CD47阻断通过抗原呈递细胞(APC)增强对肿瘤细胞的吞噬,使得肿瘤抗原在MHC I类分子的沟槽中成为肽的加工和呈递。 因此,通过阻断CD47检查点可以活化肿瘤特异性的CD8 +效应子T细胞。
CD47阻断诱导的APC激活是否也可以增强CD4 + T细胞的肿瘤免疫作用仍然是一个未得到解答和潜在的关键问题。
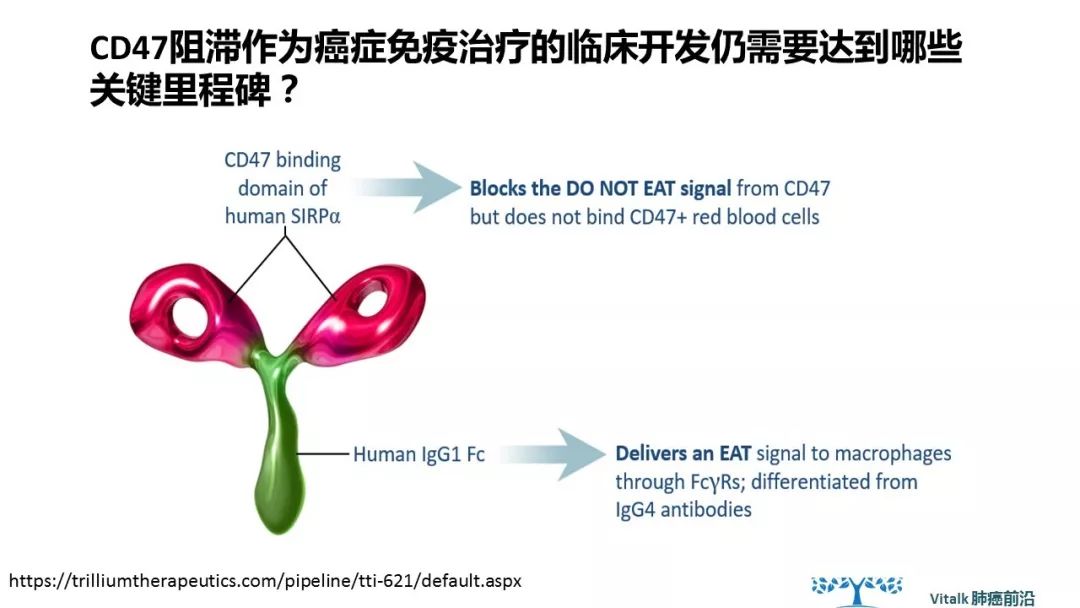
CD47阻滞作为癌症免疫治疗的临床开发仍需要达到哪些关键里程碑?首先是安全性的管理。CD47也在某些健康组织上表达; 例如,在人类大脑皮层和小脑中有明显的表达。所提出的CD47阻断治疗指数依赖于以下假设:健康细胞缺乏有效的“吃我”信号,使CD47阻断对健康细胞保持“缄默silent“。
然而,这在第phaseI中显然值得仔细研究,特别是如果患者同时接受化疗或放射治疗,可以上调“eat me”的信号。
CD47 +红细胞的消耗是预期的临床不良反应,尽管相对容易管理。从某种意义上来说,治疗相关性贫血可能是一种有用的生物标志物,用于评估和比较新的CD47靶向抑制剂。
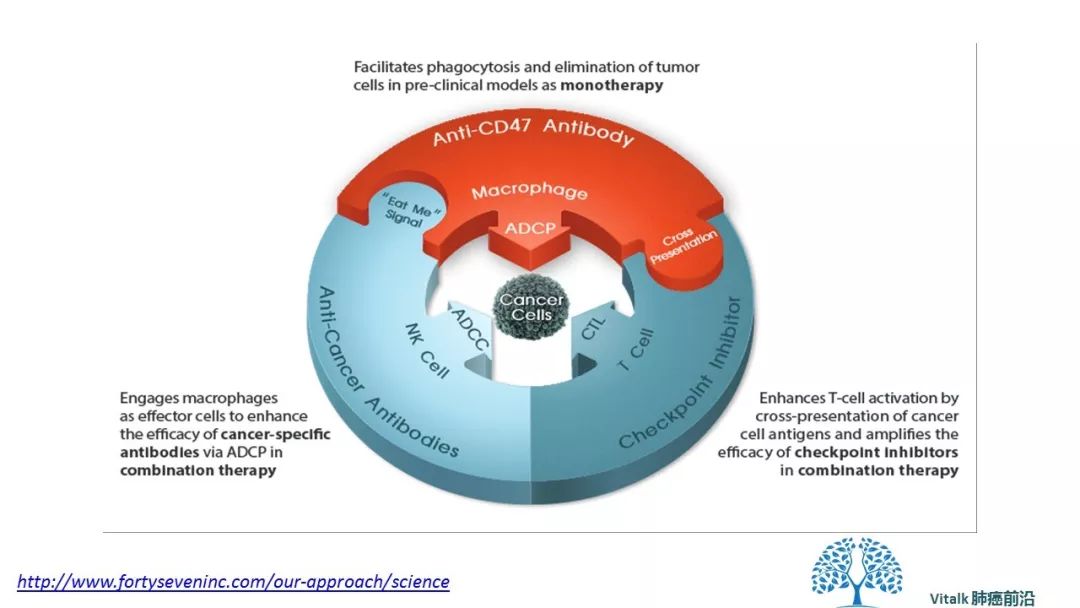
其次,假设CD47抗体可以穿透肿瘤微环境,在没有高度免疫原性肿瘤或缺乏针对其他免疫抑制因素的治疗方法参与下,使用CD47阻断实现临床效果可能会面临挑战。
虽然实验性新抗原如ovalbumin, mimic T cell neo-epitopes 是否可以模拟由肿瘤体细胞突变表达的新抗原尚处在探索阶段,但CD47阻断相关的临床前数据提示对患者进行新抗原和突变负荷的筛选可能有助于提高疗效。这种筛选方法类似于富集checkpoint inhibitor 的可能获益人群。
1.Barrett, D.M., Singh, N., Porter, D.L., Grupp, S.A. & June, C.H. Annu. Rev. Med. 65, 333–347 (2014).
2. Tseng, D. et al. Proc. Natl. Acad. Sci. USA 110, 11103–11108 (2013).
3. Soto-Pantoja, D.R. et al. Cancer Res. 74, 6771–6783(2014)
如Liu等所述,另一种策略是在CD47阻断性抗体治疗之前而不是之后给予化疗以促进肿瘤死亡和抗原释放,然后激活APC。
鉴于这些提出的作用机制,将CD47阻断剂与活化APC的药剂(如激动剂CD40抗体11)或那些提供强烈“吃我”信号的药剂(如抗肿瘤单克隆抗体2)结合起来可能是有益的。
一旦通过CD47阻断在患者中诱导T细胞应答可以用检查点抗体进一步增强,例如美国食品和药物管理局批准的阻断PD-1或CTLA-4检查点抑制剂。
尽管CPI在一些患者中取得了令人印象深刻的临床结果,但在大多数人群中仍然缺乏有效应答,主要是因为缺乏肿瘤特异性T细胞[12]。
将治疗与抗CD47联合使用是扩大PD-1和CTLA-4阻滞临床应用获益人群范围将是一种具有广阔前景的联合策略。

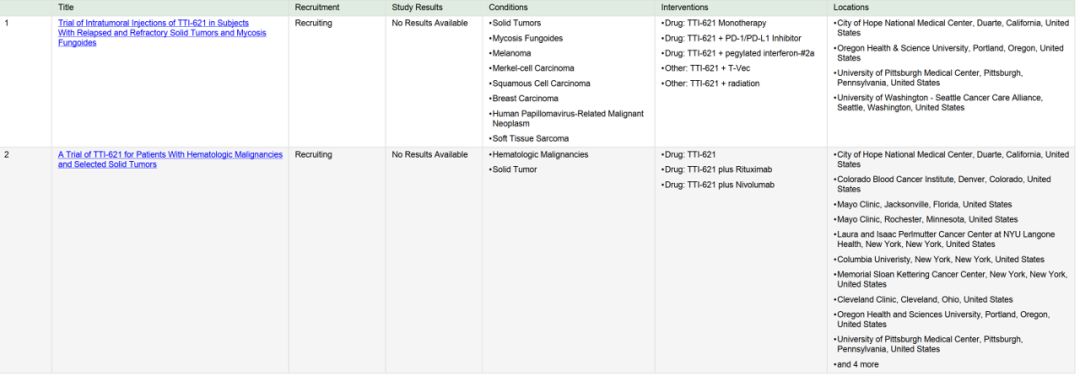
CD47的治疗潜力得到了来自临床前试验数据的支持,已经有几家正在开发靶向该蛋白质的单克隆抗体的制药公司正在投入临床研发。
Forty Seven将在2018年ASCO 上公布2项早期数据:
Data from its ongoing Phase 1b/2 clinical trial evaluating 5F9 in combination with rituximab for the treatment of r/r NHL, including diffuse large B-cell lymphoma and follicular lymphoma and
Data from a Phase 1 PK and PD study of 5F9 in patients with advanced solid tumors, including ovarian cancer, will be presented in two oral presentations at the 2018 ASCO Annual Meeting in Chicago, Illinois, June 1-5, 2018. An additional abstract describing the PK profile of 5F9 in human patients and the recommended Phase 2 dose has also been accepted for poster presentation.


Finally, among the myriad of emerging immunotherapy agents for cancer, an antibody that achieves T cell activation by blocking a negative regulatory pathway has an obvious dose and schedule pharmacological advantages over pure agonists.
We have, however, entered the era of combinations. Optimal immune activation involves non-redundant pathways that work synergistically. The caution, therefore, is not to throw away CD47 blockade or novel immune agonists if the first clinical trials of monotherapy fall short of expectations. Robert H. Vonderheide, Nature Med, 2015
大意:肿瘤,是我们所面对的这个星球上最强大的物种,对它的征伐,需要基于对cancer biology的深入动态的理解,并且做好准备在新药/新策略研发道路上面临的难以预料的挑战和不可避免的失败。不抛弃,不放弃,不要随意丢弃任何成功的可能性,尤其是失败接踵而至的时候。向IDO表示慰问。
1. Grimsley, C. & Ravichandran, K.S. Trends Cell Biol. 13,648–656 (2003).
2. McCracken, M.N., Cha, A.C. & Weissman, I.L.Clin. Cancer Res. 21, 3597–3601 (2015).
3. Willingham, S.B. et al. Proc. Natl. Acad. Sci. USA 109,6662–6667 (2012).
4. Beatty, G.L. et al. Science 331, 1612–1616 (2011).
5. Ruffell, B. & Coussens, L.M. Cancer Cell 27, 462–472 (2015).
6. Liu, X. et al. Nat. Med. 21, 1209–1215 (2015).
7. Sharma, P. & Allison, J.P. Cell 161, 205–214 (2015).
8. Barrett, D.M., Singh, N., Porter, D.L., Grupp, S.A. & June, C.H. Annu. Rev. Med. 65, 333–347 (2014).
9. Tseng, D. et al. Proc. Natl. Acad. Sci. USA 110, 11103–11108 (2013).
10. Soto-Pantoja, D.R. et al. Cancer Res. 74, 6771–6783 (2014).
11. Vonderheide, R.H. & Glennie, M.J. Clin. Cancer Res. 19, 1035–1043 (2013).
12. Lesokhin, A.M., Callahan, M.K., Postow, M.A. & Wolchok, J.D. Sci. Transl. Med. 7, 280sr281 (2015).











 苏公网安备32059002004080号
苏公网安备32059002004080号


