腹腔热灌注化疗在晚期卵巢癌的治疗中取得了不错的成果,其结果在今年1月初发表在了NEJM杂志上。对于胃癌伴腹膜转移的患者,全身化疗的疗效十分有限,腹腔灌注化疗能否显示出更好的疗效呢?让我们一起来看5月11日发表在JCO杂志上的日本PHOENIX-GC 研究: S-1联合紫杉醇(腹腔灌注)对比S-1联合顺铂(静脉)治疗胃癌合并腹膜转移患者的III期试验。
目的
胃癌伴腹膜转移患者的全身化疗与其他部位转移患者的治疗方式相同,一线治疗采用铂类联合氟尿嘧啶,二线治疗为紫杉醇(PTX)加雷莫如单抗。但是系统给药最终只有一小部分药物能进入腹膜,对于腹膜转移灶,腹腔内灌注化疗是否更合理呢?
腹腔内灌注化疗最早用于卵巢癌,目前已有可靠的临床研究数据支持。而对于胃癌伴有腹膜转移的患者,有研究初步报道了腹腔PTX联合全身化疗的有效性。因此,我们进行了II期临床试验,将每周腹腔灌注PTX与S-1联合静脉注射PTX,腹腔灌注PTX的推荐剂量为20 mg/m2,这两项临床试验的1年OS分别为77%和78%,在东京大学附属医院接受此方案治疗的100例患者的中位生存时间(MST)为20.6个月。
因此,本研究旨在评估腹腔和静脉注射PTX加S-1(IP)与标准方案S-1加顺铂(SP)相比在胃癌腹膜转移患者中的安全性和有效性。
患者和方法
入组标准包括病理证实的原发性胃腺癌伴腹膜转移,未接受化疗或短期内(<2个月)化疗没有疾病进展,年龄20至74岁,ECOG评分为0或1,良好的营养状况和器官功能。排除标准包括腹膜或卵巢转移以外的远处转移,接受过姑息性胃切除术和存在需要频繁引流的大量腹水。
患者以2:1的比例随机分配至接受IP或SP,IP组:腹腔灌注和静脉注射PTX加S-1。用法用量:第1天和第8天腹腔注射紫杉醇20 mg/m2及静脉注射紫杉醇50 mg/m2,在每3周周期的第1天至第14天口服S-1 80 mg/m2;SP组:S-1加顺铂。用法用量:每5周周期第1至21天口服S-1 80mg/m2,第8天静注顺铂60mg/m2。IP组的患者置入腹腔内导管。
分层因素为:中心、既往化疗(是/否)和腹膜转移的程度(P1或P2/P3)分层。根据日本胃癌分类将腹膜转移分类如下:P1,转移结节限于邻近的腹膜; P2,腹腔内有数个散在的转移性结节;和P3,在整个腹膜腔内有许多转移性结节。由于P2和P3之间的区别不明确,因此整合为P2/P3类别,还包括仅通过影像诊断的晚期腹膜转移。
患者接受方案治疗直至疾病进展,毒性不可接受,研究者决定或患者退出。接受SP组治疗方案者禁止腹腔化疗。
主要终点是完成入组后随访2年的全分析集(FAS)的OS,次要终点为反应率,3年的OS和安全性。根据日本厚生劳动省的建议,在初步分析之前对研究方案进行了修订,因为有些患者当时仍在接受IP,所以建议我们将研究期延长1年,并将3年OS作为次要终点。
我们根据腹水量和腹膜细胞学检查结果探索性评估患者对化疗的反应。在患者入组时根据CT结果将患者分为无、少量(在盆腔内)或中等(在盆腔外)腹水,治疗期间评估中等量腹水的患者对治疗的疗效。IP组患者通过最初的腹腔镜检查和每个治疗周期的第一天检测腹膜灌洗液来进行细胞学检查,SP组患者如果进行腹腔细胞学检查,则在第一次和第二次腹腔镜检查时进行。
预计IP和SP组的MST分别为22和11个月。使用Lakatos方法计算所需的样本量为170名患者,采用log-rank检验,双侧α=0.05,效能为90%,最终计算样本量为180名患者。根据O'Brien-Fleming方法,在90名和160名患者入组后进行了两次中期分析,因此,主要终点的最终分析使用了4.976%的显著性水平。对FAS进行主要疗效分析,对全部治疗患者集(APTS)进行安全性分析,对APTS和PP集(PPS)进行OS的敏感性分析,用APTS分析随访时间、治疗时间和相对剂量强度。
对OS进行事后亚组Cox回归分析,以评估各亚组之间效应的一致性。使用Mantel检验比较治疗组间腹水的最佳反应,由独立的影像医生进行评估,分为消失、减少、无变化或增加。
结果
从2011年10月到2013年11月,日本的20个中心共入组了183名患者。图1显示了首次分析截止日期的研究概况。
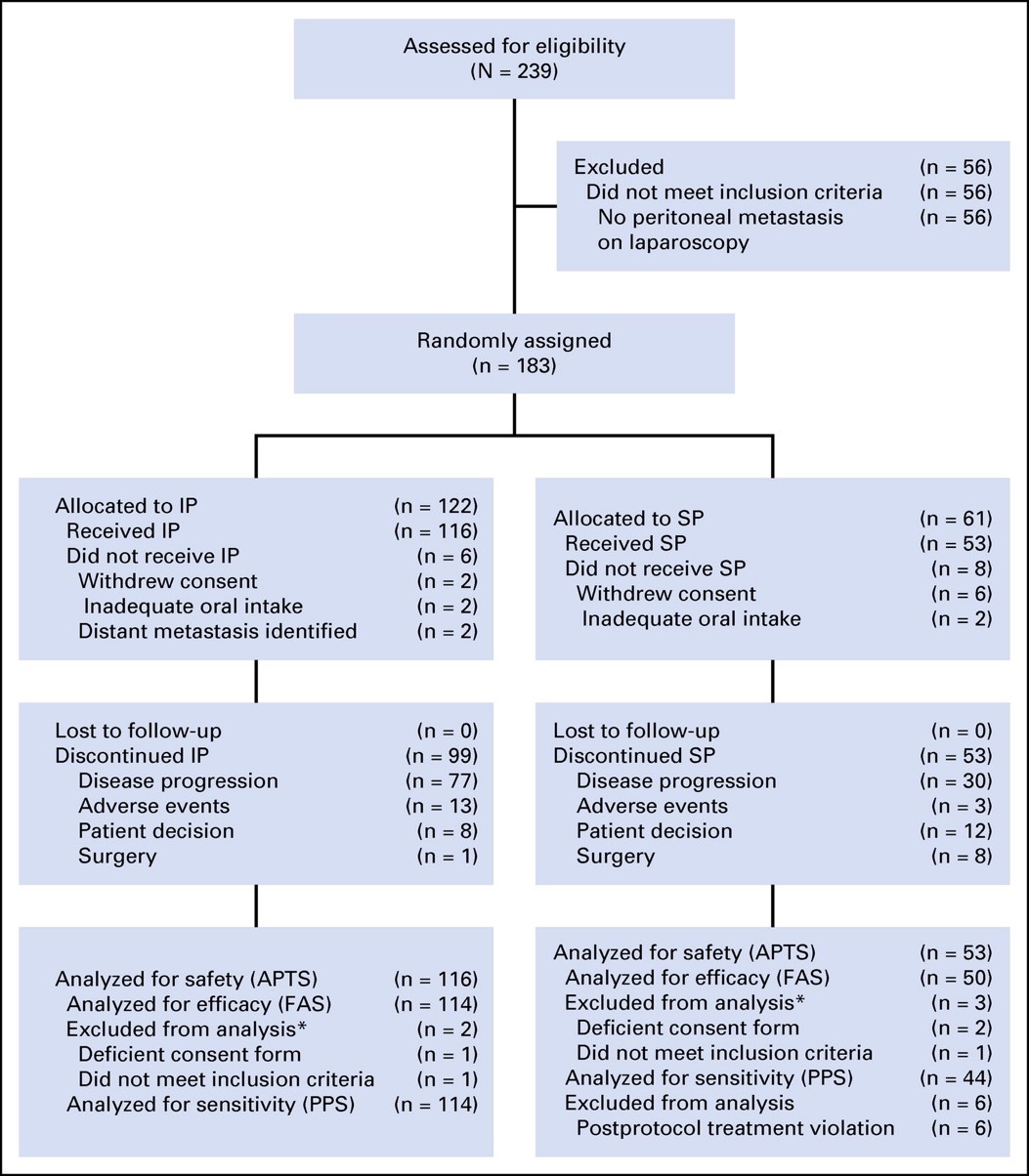 中期分析的结果不符合有效性或无效早期停止的标准。因此,随访持续2年,并延长1年。中位随访30.1个月(25.9~36.5个月)。治疗的中位持续时间:IP组为39周(27~81周),SP组为15周(10~30周)。IP组腹腔PTX、静注PTX和S-1的中位相对剂量强度分别为89.9%(80.8%~96.8%),87.2%(77.2%~95.2%)和84.6%(73.3%~93.5%);SP组顺铂和S-1分别为94.6%(82.5%~100%)和92.1%(81.4%~96.8%)。在额外的1年随访分析中,中位随访时间为41.7个月(37.0~48.0个月)。
中期分析的结果不符合有效性或无效早期停止的标准。因此,随访持续2年,并延长1年。中位随访30.1个月(25.9~36.5个月)。治疗的中位持续时间:IP组为39周(27~81周),SP组为15周(10~30周)。IP组腹腔PTX、静注PTX和S-1的中位相对剂量强度分别为89.9%(80.8%~96.8%),87.2%(77.2%~95.2%)和84.6%(73.3%~93.5%);SP组顺铂和S-1分别为94.6%(82.5%~100%)和92.1%(81.4%~96.8%)。在额外的1年随访分析中,中位随访时间为41.7个月(37.0~48.0个月)。
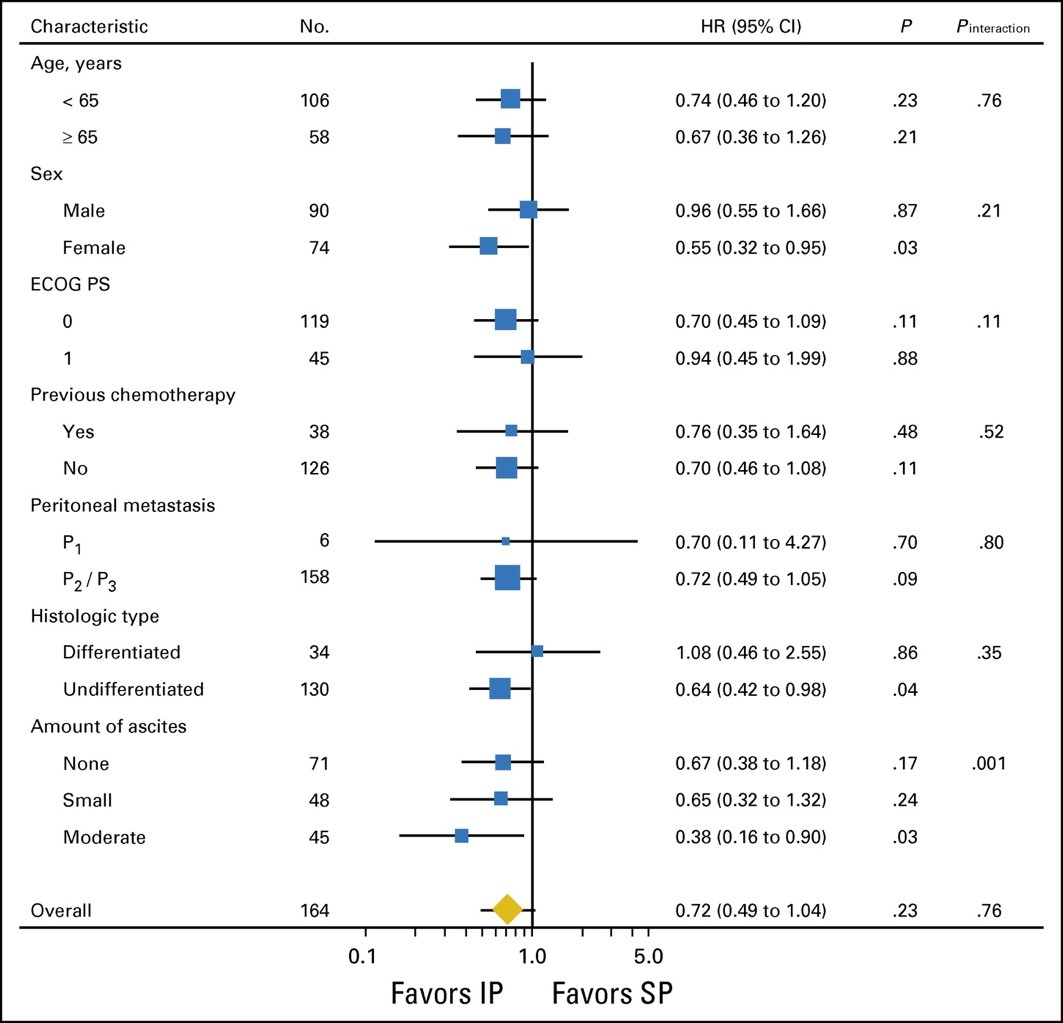
主要疗效分析的FAS包括164名患者。除了IP组的患者腹水量更多外(P = 0.015),两组之间的基线特征平衡。SP组有6例患者接受了腹腔化疗方案,这6名患者被排除在PPS之外。
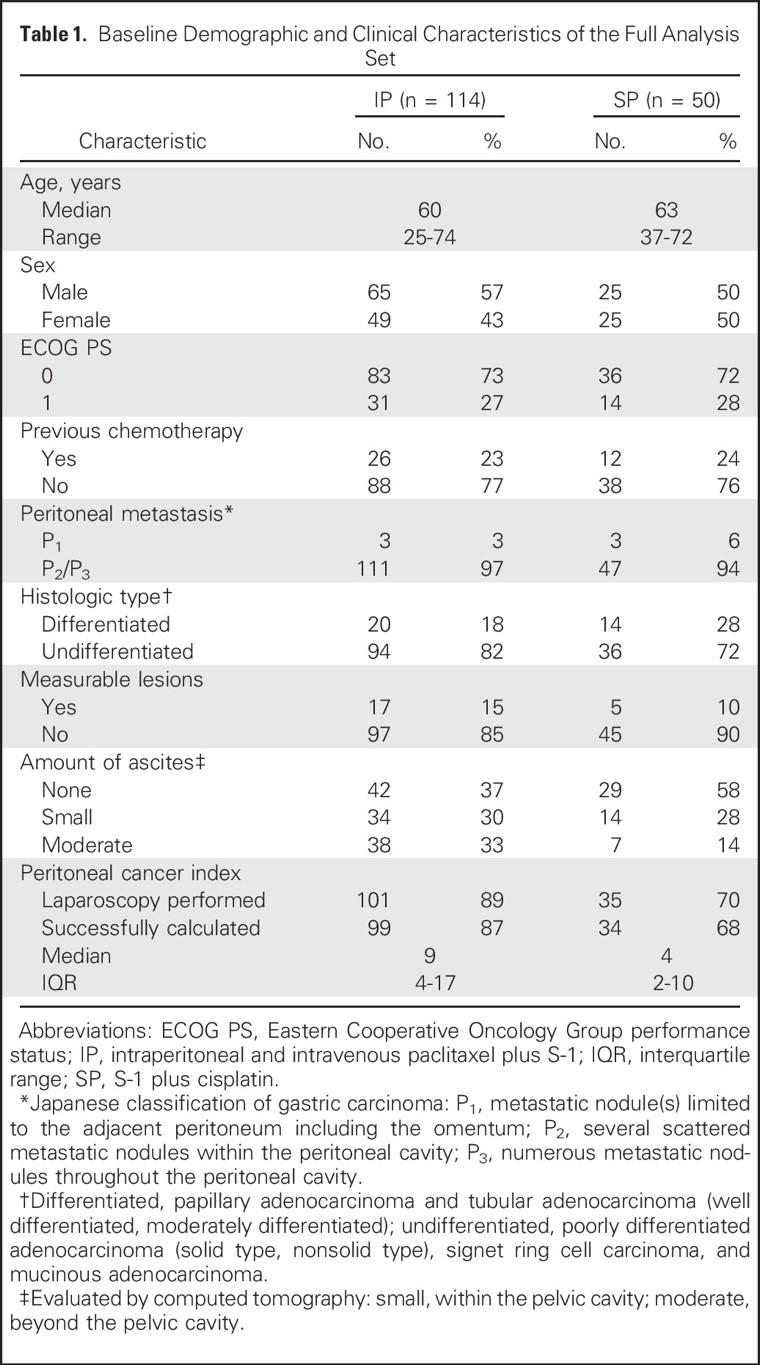
疗效
IP组的MST为17.7个月(95%CI 14.7~21.5个月),SP组为15.2个月(95%CI 12.8~21.8个月)(HR 0.72; 95%CI 0.49〜1.04;分层log-rank P=0.080;图2A)。IP组3年OS为21.9%(95%CI 14.9%~29.9%),SP组为6.0%(95%CI,1.6%~14.9%,图2B)。IP组的反应率为53%(9/17,95%CI,31%~74%),SP组为60%(3/5; 95%CI,12%至77%)(P = 1.0)。
对APTS进行敏感性分析,IP组的MST分别为17.7个月(95%CI,14.3~21.3个月)和SP组为14.8个月(95%CI,12.3~21.8个月)(HR,0.71; 95%CI,0.50~1.03; P = .067)。在排除违反协议治疗的患者后分析PPS,IP组的MST为17.7个月(95%CI,14.7~21.5个月),SP组为14.3个月(95%CI,12.1~17.7个月)(HR 0.64; 95%CI,0.43~0.94; P = 0.022)。用FAS对基线腹水进行校正的事后敏感性分析中,IP组的OS比SP组长(adjusted HR,0.59; 95%CI,0.39~0.87; P = .008)。
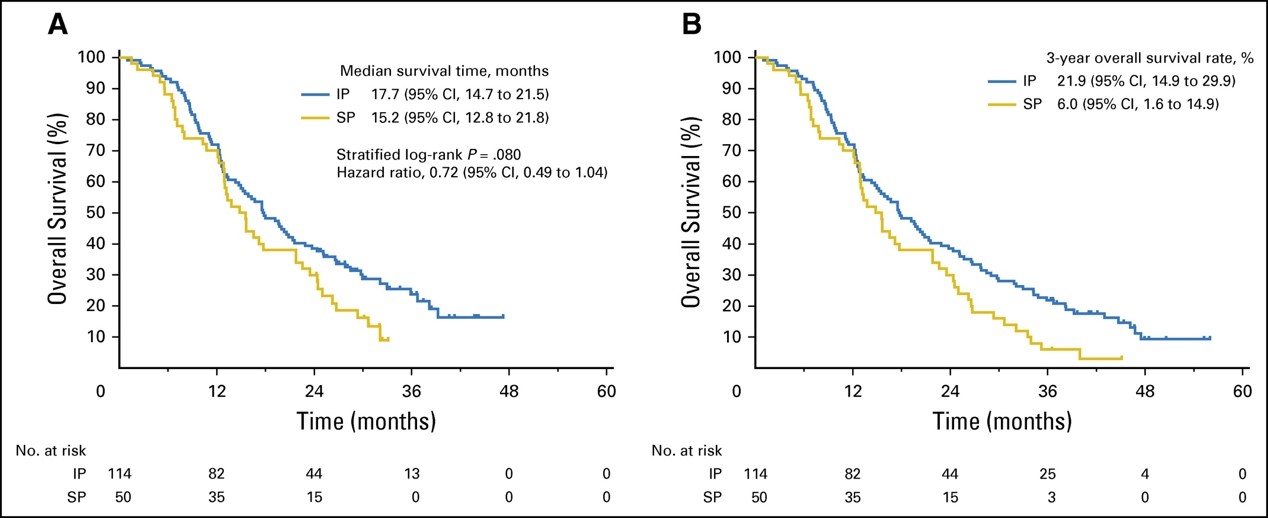
在总体生存的亚组分析中,我们发现治疗效果与腹水量之间有明显的关系(P = .001; 图3)。
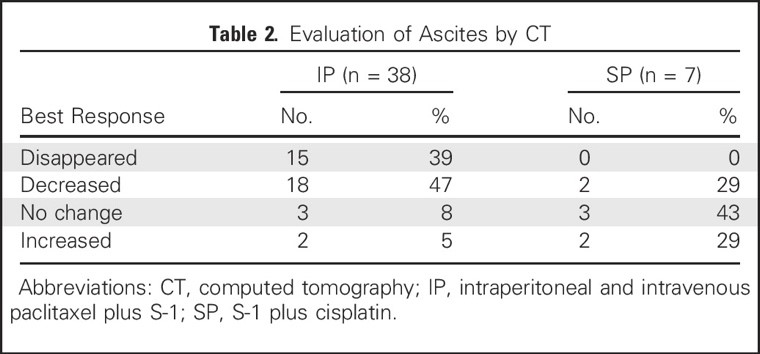
对腹水量的分析显示,IP组患者的反应更好(P = 0.001; 表2)。IP组共114例患者中93例(82%)、SP组40例患者中31例(78%)患者的腹膜细胞学检查阳性。对阳性患者在治疗期间至少一次重新评估, IP组中91名患者中69名(76%)腹膜细胞学转阴,SP组中9名患者中有3名(33%)转阴。
安全性
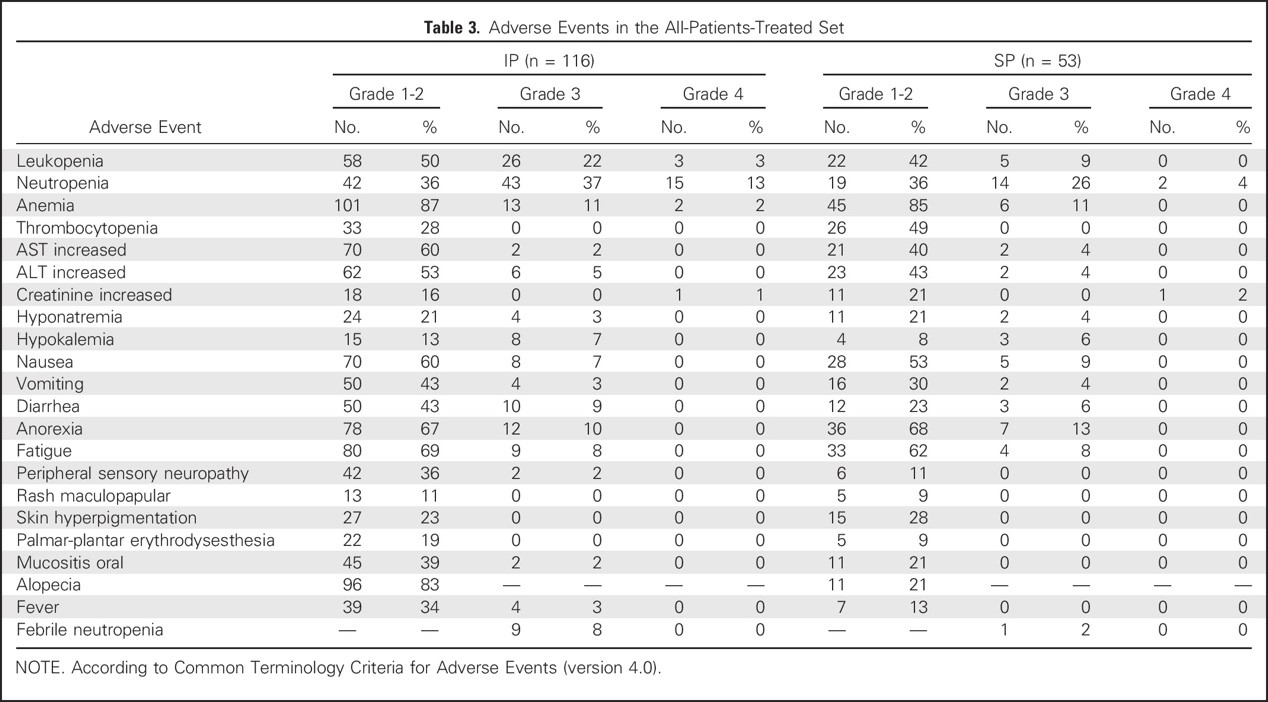
最常见的3/4级不良事件是两组的白细胞减少、中性粒细胞减少,贫血和厌食(表3)。IP组3或4级白细胞减少(25%v 9%; P = 0.023)和中性粒细胞减少(50%v 30%; P= .028)更常见。非血液学毒性是可以忍受的,两组之间没有差异。在116名患者中有7名(6%)观察到与腹膜内导管有关的八种不良事件:腹膜内导管感染(n = 3),导管阻塞(n = 3),皮下血肿(n = 1)和导管与小肠瘘(n = 1)。所有患者在取出腹腔内导管(n = 5)或保守治疗(n = 2)后均恢复。没有发生感染性腹膜炎或其他严重并发症。既没有意外的严重不良事件,也没有与方案治疗有关的死亡。
结论
该研究未能显示腹膜内紫杉醇加全身化疗的统计学优势。然而,探索性分析提示腹腔内紫杉醇可能对胃癌有临床获益。
Ishigami H, Fujiwara Y, Fukushima R, et al: Phase III Trial Comparing Intraperitoneal and Intravenous Paclitaxel Plus S-1 Versus Cisplatin Plus S-1 in Patients With Gastric Cancer With Peritoneal Metastasis: PHOENIX-GC Trial. Journal of Clinical Oncology:Jco2018778613, 2018











 苏公网安备32059002004080号
苏公网安备32059002004080号


