
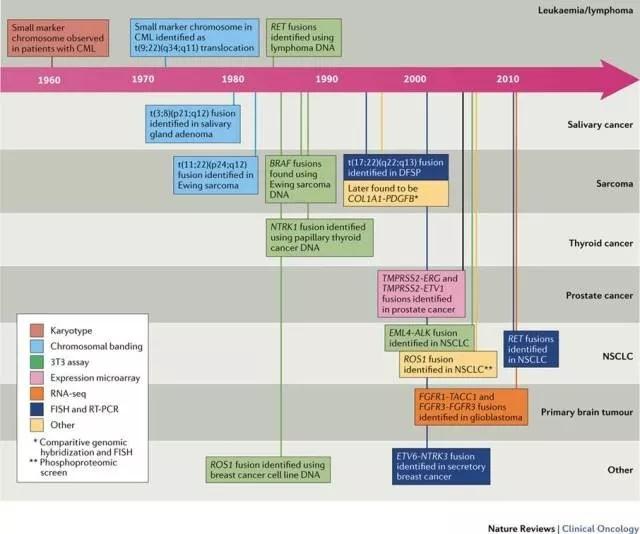
图1 |描绘各种恶性肿瘤中选择的致癌融合基因的发现时间和用于检测它们的方法。结构重排及其后的基因融合首先在慢性骨髓性白血病患者中被发现,其中含有t(9; 22)(q34; q11)易位的肿瘤细胞容易从血液中获得并用于细胞遗传学分析。随后在肉瘤(如t(11; 22)(q24; q12)和t(17; 22)(q22; q13))和癌组织中使用类似技术发现染色体间基因交换,导致易位。
用于检测基因融合的技术随着时间的推移而演变,包括多种检测平台方法,包括荧光原位杂交(FISH)和逆转录酶PCR(RT-PCR)分析,能够检测产生融合物的染色体内事件(例如,那些导致EML4-ALK和KIF5B-RET融合的事件)。目前,采用无偏差的融合检测技术,如NGS测序和anchored-multiplex PCR,可以在研究和临床中检测到越来越多的融合事件。 DFSP,皮肤纤维肉瘤。
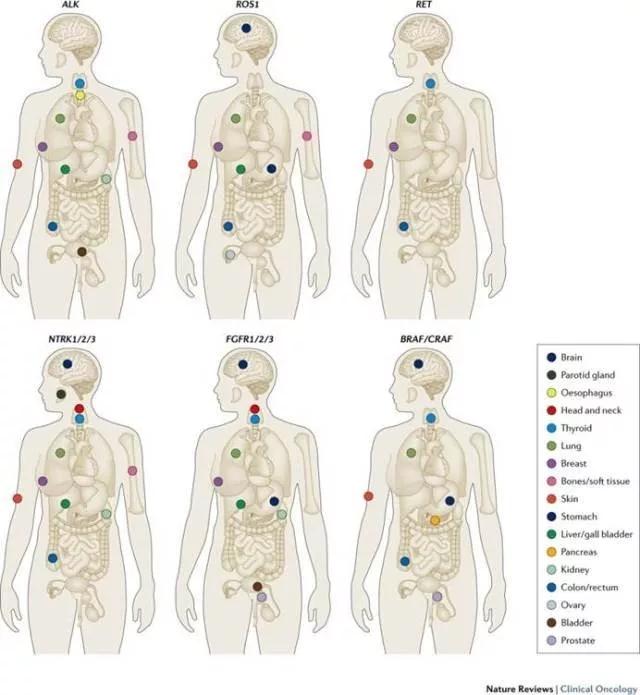 激酶融合在原发肿瘤部位的分布。 融合基因的重排(能够被靶向治疗药物所抑制)被认为是具有临床重要意义的驱动基因事件。 图中显示了所选择的临床相关基因融合的分布,特别是涉及ALK,ROS1,RET,NTRK1 / 2/3,FGFR1 / 2/3和BRAF / CRAF在不同器官起源肿瘤的分布。 这些融合的频率在不同肿瘤之间变化很大,从孤立病例报告到在大样本报道的融合事件。 在恶性肿瘤中临床相关基因融合的广泛存在支持,提示有必要用basket方法(master protocal)来设计涉及靶向治疗的临床试验。
激酶融合在原发肿瘤部位的分布。 融合基因的重排(能够被靶向治疗药物所抑制)被认为是具有临床重要意义的驱动基因事件。 图中显示了所选择的临床相关基因融合的分布,特别是涉及ALK,ROS1,RET,NTRK1 / 2/3,FGFR1 / 2/3和BRAF / CRAF在不同器官起源肿瘤的分布。 这些融合的频率在不同肿瘤之间变化很大,从孤立病例报告到在大样本报道的融合事件。 在恶性肿瘤中临床相关基因融合的广泛存在支持,提示有必要用basket方法(master protocal)来设计涉及靶向治疗的临床试验。
临床中用于检测基因融合的方法
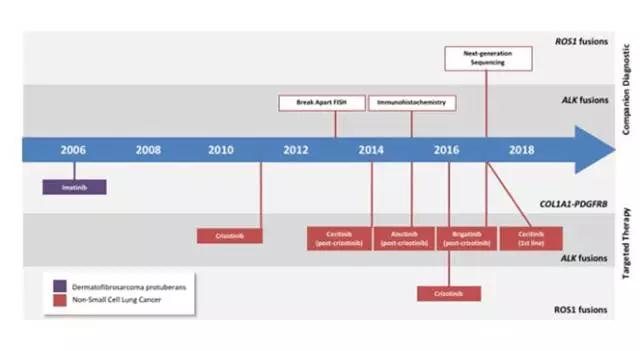
尽管针对基因融合变异的肿瘤已经有多个靶向药物获批,目前被FDA批准作为“伴随诊断”的诊断方法,仅限于对ALK,ROS1,BRAF的融合进行诊断;其中包括用于ALK检测的FISH,Ventana IHC,以及用于RSO1,BRAF诊断的NGS(Oncomine DX target Test,ThermoFisher)。
The panel, however, gauges alterations in 23 genes in total. The test report will not only indicate whether patients have ROS1, EGFR, and BRAF alterations linked to the three FDA-approved treatments, but also the presence or absence of variants in other genes
NGS能够同时进行多种驱动基因检测,但存在的问题是往往需要数周的检测周期(Turn around time),并且通常仅包括筛选出的外显子Exons和少数已知的内含子Introns,因此有可能无法检测出新的融合类型变异。比较好的检测流程,是先应用IHC对ALK和ROS1进行快速检测,剩余标本再进行更广的NGS测序。
基于血浆的液态活检也被应用于体细胞突变的检测。比如分离血浆中的ctDNA进行定量PCR(qPCR)或 hybridization capture based NGS检测。但是qPCR需要在测序前获知DNA断裂点的信息,同样,NGS能够检测出特定筛选的外显子和内含子以检测融合,但前提是断裂点正好要落在被筛选的区域中。需要注意的是,Introns通常较长,现有的NGS panel往往会为了节约测序成本将其排除在外,这就意味着,很多融合类型将无法被检测出来(ALK 和ROS1都存在许多不同的融合类型)。
对于在肿瘤中为发现驱动基因(阴性)或高度怀疑存在融合基因变异但未必NGS检出是,可以采用RNA 测序进行检测(anchored multiplex PCR),对比传统的测序方法,对于未知的融合类型,基于RNA测序的检测具有更大的优势。
Targets of tyrosine-kinase inhibitors
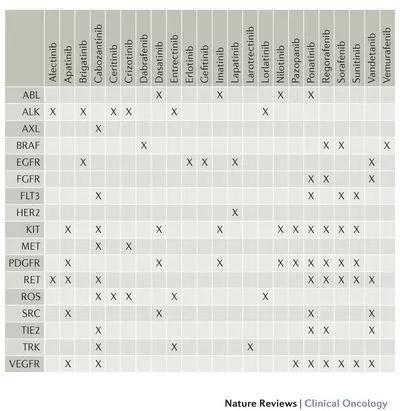 酪氨酸激酶抑制剂及其在体外抑制的蛋白质总结如下(部分筛选)。 目标列表不全面,这些药物也可能会抑制本文未列出的其他蛋白质。 这些被批准或临床测试的药物中的大多数是除了下文描述的激酶之外还具有针对各种融合基因的一种或多种下游激酶配体的抑制活性。 值得注意的是,这些化合物的体外抑制作用在病例报告和/或临床试验中并不都能转化为临床获益。
酪氨酸激酶抑制剂及其在体外抑制的蛋白质总结如下(部分筛选)。 目标列表不全面,这些药物也可能会抑制本文未列出的其他蛋白质。 这些被批准或临床测试的药物中的大多数是除了下文描述的激酶之外还具有针对各种融合基因的一种或多种下游激酶配体的抑制活性。 值得注意的是,这些化合物的体外抑制作用在病例报告和/或临床试验中并不都能转化为临床获益。
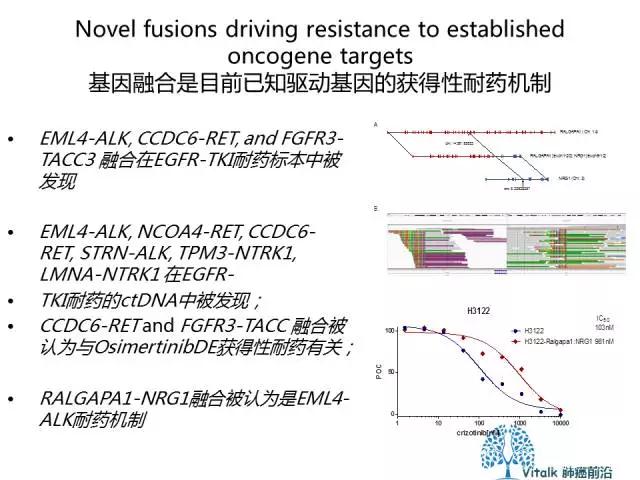
针对激酶融合的药物耐药性的机制
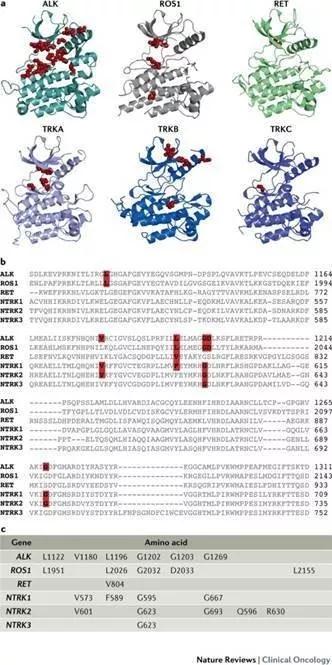
针对激酶融合的药物耐药性的机制分为两大类:“on target”改变,涉及融合本身的突变或扩增;以及涉及激活并行旁路途径的“off target”改变。 已经发现在ATP-Binding site周围 和solvent front 的获得性耐药突变为某些特定融合蛋白的常见on-target耐药机制。
这些突变可以通过增加对ATP的亲合力,通过改变在结合口袋中稳定药物所必需的氢键或引起空间干扰来阻碍药物结合。
有趣的是,在不同的融合激酶中看到了趋同进化 “convergent evolution”的现象,在不同的融合转录文本中观察到了同源基因耐药突变(上图C所示,大部分ROS1,RET,TRKA,TRKB存在的耐药突变与ALK中发现的耐药突变为平行进化同源基因)
激酶抑制剂对特定耐药突变的抑制活性(in vitro)
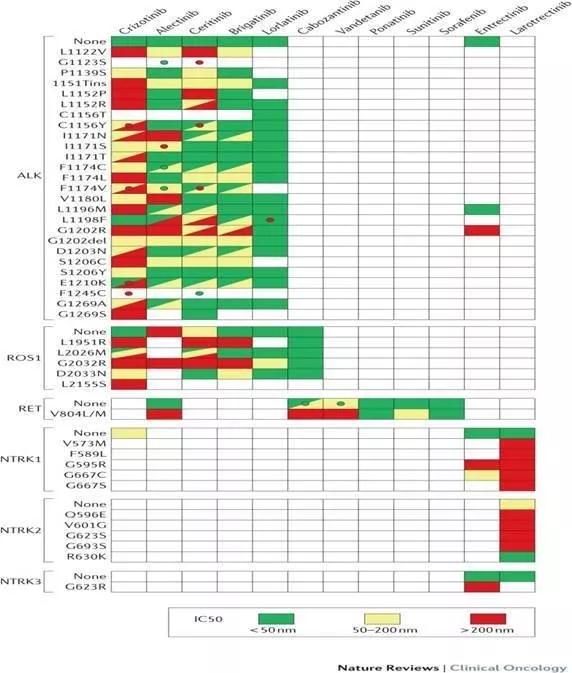 激酶抑制剂对特定耐药突变的抑制活性(in vitro)。怎对特定耐药突变位点进行激酶抑制剂的筛选用彩色图表表示(绿色表示一个IC50 < 50 nM,黄色表示50 - 200nm的IC50,红色代表的IC50 > 200nm)。
激酶抑制剂对特定耐药突变的抑制活性(in vitro)。怎对特定耐药突变位点进行激酶抑制剂的筛选用彩色图表表示(绿色表示一个IC50 < 50 nM,黄色表示50 - 200nm的IC50,红色代表的IC50 > 200nm)。
Fusions with approved /reported drugs
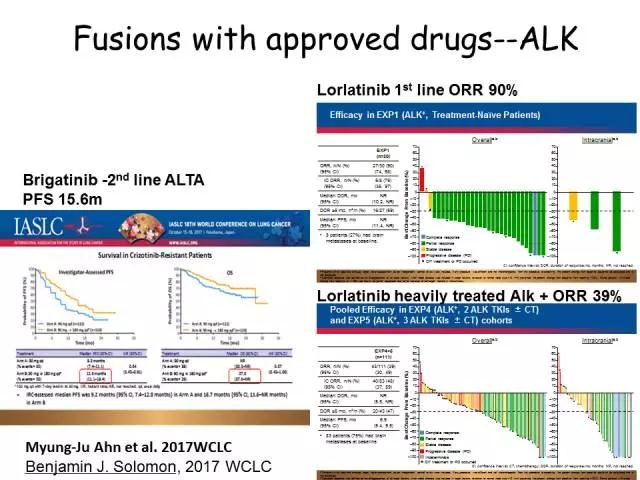
 、
、
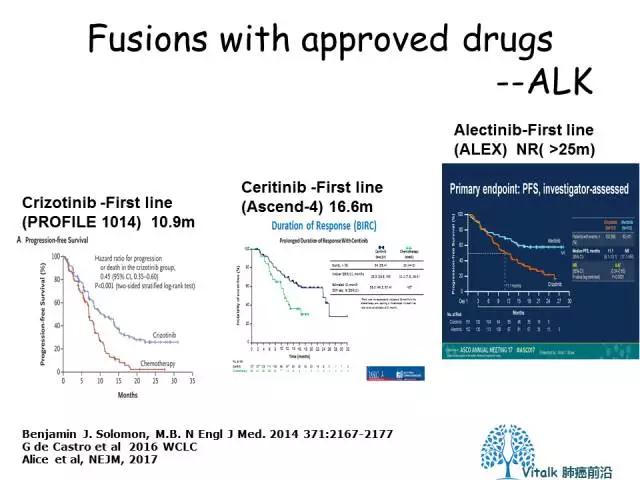
ALK融合是目前III期临床实验数据最丰富的融合驱动基因,这条通路单药治疗的天花板不断被被突破,ALEX一线超过25个月,是前所未有的胜利,同时PROFILE1014 长期生存超过5年。这个领域的研发活力转化成病人额长期生存,没有比这个更好的事情。
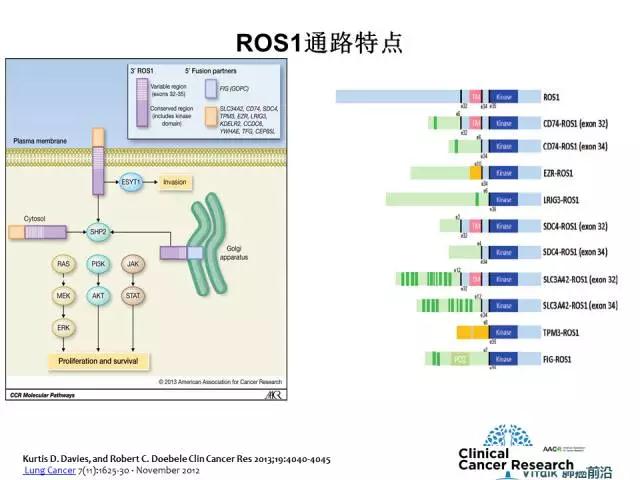
人类ROS1基因定位于6q21染色体,属于酪氨酸激酶胰岛素受体基因,编码具有酪氨酸激酶活性的嵌合蛋白(RTK)。ROS1基因发生重排时丢失细胞外区域,保留跨膜区和胞内酪氨酸激酶区域,重排位点主要发生在ROS1基因的32~36 外显子。
NSCLC中与ROS1重排的伙伴基因众多,目前,在NSCLC患者及细胞株中已发现13个不同的ROS1 融合基因型,;在NSCLC中ROS1 基因主要与SLC34A2、CD74发生融合,并持续激活ROS1 酪氨酸激酶区及下游JAK/STAT、PI3K/AKT、RAS/MAPK等信号通路,进而引起肿瘤的发生;
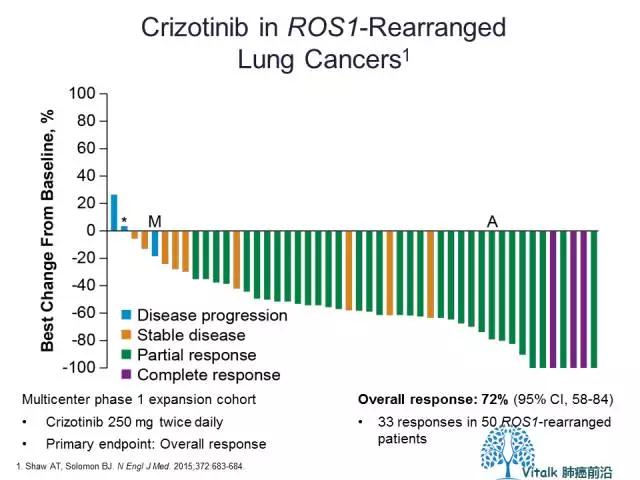
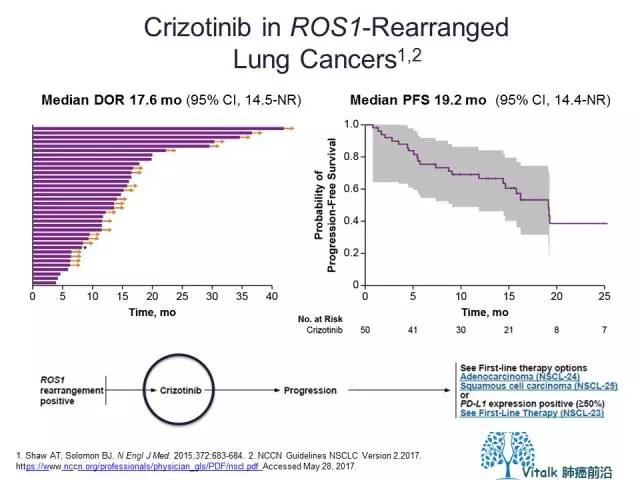
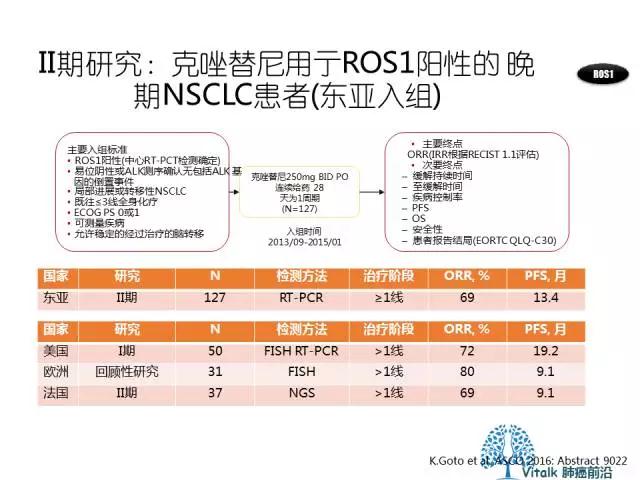
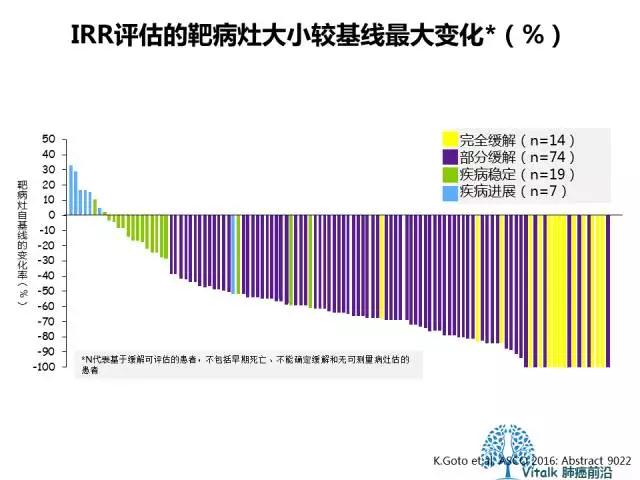
2014年11月,Alice shaw在NEJM上报道了I期临床研究PROFILE1001中ROS1扩大队列的结果,数据来自50位入组的携带有ROS1融合的病例,crizotinib在这一人群出达到ORR72%和PFS19.2m可观的长期疾病控制时间。值得注意的是,在2015年JCO上发表的一项来自欧洲32例ROS1阳性NSCLC回顾性分析提示,crizotinib的中位PFS为9.1m。
2016年ASCO上报道了一项克唑替尼治疗ROS1晚期NSCLC的II期研究,纳入了127例东亚患者,(中国患者 74 例)经 RT-PCR 确诊的 ROS1 阳性晚期NSCLC患者,结果提示整体患者和中国患者的 CR 分别为 11.0% 和 12.2%,PR 分别为 58.3% 和 56.8%,8 周疾病控制率为 88.2% 和 90.5%,中位首次缓解时间均为 1.9 月,中位无进展生存为 13.4 个月和 12.9 个月。该研究结果与此前Alice T Shaw在2014年发表于NEJM的数据相一致,但由于欧洲的EUROS(中位PFS9.1m,2015JCO)
中国CFDA于2017年10月中旬批准crizotinib用于ROS1阳性NSCLC一线治疗
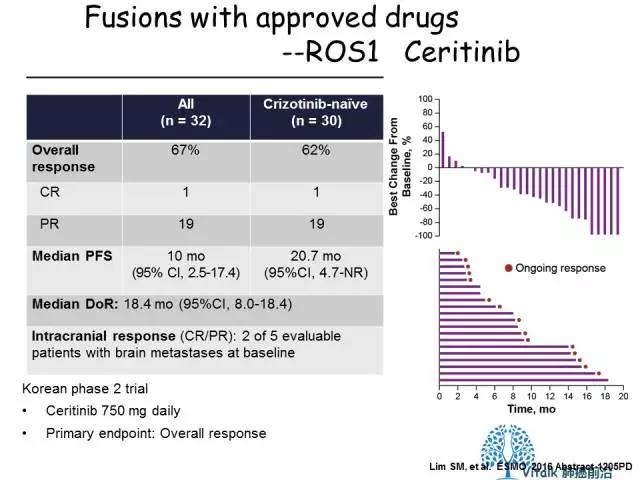 Ceritinib用于ROS1重排NSCLC: 一项韩国的II期临床研究(NCT01964157)
Ceritinib用于ROS1重排NSCLC: 一项韩国的II期临床研究(NCT01964157)
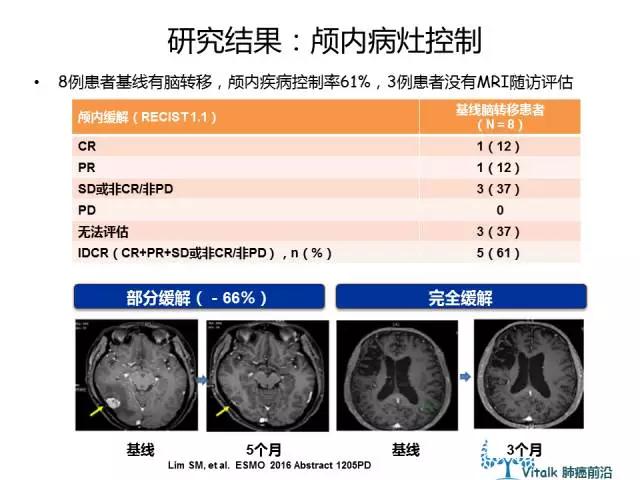
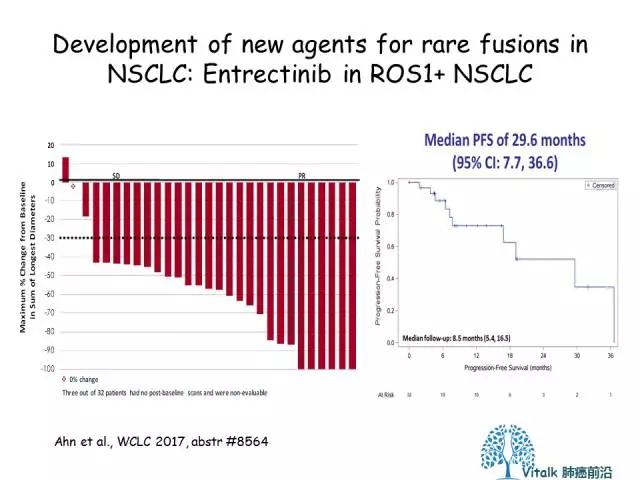
2017年WCLC上报道了一项多激酶抑制剂Entrectinib(ROS1,TRK1/2/3)应用于ROS1融合NSCLC的数据(来自STARTRK-2 (Phase 2), STARTRK-1 (Phase 1), and ALKA-372-001 (Phase 1) )研究;在未经TKI治疗的ROS1-NSCLC中,Entrectinib达到86%ORR(12/14),中位PFS长达29.6m。
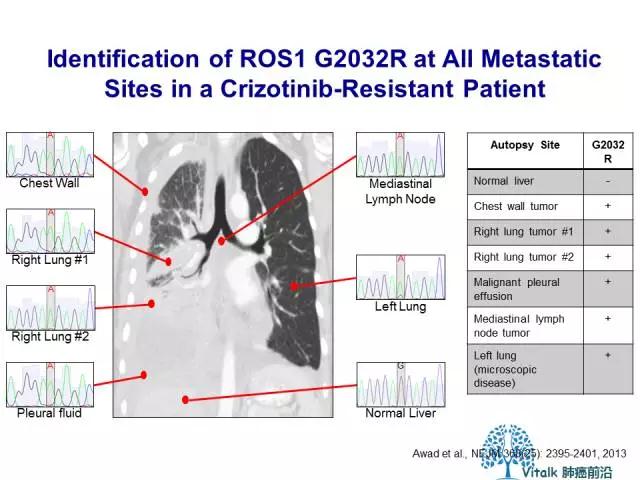
对crizotinib的获得性耐药,已知的机制包括 ROS1 G2032R和D2033N突变,能够被cabozantinib或Lorlatinib克服,目前已经有临床研究正在进行。
Zou, H. Y. et al. PF-06463922 is a potent and selective next-generation ROS1/ALK inhibitor capable of blocking crizotinib-resistant ROS1 mutations. Proc. Natl Acad. Sci. USA 112, 3493–3498 (2015).
Drilon, A. et al. A novel crizotinib-resistant solvent-front mutation responsive to cabozantinib therapy in a patient with ROS1-rearranged lung cancer. Clin. Cancer Res. 22, 2351–2358 (2016).
Katayama, R. et al. Cabozantinib overcomes crizotinib resistance in ROS1 fusion–positive cancer. Clin. Cancer Res. 21, 166–174 (2015)
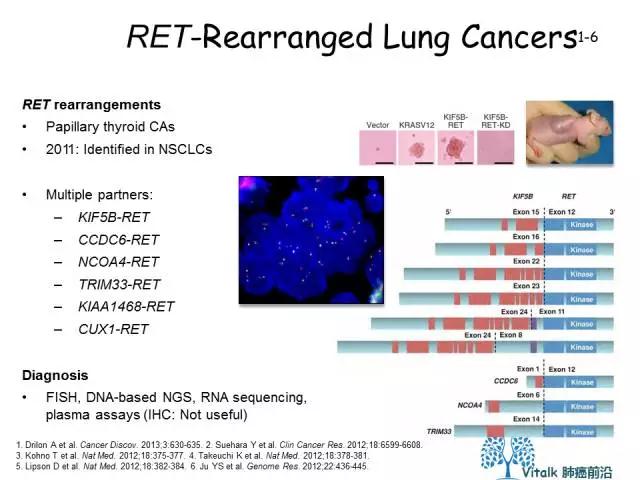
RET 基因位于10号染色体上,编码属于受体酪氨酸激酶(RTK)RET家族RTK的。RET重排在2012年被确认为NSCLC的一种新的驱动癌基因,发现于1-2%的NSCLC患者中 Nature Medicine 18, 378–381 (2012),在年轻NSCLC(〈60y),不吸烟/少吸烟者中更常见。KIF5B-RET是主要融合型.(Drilon A et al. Lancet Oncol. 2016;17:1653-1660.)
在FDA已经批准的许多其他恶性肿瘤的药物中,已经被证明具有抗RET重排活性的有,凡德他尼,索拉菲尼,舒尼替尼,cabozantinib
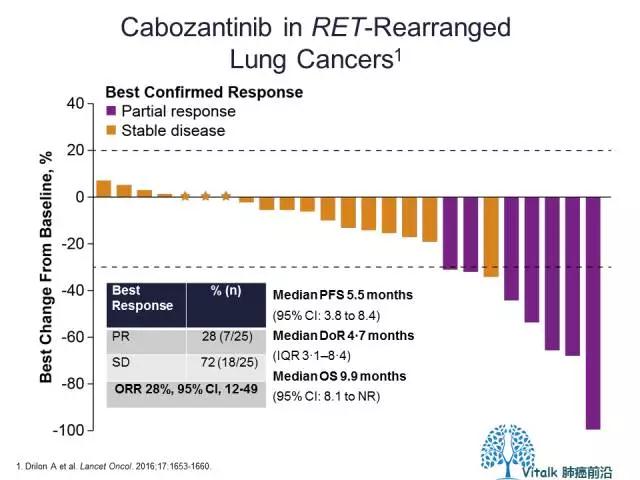 一项研究Cabozantinib用于RET融合NSCLC的Phase II证实cabozantinib在这一人群的ORR为28%,中位PFS为7m。
一项研究Cabozantinib用于RET融合NSCLC的Phase II证实cabozantinib在这一人群的ORR为28%,中位PFS为7m。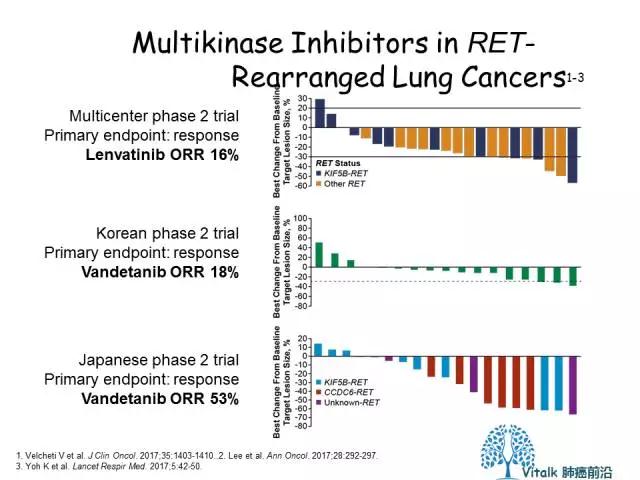
一项在日本完成的Phase II,发现Vandetianib的有效率为53%,但有意思的是,一项来自韩国的补充数据显示ORR仅有18%。
总而言之,对于RET融合NSCLC,已知的TKI抑制剂都仅仅表现出中度的活性(相比于ALK融合,和ROS1融合),为了获得更大的临床疗效,仍然需要探索更有效的药物或联合方案。
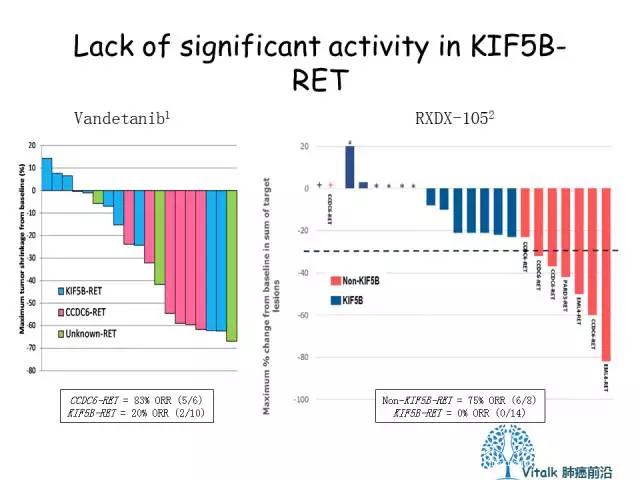 不同融合类型对于肿瘤应答的影响,在ALK融合和ROS1融合引起关注,同在,从2016年ASCO报道的RXDX105(Ignyta的另一个小分子抑制剂)的数据可以看出,KIF5B-RET融合对RXDX105缺乏应答,而非KIF5B-RET融合的应答率为83%。
不同融合类型对于肿瘤应答的影响,在ALK融合和ROS1融合引起关注,同在,从2016年ASCO报道的RXDX105(Ignyta的另一个小分子抑制剂)的数据可以看出,KIF5B-RET融合对RXDX105缺乏应答,而非KIF5B-RET融合的应答率为83%。
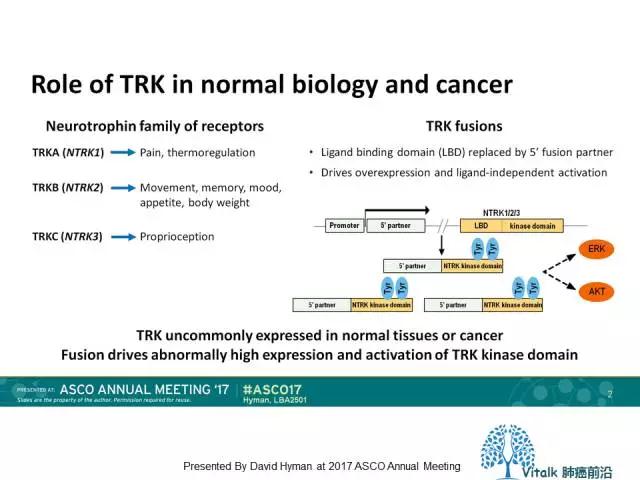
•NTRK1 fusion originally identified in 19821,2 •NTRK1 fusions first identified in NSCLC in 20133 •MPRIP-NTRK1 and CD74-NTRK1 •NTRK fusions <1% in NSCLC •Oncogene fusions also involve NTRK2 and NTRK3 with multiple gene partners
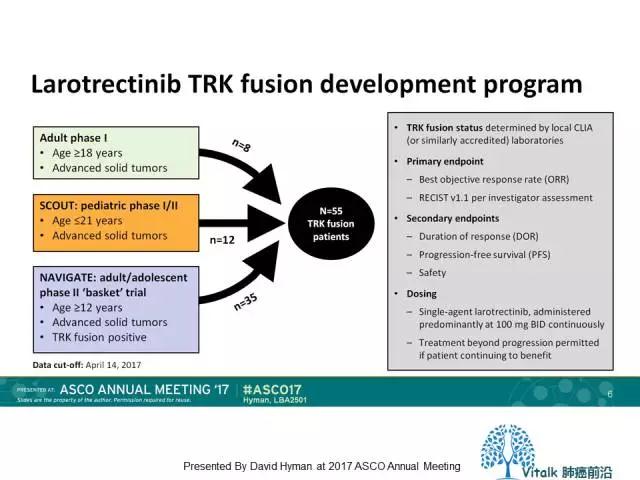
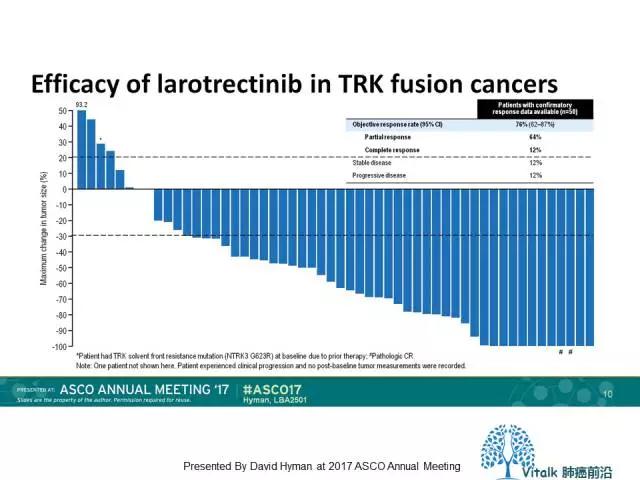
2017年ASCO报道了一项关于basket-trial,在涵盖了17种肿瘤类型携带TRK融合的患者验证了Larotrectinib的临床疗效,肿瘤应答率达到76%,中位PFS仍未达到,2017年5月12日FDA授予Larotrectinib在NTRK融合恶性肿瘤中的“Orphan drug designation “的称号。
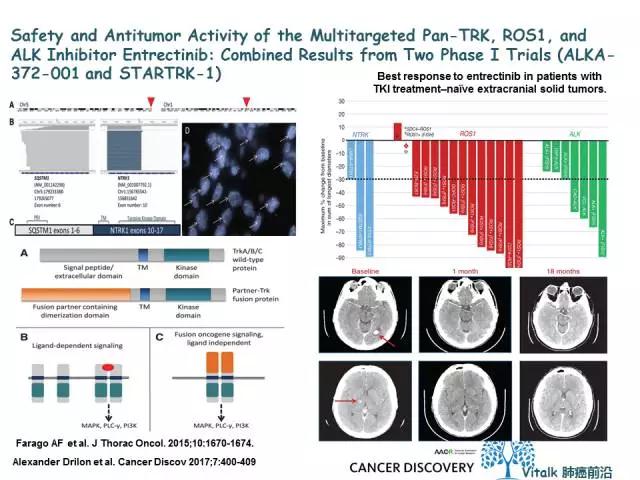 在 AACR 2016年会上报告的两项研究——STARTRK-1 研究和 ALKA-372-001 研究的数据显示,Entrectinib 治疗多种融合基因实体瘤患者均显示出了可观的疗效,客观缓解率达到79%,并对原发性脑瘤和脑转移表现出良好的效果。
在 AACR 2016年会上报告的两项研究——STARTRK-1 研究和 ALKA-372-001 研究的数据显示,Entrectinib 治疗多种融合基因实体瘤患者均显示出了可观的疗效,客观缓解率达到79%,并对原发性脑瘤和脑转移表现出良好的效果。
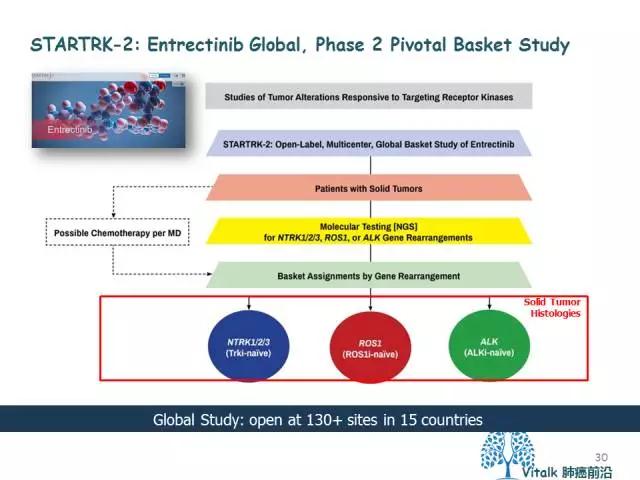 目前,已启动更大样本量的STARTRK-2 II期研究(basket trial),以证实在STARTRK-1和ALKA-1试验中所观察到的研究结果。STARTRK-2 II期研究纳入了NTRK1/2/3、ROS-1和ALK重排患者。
目前,已启动更大样本量的STARTRK-2 II期研究(basket trial),以证实在STARTRK-1和ALKA-1试验中所观察到的研究结果。STARTRK-2 II期研究纳入了NTRK1/2/3、ROS-1和ALK重排患者。
过去几十年来,在精准肿瘤学领域取得了巨大进步。
融合型驱动基因的检测技术和药物研发,包括含有ALK和ROS1的融合蛋白是最成功的例子之一,这两个领域的进展足可以成为驱动基因理念的佐证。大规模测序工作已经确定了几种癌症的罕见致癌融合。重要的是,许多这些融合已被证明是可被靶向的目标,或者具有极佳的研究前景。在某些情况下,与存在在相同基因上的点突变相比(如FGFR2 / 3),已经证明基因融合对靶向治疗具有更高的敏感性。由于几种致癌融合的出现率低,在典型的I / II期试验中临床进行试验似乎是不切实际的。设计针对具有特定遗传异常的患者的篮子试验,无论组织学或肿瘤类型如何,提供了一种有效的方法来研究这些罕见改变的临床意义。











 苏公网安备32059002004080号
苏公网安备32059002004080号


