
什么是TAM细胞?如何在“瘤社会”中有效识别TAM细胞
TAM细胞是浸润或邻近肿瘤组织区域内,从属巨噬细胞系的一类肿瘤相关免疫细胞。也有将其中发挥免疫抑制及促肿瘤作用的特定M2形态巨噬细胞定义为狭义的TAM。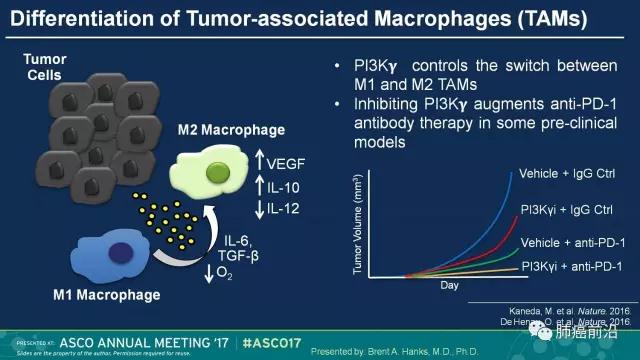
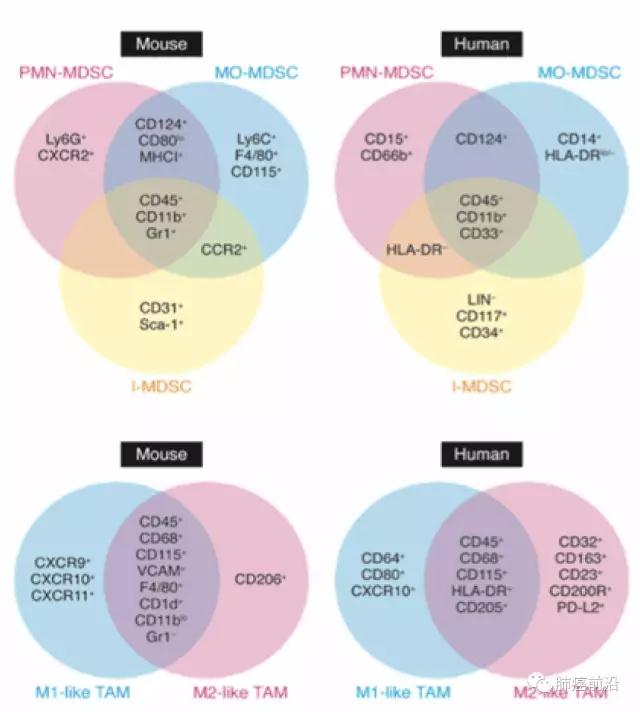
识别TAM是开展研究的第一步,目前,对于TAM的研究,主要利用流式细胞分析技术而非免疫组化。通常用来识别人类巨噬细胞的标记为CD68,但是在肿瘤组织中,某些间质细胞,甚至某些肿瘤细胞本身也会表达CD68,所以在进行相关研究结果分析中,一定要充分考虑各种可能性。
在TAM群体中,M2形态作为被肿瘤细胞“策反”的群体,发挥免疫抑制及促肿瘤作用,研究M2形态细胞所占比及其影响因素,是探讨可能影响肿瘤免疫环境的重要内容,通常用CD163作为M2形态TAM细胞的特异性标记物。
TAM细胞从何而来
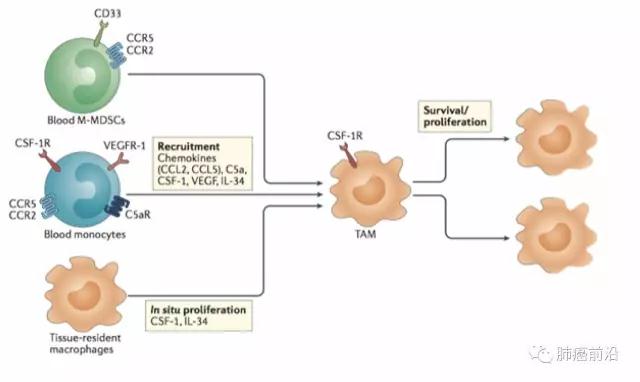
在很长一段时间内,普遍认为,肿瘤炎性环境的巨噬细胞,是受趋化作用由外周募集而来,并由单核前体细胞在局部环境生成的。但是目前研究表明,在部分器官,巨噬细胞(例如,大脑中的小胶质细胞)是由胚胎期和胚胎发育过程中定植局部前体细胞生成,而不是起源于外周循环的单核细胞。虽然局部胚胎前体细胞发育而来的巨噬细胞对于TAM社群的构成、功能影响尚不明确,但已有研究表明这种来源途径并不能维持肿瘤炎性环境中TAMs的数量,也就是说TAM如果需要持续对肿瘤进展产生影响,就必须依靠不断从外周循环中募集。
而就目前对于循环中的TAM前体细胞的了解,普遍认为M-MDSC及单核细胞系是TAM的主要来源。MDSC(monocyte-related myeloid-derived suppressor cells)是一种在病理环境下多见,免疫抑制相关的骨髓来源细胞。CD163为其主要标记。在鼠源骨髓细胞分型中,又可以根据Ly6C+/Ly6C-及Ly6C-/Ly6G+分为单核细胞相关(M)及粒细胞(G)相关MDSC。而其中M-MDSC可以受多种趋化因子作用,转化为TAM细胞。
而外周循环中,传统意义上的外周炎症相关单核细胞系,同样可以受多种细胞因子(CCL2, CCL5, C5a, CSF-1, VEGF, IL-34)募集,转运至肿瘤环境,持续为肿瘤环境提供TAM细胞。
综上,TAM细胞可由局部定植前体细胞直接分化而成,但这种来源并不对局部肿瘤环境TAM浓度起决定作用。机体主要通过募集外周循环中的MDSC及单核细胞系细胞至肿瘤环境,成为TAM源源不断的来源。
两面派的TAM细胞
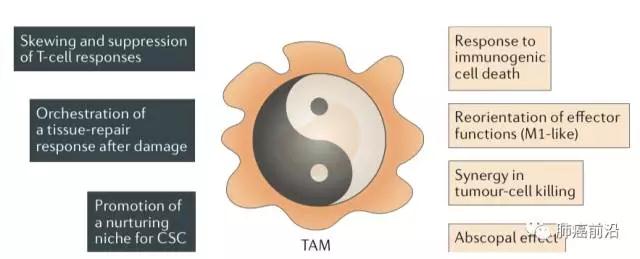
作为免疫环境中的两面派,TAM细胞发挥着“阴阳”两向作用,即肿瘤杀伤作用及促肿瘤作用。而根据作用不同,分为两向细胞, M1及 M2。 M1 巨噬细胞主要与验证、吞噬、攻击相关;M2形态则主要参与免疫抑制、纤维化形成、组织修复。前文提到,TAM在过去一直被认为是一种M2局势细胞,发挥促肿瘤作用,目前研究表明,其实TAM 细胞群体处于 M1 及 M2 两种形态之间不断转变的状态 (称为极化作用,polarization),各形态所占比受收肿瘤环境内不同激素种类及浓度而定。但是目前对于相关转变的详细机制研究尚浅。
目前针对TAM的治疗手段,及临床获益情况
目前针对TAM的干预思路主要有抑制驱动因素,及直接靶向巨噬细胞等。
针对TAM细胞募集诱导因素
前文所诉,肿瘤社会发挥作用的相关巨噬细胞,是由持续外源细胞“迁徙”而来,而细胞因子的趋化作用是主要动力,目前分别针对CCL2及CLL5的抗体已在临床试验中进行了相关验证。小鼠实验表明,CCL2抗体的应用能有效抑制小鼠瘤体的生长,及远处播散。但是早期临床试验表明,CCL2抗体Carlumab,在乳腺癌、肺癌等实体瘤患者中虽然可以良好耐受,但是并没有获得有效缓解。针对CCL5的受体拮抗剂——Maraviroc,在CRC患者中,获得部分缓解,进一步临床试验及联合传统用药疗效分析实验均在进行中。
针对CSF-1/CSF-R 轴抑制治疗
CSF-1R主要在单核巨噬细胞系表达,CSF-1是其主要促生长、分化因子,所以针对CSF-1/CSF-1R轴可以直接作用于TAM或其前体细胞。
针对CSF-1R的人源性单克隆抗体emactuzumab (RG7155),小鼠实验证明,其可以有效减少肿瘤环境TAM细胞浓度,并增加CD8+/CD4+T细胞比例。Emactuzumab应用前后的穿刺病理标本提示在人体中发生了同样的改变。在骨巨细胞瘤(往往存在CSF-1R过表达)患者中,emactuzumab使得93%患者获得有效缓解。
另一个口服CSF-1R抑制剂Pexidartinib由于可以通过血脑屏障,被用于复发性胶质瘤治疗,尽管多数患者耐受良好,但是II期临床试验受试患者中并无有效缓解。而另一个小分子抑制剂,BZL945,在前期实验研究中,被证实可以延缓胶质瘤进展并有效延长生存期,但相关机制分析,最终发挥作用并非通过减少环境中TAM细胞浓度,而是对M2形态细胞进行再“教育”。
目前对于TAM细胞的靶向治疗尚处于早期临床研究阶段,疗效并不确切。
TAM与immune-checkpoint blockade的相关性
目前,以PD-1/PD-L1拮抗剂为主的免疫检查哨抑制剂(immune checkpointinhibitors)在越来越多的肿瘤治疗中取得了确切的临床疗效,由于单核巨噬细胞系是肿瘤免疫环境的重要组成成员,所以,研究TAM可以为其提供疗效预测工具亦或是协同治疗位点。
TAM细胞表面即可表达PD-1的配体PD-L1及PD-L2,而这些配体表达水平受生长因子及周围乏氧环境影响,目前,TAM细胞表达相关配体在PD-1/PD-L1治疗中是否具有特殊意义,尚需进一步的验证,近期一项发表于Nature的文章揭示了免疫检查点抑制剂PD-1/PD-L1除传统观点认为的通过影响T细胞实现抗癌外,尚可以通过结合TAM表面相关配体,从而恢复其抑癌作用,所以在效应T细胞之外,TAM同样是我们需要争取的重要角色。
而TAM细胞是否能作为PD-1/PD-L1拮抗剂是否有效的预测因子,尚需进一步实验验证。
众所周知,肿瘤产生免疫抑制的机制复杂多变,PD-1/PD-L1抑制剂只能使部分患者群体收益,那么探讨其相关耐药及失效原因变得十分必要,M2形态TAM细胞可以通过多种途径抑制效应T细胞,是肿瘤细胞逃逸杀伤作用,而这些途径是否可以补充抑制PD-1通路后的肿瘤免疫抑制作用。《Science Translational Medicine》的一项研究通过活体显微成像技术发现,在肺癌和黑色素瘤模型小鼠中,在经历PD-1抗体处理后,巨噬细胞可以通过吞噬作用,特异性的从CD8+T细胞中抢夺PD-1抗体,使其失效。











 苏公网安备32059002004080号
苏公网安备32059002004080号


