冷凝集素综合征(CAS)是自身免疫性溶血性贫血(AIHA)的一种形式,最常与淋巴增殖性疾病或感染相关。其在乳腺癌中罕见,且可能由全身系统性治疗诱发。本文报告一例50多岁女性患者病例,该患者2019年确诊乳腺癌,经手术、辅助化疗及放疗后,接受3年内分泌治疗。其后出现骨和肝转移,一线使用瑞波西利联合来曲唑部分缓解,进展后换用氟维司群,再次进展后接受紫杉醇三线治疗。但在四次周疗后,患者因严重贫血入院,确诊为CAS。经及时干预及多学科处理后,患者血液学指标部分恢复,但停用紫杉醇后仅短暂获益,最终患者死亡。
该病例提示,紫杉醇在转移性乳腺癌治疗中可能引发罕见而严重的免疫并发症——CAS,凸显了治疗过程中密切监测的重要性。尽管早期识别、多学科协作与及时处理可带来一定改善,但患者预后最终仍取决于恶性肿瘤的进展。
紫杉烷化疗后并发冷凝集素综合征
乳腺癌是女性最常见的恶性肿瘤,也是全球癌症相关死亡的主要原因。在转移性疾病中,贫血是常见的并发症,最常源于治疗引起的骨髓抑制、营养缺乏或骨髓浸润。较少见的情况下,贫血可能源于自身免疫机制,如AIHA。AIHA是一种罕见的溶血性贫血,由自身抗体攻击红细胞引起,通常具有温度依赖性。它包括冷抗体型AIHA,进一步分类为原发性冷凝集素病(CAD)、阵发性冷性血红蛋白尿(PCH)和继发性冷凝集素综合征(CAS)。冷抗体型AIHA很少有与实体瘤相关的报道。
虽然冷抗体型AIHA偶尔可作为副肿瘤表现出现,但其与全身治疗的关联提示了药物诱导机制的可能性。在此类病例中,药物可能触发识别红细胞表面抗原的抗体形成,并在低温下激活经典补体途径。这些抗体可结合红细胞,促进补体沉积,最终导致血管内或血管外溶血。
在抗癌治疗中,以紫杉烷类为基础的方案偶尔与免疫介导的溶血有关。意识到这种潜在并发症至关重要,因为及时识别可直接影响治疗决策,通常需要停用致病药物、调整全身治疗方案,并优先进行多学科护理。除了改变肿瘤治疗轨迹外,这对预后也有重大影响。
在此,我们报告一例转移性乳腺癌患者在接受紫杉烷类化疗后发生CAS的病例。
病例介绍
患者女,年龄50-59岁区间,既往有肥胖、高血压、血脂异常和焦虑病史,于2019年诊断为左乳癌。组织病理学显示为非特殊类型浸润性癌,II级,雌激素受体(ER)阳性,孕激素受体(PR)阳性,HER2阴性。患者接受了肿瘤切除术,随后接受多柔比星/环磷酰胺辅助化疗,继以紫杉醇治疗(图1)。治疗过程并发轻度毒性反应,包括恶心、呕吐、乏力和周围神经病变。放疗于2020年8月完成,随后开始他莫昔芬治疗。

图1转移性乳腺癌合并CAS患者的临床诊疗时间轴
本图概括了患者从乳腺癌初诊开始,历经辅助治疗、确诊转移、序贯全身治疗、CAS的发病与诊治,直至最终转为姑息治疗及死亡的关键临床节点。图中日期(月/年)标示了各项主要临床事件或干预措施的启动时间。
2022年2月,PET-CT显示弥漫性骨转移、单发肝脏病灶和胰周淋巴结肿大。肝活检证实为转移性乳腺癌(ER/PR阳性,HER2阴性)。诊断为转移性疾病后,启动瑞波西利联合来曲唑作为一线抗转移治疗,达到部分缓解。进一步进展后,患者接受了氟维司群治疗,随后接受紫杉醇分别作为二线和三线治疗,后者始于2024年5月。在四次每周紫杉醇治疗(80 mg/m²/周)后,患者因严重贫血(血红蛋白 5.5 g/dL,院内最低值 2.8 g/dL)入院。
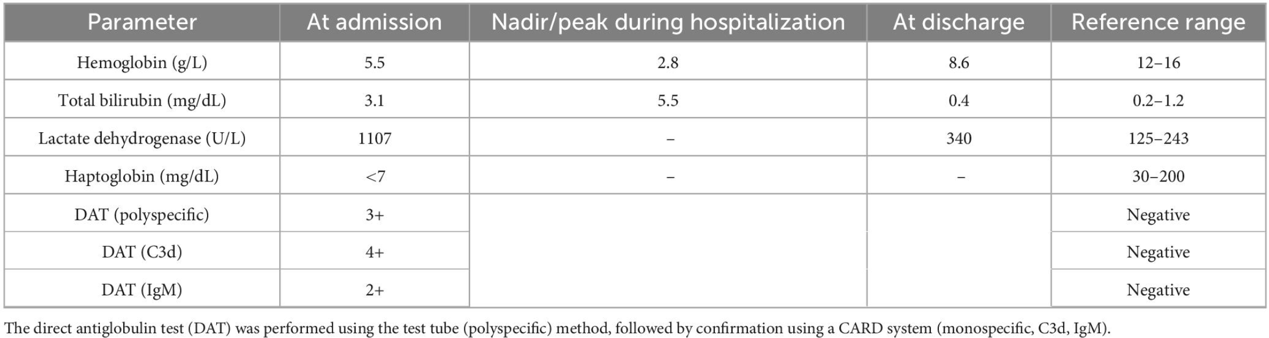
实验室评估显示溶血证据,包括总胆红素升高(3.1 mg/dL,峰值 5.5 mg/dL)、乳酸脱氢酶升高(1107 UI/L)、血清结合珠蛋白(haptoglobin)降低(<7 mg/dL)和网织红细胞计数为 7.3%(32 × 10⁹/L;参考范围 50–100 × 10⁹/L)。
此外,观察到直接抗球蛋白试验(DAT)强阳性(3+),其中C3d 4+,IgM 2+(表1)。
表1 患者入院、极值期及出院时的血液学与血清学指标演变
外周血涂片显示明显的红细胞凝集、多色性,可见少量球形红细胞,未见裂红细胞。玻片复温至37°C后制备,红细胞凝集散开。进行了全面的感染和自身免疫筛查,结果均为阴性。
患者需要通过输血加温器输注多次挽救生命的血液,并使用了6天的皮质类固醇(泼尼松龙,1 mg/Kg/天,每周减量 7.5 mg),但反应有限。由于患者在血红蛋白恶化和明显疾病进展时临床状态不稳定,无法评估骨髓浸润情况。肝炎血清学检测为阴性。随后启动利妥昔单抗 375 mg/m² 每周一次,连续四剂,结果显示临床和血液学改善,血红蛋白升至 7–8 g/dL,溶血指标下降。
出院后,未恢复紫杉醇治疗。几周后,患者开始接受节律性卡培他滨(500 mg,每日两次),最初耐受性良好,但于2025年1月因肝毒性(AST/ALT > 5 × ULN,胆红素 1.7 mg/dL)和临床状况恶化而停药。2025年2月,她开始接受节律性脂质体多柔比星(20 mg/m²,每2周一次),产生了短暂的生化指标改善,包括AST降低、胆红素正常化和CA15-3下降。然而,到2025年3月,PET-CT显示弥漫性肝脏和骨骼进展。全身治疗被永久停用,患者转为单纯的最佳支持治疗和姑息治疗,直至去世。
病例小结
冷凝集素综合征(CAS)是自身免疫性溶血性贫血(AIHA)的一种罕见亚型,由IgM自身抗体介导。与原发性冷凝集素病(CAD)典型的慢性溶血及单一C3d阳性特征不同,继发性CAS通常起病急骤,常伴发于感染或淋巴增殖性疾病,但在实体瘤治疗中极为少见。
在转移性乳腺癌患者中,贫血多归因于骨髓抑制或肿瘤浸润。然而,本例患者在紫杉醇治疗启动后短期内突发严重溶血,结合高滴度冷凝集素及C3d强阳性的血清学证据,有力支持了药物诱导性免疫性溶血的诊断,而非单纯的副肿瘤机制。其潜在机制可能涉及多重因素的交互作用:包括进展期疾病背景下的免疫激活、肝转移导致的免疫耐受受损,以及紫杉醇触发的冷反应性IgM抗体生成与补体激活。
在治疗策略上,继发性CAS的管理核心在于去除诱因及治疗基础疾病。尽管糖皮质激素常被尝试使用,但其在冷抗体型溶血中疗效有限且短暂;相比之下,利妥昔单抗因能清除潜在致病B细胞克隆,在本例及既往研究中显示出更确切的疗效。
本病例最核心的临床启示在于:罕见的治疗相关免疫并发症具有重塑晚期肿瘤患者治疗轨迹的破坏力。 尽管通过多学科协作实现了血液学指标的暂时恢复,但CAS的出现迫使紫杉醇永久停用,后续治疗被迫降级为强度较低的节律性方案。反复的肝功能损伤与累积毒性进一步限制了全身治疗的选择空间,从而加速了患者向单纯姑息治疗的过渡。
综上所述,本病例揭示了化疗药物(如紫杉醇)在抗肿瘤效应之外,可能诱发严重的免疫介导并发症。这提醒临床医师,在面对非典型贫血模式时,需将治疗相关的免疫机制纳入鉴别诊断。早期识别、血液学专家的及时介入以及治疗策略的灵活调整,是应对此类意外事件、尽可能延长患者生存获益的关键。哪怕在极少预期发生冷凝集素病的实体瘤领域,这种警惕性也至关重要。
Daniel Bandarra,Dina Rochate,Beatriz Gosalbez,et al.Cold agglutinin syndrome in a patient with metastatic breast cancer: a Case Report.Front Med (Lausanne). 2026 Jan 16:12:1711809. doi: 10.3389/fmed.2025.1711809. eCollection 2025.
排版编辑:肿瘤资讯-slb











 苏公网安备32059002004080号
苏公网安备32059002004080号


