肺癌是全球发病率和死亡率最高的恶性肿瘤之一,其中小细胞肺癌(SCLC)具有极高的侵袭性和早期广泛转移的高危特性,约70%的患者在确诊时已为广泛期(ES-SCLC),预后极差,5年生存率低于5%[1-3]。骨转移是SCLC常见的远处转移形式之一,骨转移不仅严重影响患者的生活质量,加重了SCLC的高危特性,还通过系统性免疫抑制进一步恶化预后[4, 5]。在免疫治疗时代,骨转移负面影响愈发凸显。因此,如何破解骨转移带来的系统性免疫抑制,成为提升SCLC骨转移患者疗效的当务之急。基于此,【肿瘤资讯】特邀平顶山市第一人民医院丁军红教授分享并点评一例ES-SCLC伴多发骨转移的患者,经地舒单抗联合免疫治疗后取得优异疗效的诊疗实践,该病例直观展示了地舒单抗在联合免疫治疗中的关键破局作用。
平顶山市第一人民医院呼吸内科一病区
擅长肺恶性肿瘤、支气管哮喘,慢性阻塞性肺疾病及肺间质纤维化等呼吸系统疾病的诊治
河南省生命关怀协会体外生命支持分会委员
河南省呼吸与危重症学会肺栓塞与肺血管疾病分会常务委员
河南省医院协会慢病健康管理分会第一届委员会委员
河南省老年学和老年医学学会委员
平顶山医学会呼吸学会委员
平顶山变态反应学会会员
病例介绍
一、基本情况
基本信息:患者,女性,35岁。
主诉:因腰痛3月余,发现肺占位3天。
现病史:患者于3个月前无明显诱因出现腰部疼痛,在当地医院尝试按摩理疗,效果不佳。后行腰椎磁共振检查,提示多处椎体骨质破坏,考虑为转移性病变。进一步行胸部CT检查,发现右肺下叶占位性病变。为求进一步诊治,遂来院就诊。病程中,患者无咳嗽、咳痰、咯血、胸闷、发热等不适。
个人史:患者育有一子,1岁。
既往史:平素健康状况一般,疾病史既往无,传染病史无。
二、辅助检查
体格检查:右下肺呼吸音低,可闻及干湿啰音。
胸部CT(2024年4月8日):1. 右肺下叶见不规则软组织密度影,大小约8.2*6.7cm。2. 右侧胸腔少量积液。3. 肝脏多发占位,考虑转移。
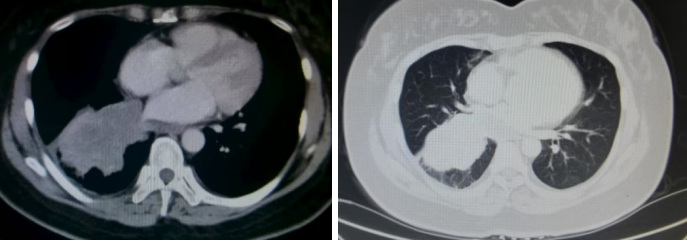
病理活检(2024年4月11日):右肺下叶活检组织结合免疫组化,病理诊断为 小细胞肺癌。免疫组化结果:CK7(-);CD56(+);CEA(-);CK(+);CgA(+);Ki-67(+50~75%);P63(±);P40(-);Napsin-A(-);CK5(-);TTF-1(+);Syn(+)。
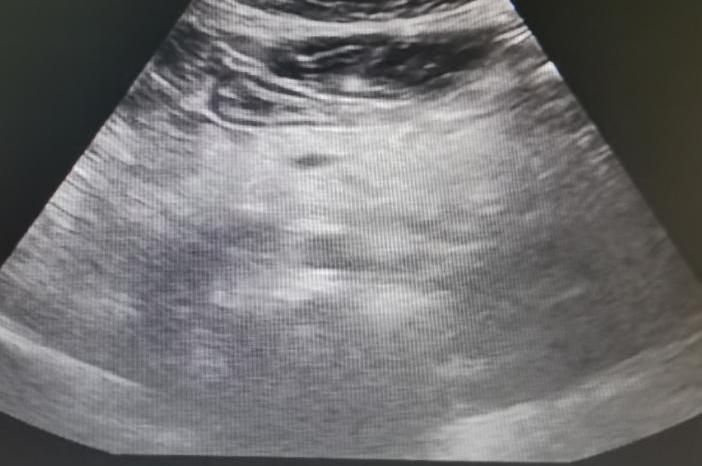
腹部超声(2024年4月11日):肝脏多发实性结节。
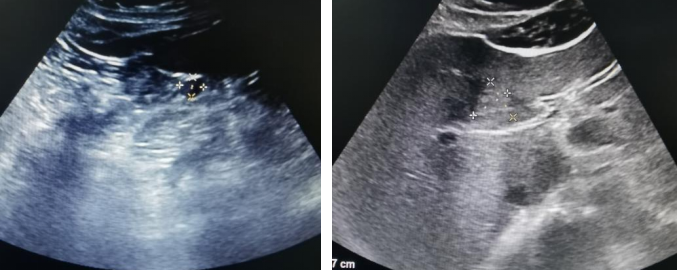
腹部超声(2024年4月11日)
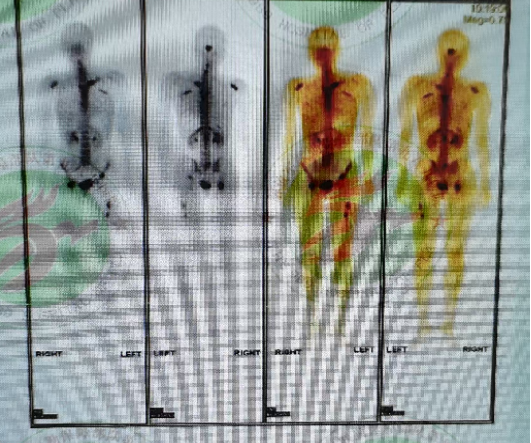
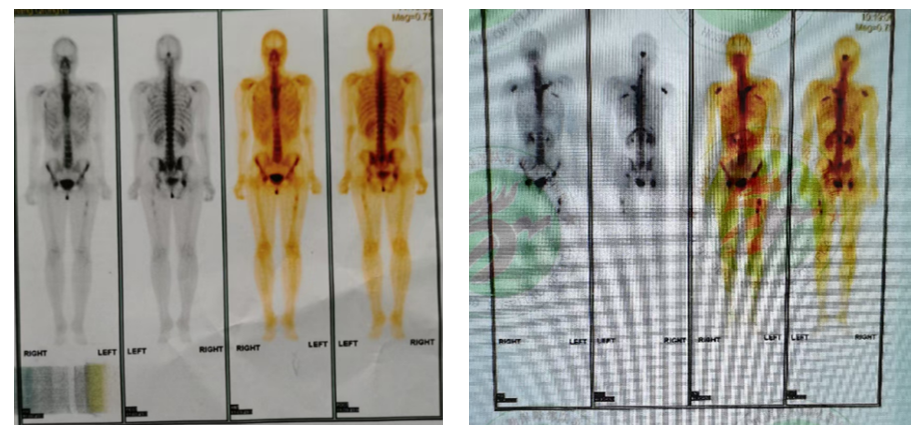
全身骨扫描(2024年4月11日):全身多处骨质核素代谢异常,考虑多发骨转移。
头颅MR(2024年4月13日):未见明显异常。
三、初步诊断
小细胞肺癌,肝继发恶性肿瘤,骨继发恶性肿瘤。
四、治疗过程与疗效评估
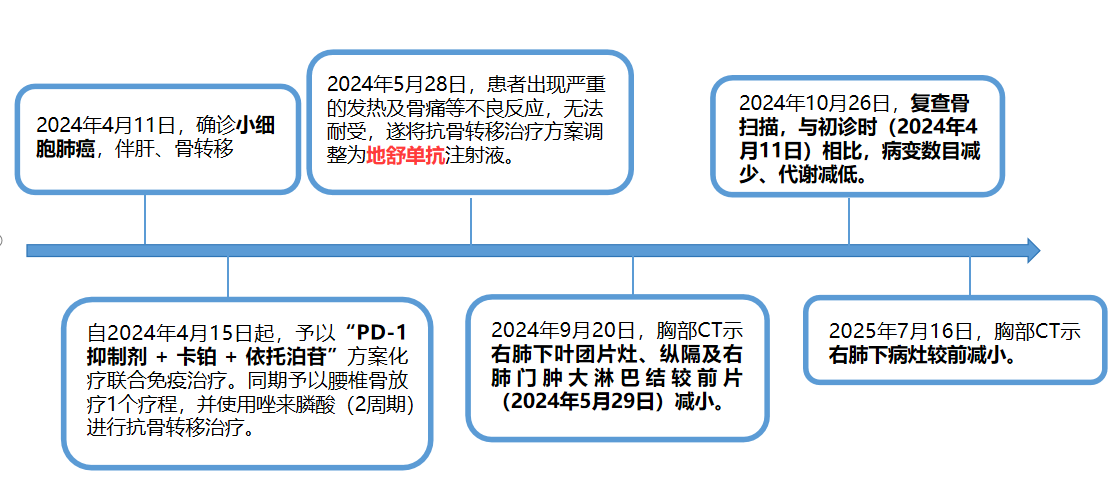
治疗方案:自2024年4月15日起,予以“PD-1抑制剂 + 卡铂 + 依托泊苷”方案化疗联合免疫治疗,同期予以腰椎骨放疗1个疗程。
疗效评估:
第一阶段: 2024年4月15日,联合使用双膦酸盐(2周期)进行骨保护治疗。
第二阶段:2024年5月29日,胸部CT示右肺下叶团片灶,较前减小。由于患者在使用双膦酸盐后出现严重的发热及骨痛等不良反应,遂将骨保护治疗方案调整为地舒单抗注射液。
第三阶段:2024年9月20日,胸部CT示右肺下叶团片灶、纵隔及右肺门肿大淋巴结,结合病史考虑肺癌并淋巴结转移性肿大,较前片(2024年5月29日)减小。后续治疗方案调整为“PD-1抑制剂单药维持治疗+地舒单抗抗骨转移治疗”。
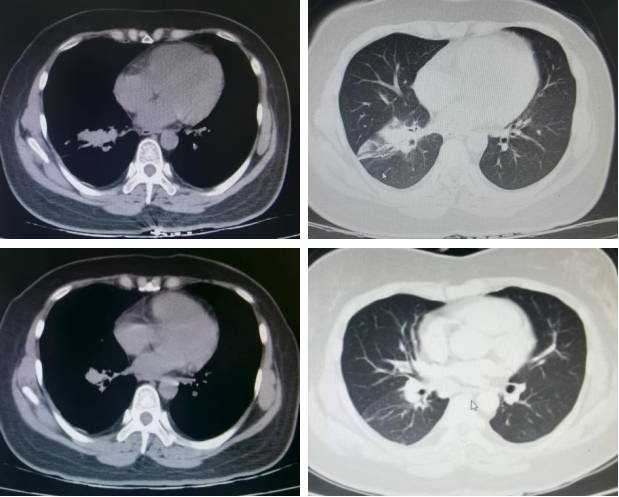
2025年7月16日:胸部CT示右肺下病灶较前减小。
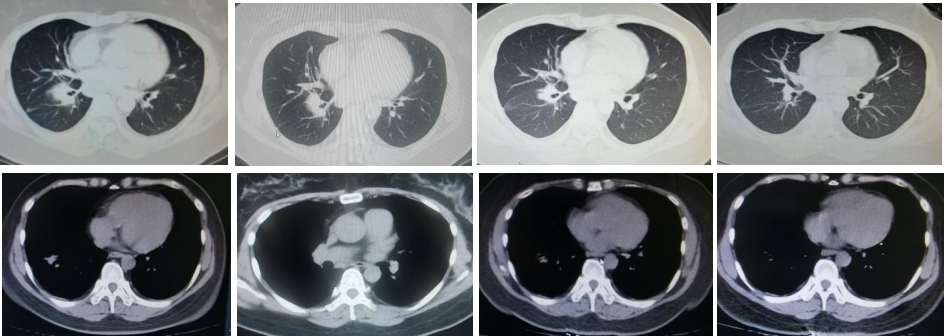
骨转移与肝转移的疗效评估:
2024年10月26日:复查骨扫描,与初诊时(2024年4月11日)相比,病变数目减少、代谢减低。双肾显影清晰。
2025年6月4日:肝胆胰脾超声示脂肪肝,胆囊积液。
五、病例总结
 1. 患者初诊时肿瘤广泛转移(肝脏、多发骨),首选免疫+化疗+抗骨转移治疗;
1. 患者初诊时肿瘤广泛转移(肝脏、多发骨),首选免疫+化疗+抗骨转移治疗;
2. 最初的抗骨转移治疗出现严重的不良反应后,患者的骨保护治疗调整为地舒单抗,目前颈椎及下肢疼痛症状控制,无胸腰椎疼痛症状,日常工作完全不受影响,ECT复查显示骨核素浓聚影明显变淡;
3. 抗肿瘤免疫治疗维持阶段同步联合地舒单抗治疗,局部骨转实现了良好控制,还大幅缩小了肺部及肝脏的转移灶,达到了联合用药协同增效的治疗效果,患者整体病情得到有效控制。
病例点评
丁军红教授:本病例为一例典型且具有启发意义的ES-SCLC合并多发转移的病例。患者年纪轻、病情重,通过规范且个体化的治疗,取得了理想的疗效。其诊疗过程,尤其是在骨转移管理策略上的调整,值得深入探讨。
一个重要的临床现象是,骨转移的存在往往预示着ICB治疗效果不佳。临床实践与多项回顾性研究PFS和总生存期(OS)通常劣于无骨转移的患者[6]。骨转移不仅是局部并发症,更能引发一种全身性的免疫抑制状态,从而削弱ICB药物对骨外病灶(如肺、肝脏)的治疗效果。该病例患者初诊时病情凶险,也印证了骨转移对肿瘤整体进展的负面影响。
近期发表于Cancer Cell 的一项研究揭示了其核心机制[5]。该研究证实,肿瘤细胞侵入骨骼后,会通过RANKL信号通路异常激活破骨细胞。这些被肿瘤“改造”过的破骨细胞会大量分泌骨桥蛋白(OPN),OPN通过循环系统到达全身各处肿瘤病灶,在肿瘤微环境中抑制一类对免疫治疗应答至关重要的CD8+ Tpex细胞亚群,从而导致全身性的免疫抑制。骨转移灶通过“破骨细胞-OPN”这一途径,远程削弱了免疫系统对全身肿瘤的攻击力。该研究在干预策略上具有重要启示:通过使用RANKL抑制剂地舒单抗,可以从源头上阻断破骨细胞的异常活化,进而显著降低血清中OPN的水平,打破免疫抑制的恶性循环。研究证实,ICB联合地舒单抗治疗,能够有效逆转骨转移带来的免疫抑制,显著增强对骨外病灶的控制并延长PFS。该研究结论将骨保护药物的临床认知提升至新的高度,即地舒单抗不仅可抑制骨破坏,同时扮演了免疫增强剂的角色,使其临床获益从局部拓展至全身。
本例ES-SCLC患者多发骨转移,肿瘤负荷大,病情非常凶险,但是通过“免疫+化疗”联合地舒单抗的综合治疗,取得了非常成功的治疗效果。患者因不良反应将骨保护药物更换为地舒单抗,患者在换用地舒单抗并联合免疫治疗后,不仅骨扫描病灶活性降低,同时肺部和肝部的病灶也出现了持续缩小。此外,多项大样本队列研究显示,SCLC骨转移患者的中位生存期通常为4-9个月,1年生存率低于20%[7, 8]。而此例患者无进展生存期(PFS)都已超过1年,这一结果非常令人惊喜。由此可推断,地舒单抗发挥了双重作用:一是通过抑制RANKL直接控制破骨细胞活性、治疗骨转移;二是通过抑制破骨细胞减少了免疫抑制因子OPN的产生,改善了全身的免疫状态,为PD-1抑制剂更好地发挥抗肿瘤作用创造了有利条件,实现了协同增效。该病例直观地展示了,对于接受免疫治疗的骨转移患者,选择地舒单抗不仅是处理骨骼问题,更是优化全身抗肿瘤治疗策略的重要组成部分。
综上所述,该病例提示,对于伴有骨转移且接受免疫治疗的肿瘤患者,骨保护药物的选择应超越单纯“预防SRE”的传统观念。以地舒单抗为代表的RANKL抑制剂,不仅能有效控制骨转移局部进展,更能通过其独特的免疫调节机制,与ICB治疗协同增效,为患者带来全身性的生存获益。未来仍需更多前瞻性临床研究来验证地舒单抗与免疫治疗联合的最佳模式,并探索血清OPN等生物标志物在预测疗效和指导治疗中的价值。
[1] Kim SY, Park HS, Chiang AC. Small Cell Lung Cancer: A Review. JAMA. 2025;333(21):1906–1917. doi:10.1001/jama.2025.0560
[2] Simpson KL, Rothwell DG, Blackhall F, Dive C. Challenges of small cell lung cancer heterogeneity and phenotypic plasticity. Nat Rev Cancer. 2025 Jun;25(6):447-462. doi: 10.1038/s41568-025-00803-0. Epub 2025 Apr 10. PMID: 40211072.
[3] Humera Khurshid et al. Systemic Therapy for Small-Cell Lung Cancer: ASCO-Ontario Health (Cancer Care Ontario) Guideline. JCO 41, 5448-5472(2023).
[4] Charpidou A, Tsagouli S, Gkiozos I, Grapsa D, Moutsos M, Kiagia M, Syrigos K. Bone metastases in patients with small cell lung carcinoma: rate of development, early versus late onset, modality of treatment, and their impact on survival. A single-institution retrospective cohort study. Clin Exp Metastasis. 2016 Jun;33(5):453-60.
[5] Cheng JN, Jin Z, Su C, Jiang T, Zheng X, Guo J, Li X, Chu H, Jia J, Zhou Q, Ding X, Zhang Y, Xu S, Dong F, Zhang Q, Yang X, Yang T, Cheng X, Zha H, Chen D, Wan YY, Liu X, Ye L, Tang H, Symonds ALJ, Li QJ, Jia Q, Zhu B. Bone metastases diminish extraosseous response to checkpoint blockade immunotherapy through osteopontin-producing osteoclasts. Cancer Cell. 2025 Jun 9;43(6):1093-1107.e9.
[6] Landi L, D'Incà F, Gelibter A, et al. Bone metastases and immunotherapy in patients with advanced non-small-cell lung cancer. J Immunother Cancer. 2019;7(1):316.
[7] Xue M, Chen G, Chen X, Hu J. Predictors for survival in patients with bone metastasis of small cell lung cancer: A population-based study. Medicine (Baltimore). 2021 Aug 27;100(34):e27070. doi: 10.1097/MD.0000000000027070. PMID: 34449503; PMCID: PMC8389941.
[8] Liu C, Yi J, Jia J. Diagnostic and prognostic nomograms for bone metastasis in small cell lung cancer. J Int Med Res. 2021 Oct;49(10):3000605211050735. doi: 10.1177/03000605211050735. PMID: 34693779; PMCID: PMC8551427.
排版编辑:肿瘤资讯-IRIS











 苏公网安备32059002004080号
苏公网安备32059002004080号


