SMARCA4突变是非小细胞肺癌(NSCLC)中关键的分子驱动事件,主要导致SWI/SNF染色质重塑复合物的功能缺失。在2021年世界卫生组织(WHO)胸部肿瘤分类中,SMARCA4缺失性未分化肿瘤(SMARCA4-UT)被确立为独立的特殊病理亚型。此类肿瘤具有极高的侵袭性,患者预后往往较差,且对常规一线治疗方案缺乏敏感性。【肿瘤资讯】特邀江苏省肿瘤医院于韶荣教授解读SMARCA4突变NSCLC的生物学基础、诊断标准与全病程管理新范式。
江苏省肿瘤医院 内科科副主任、肺癌亚专科负责人
南京医科大学优秀中青年学术带头人
江苏省肿瘤专业质控中心肺癌质控专委会 秘书长
江苏省抗癌协会肺癌专业委员会常委
江苏省抗癌协会化疗专业委员会常委
中国初保基金会肺癌生物标志物公益基金基金管理委员会常委
中国抗癌协会化疗专业委员会委员
国家抗肿瘤药物临床应用青年委员
江苏省医学会肿瘤学分会委员
江苏省整合医学研究会肺癌专业委员会委员
江苏省抗癌协会整合肿瘤专委会委员
加州大学旧金山分校访问学者斯坦福大学肿瘤中心访问学者
江苏省青年医学人才 江苏省“333高层次”人才 江苏省“六大高峰人才”
主持国家自然科学基金面上项目、江苏省省级重点研发计划(社会发展)项目等基金多项
获江苏省科学技术奖、江苏医学科技奖、江苏省医学新技术引进奖多项
SMARCA4基因及其生物学功能
SMARCA4基因位于染色体19p13.2,其编码的BRG1蛋白是高度保守的ATP依赖性染色质重塑复合物SWI/SNF的核心催化亚基。
生理功能:在正常细胞中,SWI/SNF复合物通过BRG1水解ATP提供能量,动态调节染色质的高级结构。在DNA损伤修复(DDR)过程中,该复合物被募集至损伤位点,通过拮抗多梳抑制复合物2(PRC2)移出核小体,促使染色质松弛并暴露特定靶基因位点,从而允许RNA聚合酶及转录因子结合,启动修复程序。
致癌机制:当SMARCA4发生失活突变或缺失时,SWI/SNF复合物因失去动力源而功能障碍。PRC2的抑制作用失去拮抗,导致染色质持续处于高度盘绕的紧缩状态,修复基因的启动子无法暴露,表达受阻。这种表观遗传调控失衡导致基因组不稳定性显著增加,最终驱动肿瘤的发生与演进。
SMARCA4突变肺癌的流行病学与分类
SMARCA4是SWI/SNF复合物中最常见的突变亚基,在全癌种中的突变率约为5%-7%,而在NSCLC中高达10%。根据突变对蛋白的影响,主要分为两大类:
I类:包括截断突变、融合或全缺失,导致BRG1蛋白表达完全缺失。
II类:主要为错义突变,表现为蛋白功能受损但表达尚存。在中国肺腺癌人群中,这两类突变均较为常见,且常伴随高肿瘤突变负荷(TMB)和低PD-L1表达。
2021年WHO正式将胸部SMARCA4-UT划分为一种特殊表型的上皮来源NSCLC。该亚型具有独特的生物学行为:
形态学:呈未分化状态及横纹肌样细胞特征。
分子特征:表现为BRG1和BRM的双重缺失,显著区别于传统的普通分化型NSCLC。
临床特征与病理诊断
临床图谱
SMARCA4缺失/突变肺癌表现为高度侵袭性,典型患者多为伴有重度吸烟史的中年男性(中位年龄约63岁)。临床表现为原发病灶巨大,易侵犯胸膜及脉管。初诊时远处转移率(尤其是骨与肝脏)高达84.2%,整体预后显著劣于野生型患者。
诊断路径:NGS与IHC的协同
免疫组化(IHC):BRG1表达缺失是关键指标。
基因检测(NGS):针对IHC阴性但临床高度怀疑的病例(如TTF-1/P40阴性、分化极差的肿瘤),应通过NGS补充检测,以防错义突变导致的IHC假阴性漏诊。
预后标志物1:Napsin A的表达具有分层价值,阳性表达通常预示该亚组患者有相对较好的生存获益(图1)。
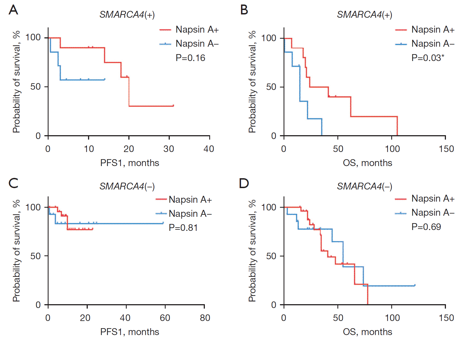
分子共突变谱系及其对预后的影响
SMARCA4突变常伴随复杂的基因组协同改变,构成独特的分子病理基础:
高频共突变:TP53(56%)、KEAP1(41%)、STK11(39%)及KRAS(33%)。
耐药特征:STK11与KEAP1的高频共存通常提示肿瘤对免疫检查点抑制剂(ICIs)存在原发性耐药。
生存获益分析2:SWI/SNF突变患者的预后显著较差,其中位总生存期(OS)由非突变组的90.90个月降至47.77个月。在相关亚基中,仅SMARCA4、SMARCA2和ARID1A突变与OS呈显著相关性,其中以SMARCA4突变的预后最差(中位OS仅25.54个月);具体而言,SMARCA4突变组的OS(37.7个月 vs. 85.3个月)及无进展生存期(PFS)(17.62个月 vs. 41.26个月)均显著短于非突变组(图2)。
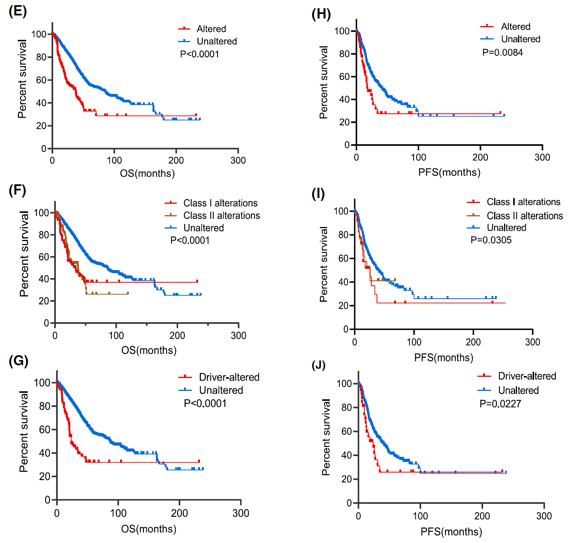
治疗困境与免疫治疗的抉择
由于SMARCA4突变常与EGFR/ALK/ROS1等经典驱动基因互斥,患者难以从常规靶向药物中获益。
免疫治疗(ICI)的争议:尽管SMARCA4突变常伴随高TMB,但其本身并非独立的强效免疫获益标志物。
基于共突变的分层效应2:
在接受免疫治疗的患者中,SMARCA4与KRAS共突变的存在显著削弱治疗获益,共突变患者的中位PFS仅为 2.1个月,显著劣于单突变患者的 4.4个月/4.33个月(P=0.0349)。这表明,该类共突变是预测免疫治疗疗效不佳的重要生物标志物。
此外,SMARCA4与STK11共突变时的PFS较单纯SMARCA4突变明显缩短(2.3个月 vs. 5.4个月);与之相反,SMARCA4与TP53共突变展现出协同增效作用,其PFS优于单纯SMARCA4或TP53突变者(5.65个月 vs. 2.3个月或3.17个月);此外,SMARCA4突变的存在与否并不会对KEAP1突变肺癌患者的免疫疗效产生显著影响(P=0.642)(图3)。
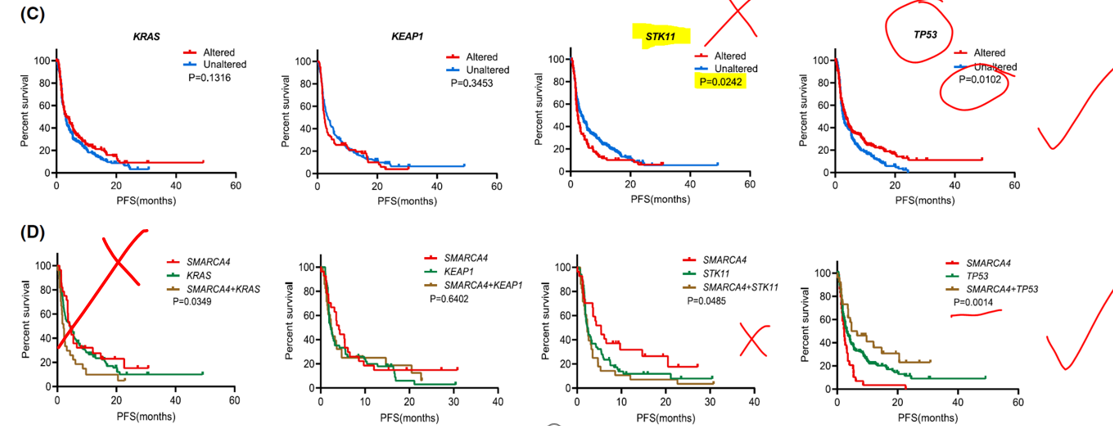
前沿治疗策略:“合成致死”与新型靶点
针对SMARCA4缺失导致的脆弱性,目前研究聚焦于以下方向:
CDK4/6抑制剂:SMARCA4缺失限制核心细胞周期调控因子CCND1的染色质可及性,使其表达下调。肿瘤细胞在G1-S期转化路径中缺乏代偿机制,从而产生“合成致死”效应。
旁系同源依赖:在SMARCA4缺陷背景下,肿瘤存活高度依赖其旁系同源蛋白SMARCA2。利用蛋白降解剂(如PROTAC)精准打击SMARCA2已成为极具前景的方向。
DDR通路干预:利用ATR抑制剂等阻断肿瘤细胞增强的DNA修复依赖,通过破坏其基因组稳定性实现靶向杀伤。
总 结
SMARCA4作为SWI/SNF复合物的核心催化亚基,通过调节染色质重塑维持基因组稳定性,其失活突变是驱动肺癌发生的关键表观遗传机制。在非NSCLC中,该突变(尤其是SMARCA4-UT亚型)表现出高度侵袭性、重度吸烟相关及极差预后等特征。临床诊断依赖IHC与NGS的协同判定。由于对传统靶向治疗不敏感,且免疫治疗疗效受TP53、STK11等共突变谱系的显著调控,临床治疗仍面临巨大挑战。目前,针对其分子脆弱性的“合成致死”策略(如CDK4/6抑制剂)、SMARCA2蛋白降解及DDR通路干预,正成为突破这一难治性肺癌治疗困境的前沿方向。
排版编辑:xiaodong
1. Transl Lung Cancer Res. 2024 ;13(8):1938-1949.
2. FEBS Open Bio. 2024;14(12):2086-2103.











 苏公网安备32059002004080号
苏公网安备32059002004080号


