甲状腺癌已成为我国发病率排名第三的恶性肿瘤,每年新发病例超过46万,其中绝大多数为分化型甲状腺癌。在这一庞大患者群体中,BRAF基因突变,尤其是V600E突变,扮演了至关重要的角色。它不仅影响着肿瘤的生物学行为,更直接关联到诊断策略、预后判断及治疗路径的选择。
在精准治疗时代背景下,为了进一步提升我国临床甲状腺癌规范化诊疗水平,【肿瘤资讯】在此特别邀请福建省肿瘤医院吴宇教授深度解析BRAF基因突变甲状腺癌的治疗进展,其将从分子机制的发现,到临床实践的革新进行系统性梳理,全景式展现这一领域如何走向精准治疗的新时代。
专家简介
福建省肿瘤医院头颈外科党支部书记、行政副主任
福建省抗癌协会甲状腺肿瘤专委会候任主任委员
中国肿瘤临床学会CSCO甲状腺癌专委会常务委员
中国医药教育协会头颈肿瘤专委会常务委员
中国抗癌协会头颈肿瘤专委会委员
中国抗癌协会甲状腺癌整合专委会委员
中国抗癌协会肉瘤专委会委员
国家肿瘤质控中心第一届黑色素瘤质控专委会委员
福建省抗癌协会头颈肿瘤青委会主任委员
福建医科大学肿瘤临床学院耳鼻咽喉头颈外科教研室主任
香港中文大学威尔斯亲王医院访问学者
不断精进:BRAF V600突变在DTC发生发展中的作用机制
BRAF基因:一个偶然的发现,一条清晰的通路
故事的起点要回到1988年。Ikawa等科学家在筛选致癌基因时,从人类尤文氏肉瘤的DNA中发现了一个能强力诱导细胞恶变的基因序列。因与当时已知的Ras基因家族高度同源,它被命名为 b-Ras,即后来的 BRAF。有趣的是,BRAF的发现带有一定的偶然性——它并非因在某种高发肿瘤中被频繁检出而“闻名”,而是因其DNA在实验模型中展现出极强的转化活性而“脱颖而出”。
这个位于7号染色体长臂上的基因,编码产生一个由766个氨基酸组成的蛋白——BRAF蛋白。作为RAF激酶家族的一员,它是细胞内 MAPK信号通路 的核心调控分子。这条通路如同细胞的“生长开关”,正常时精密调控增殖与分化;一旦异常持续激活,便会驱动肿瘤的发生与发展。
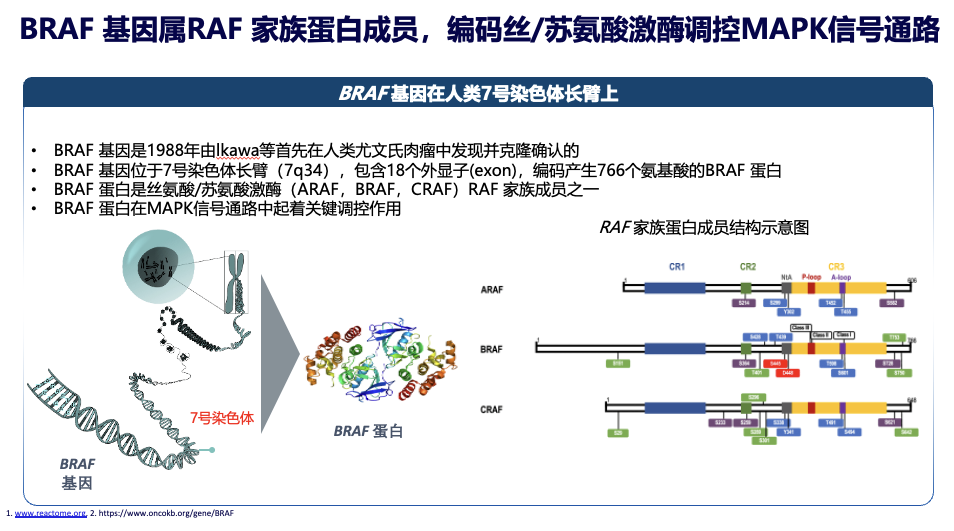
BRAF 变异是多种实体瘤发生发展的驱动因素,在实体瘤中,BRAF的突变率约为6%,其在分化型甲状腺癌(DTC)中突变率最高,达50%-80%。更重要的是,甲状腺癌中的BRAF突变几乎全部集中在 V600位点(尤其V600E),属于对特定靶向药高度敏感的 I类突变。这使得甲状腺癌患者成为BRAF抑制剂治疗中最具潜力的获益人群。
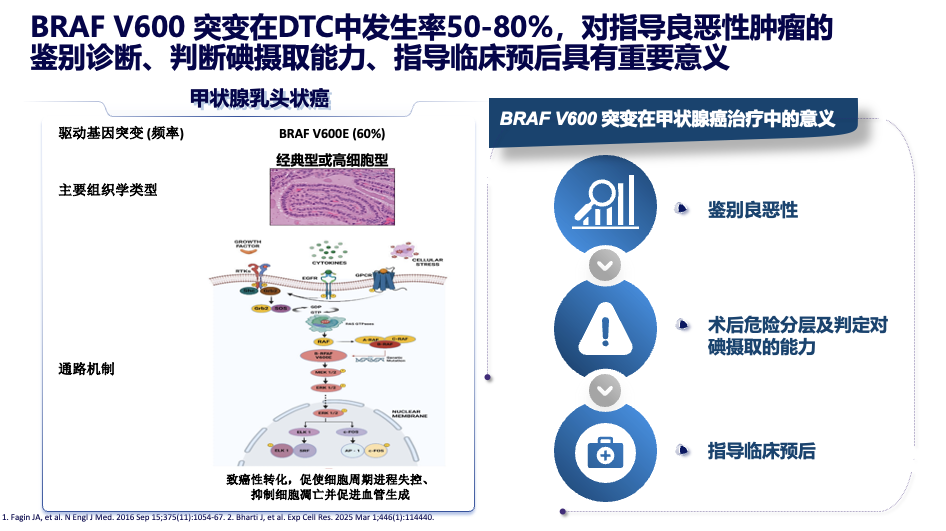
解读BRAF突变:超越“阳性或阴性”的精细分层
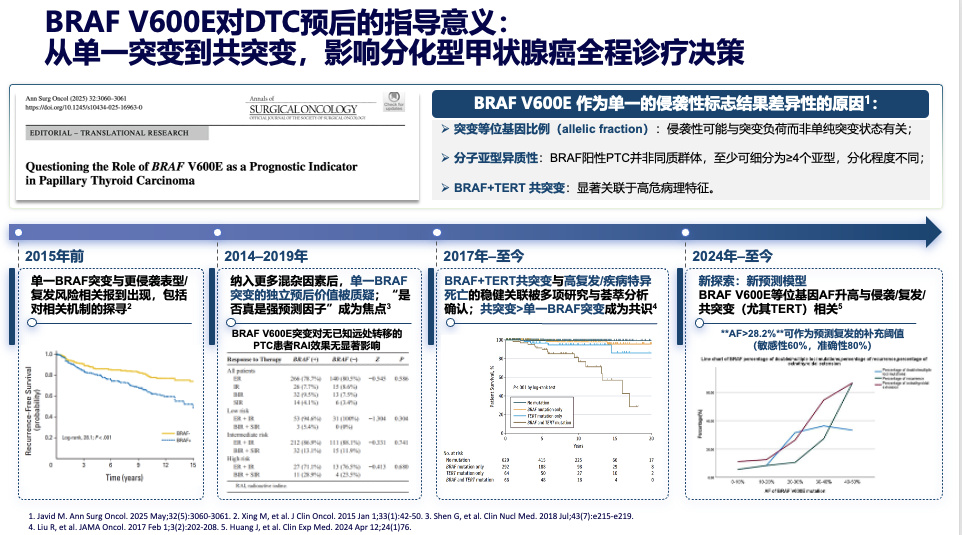
过去,临床报告一个“BRAF V600E阳性”的结果,往往直接与“侵袭性强、预后差”划上等号。然而,现代研究告诉我们,真相远非如此单一。正确评估BRAF突变的临床意义,需要进入更精细的分子分层。
1)突变等位基因比例:量化侵袭性的“刻度尺”
突变等位基因比例,即AF值,指的是在检测样本中突变型基因所占的百分比。它不仅是肿瘤异质性的指标,更是预后的“预警器”。研究显示,当AF值大于28.2%时,患者的复发风险将激增6倍。高AF值可能通过更强地激活MAPK通路,抑制肿瘤微环境的免疫功能,从而推动疾病进展。
2)分子亚型:BRAF阳性患者不是一个“整体”
BRAF阳性的甲状腺乳头状癌其实是一个高度异质性的群体。根据形态学和分子特征,至少可细分为多种亚型,如:(1)经典型:最常见,占50%以上,多为单纯的BRAF V600E突变,TERT等共突变率低,肿瘤行为相对惰性,预后良好。(2)高细胞型/柱状细胞型:侵袭性更强,复发率和死亡率高于经典型。(3)鞋钉样型:常伴有高频的TP53或TERT启动子突变,MAPK与PI3K/AKT通路协同活化,几乎完全丧失碘摄取能力,是预后最差的亚型。
3)BRAF+TERT 共突变:显著关联于高危病理特征
亚型差异的本质,在于 “BRAF V600E突变”与“不同的共突变谱”的组合。其中,BRAF与TERT启动子共突变被公认为“高危组合”,它导致MAPK通路极度活跃,强烈抑制肿瘤细胞分化,与更强的侵袭性、碘摄取能力丧失及治疗抵抗密切相关。
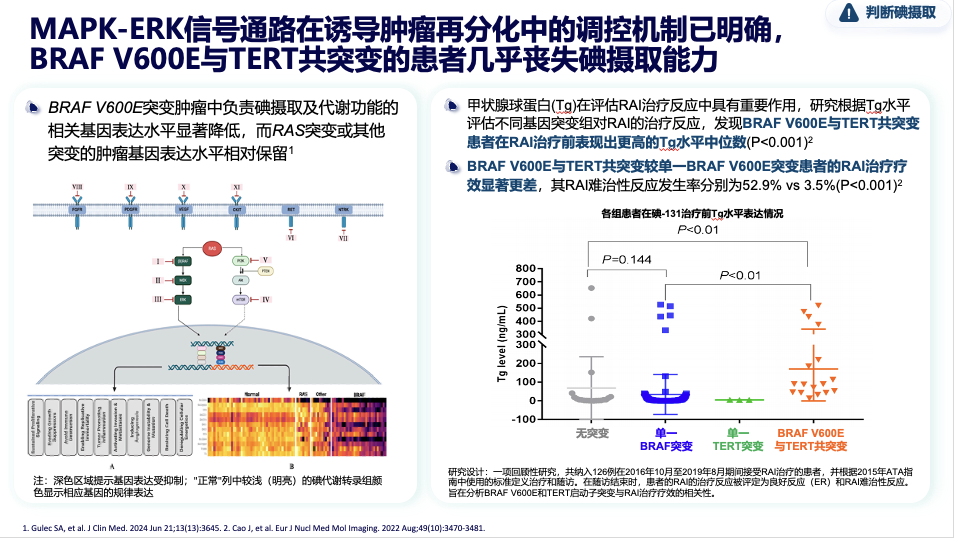
与碘摄取的关联:机制与现实的桥梁
BRAF V600E突变并非直接破坏碘摄取“工具”(钠碘同向转运体,NIS),而是通过持续激活MAPK通路,间接导致NIS的转录抑制和表观遗传沉默,最终使其表达下降。
关键在于,表达“下降”不等于完全“丧失”。事实上,70%-90%的BRAF突变患者虽然NIS表达下调,但多数仍保留部分功能,癌细胞仍能摄取一定量的碘-131。只要摄取能力达到治疗阈值,放射性碘治疗依然有效。但当BRAF V600E突变合并TERT等共突变时,MAPK通路过度活化可能导致摄碘能力严重受损,患者可几乎丧失碘摄取能力。
此外,BRAF V600E与TERT共突变对死亡、疾病持续存在及疾病复发风险升高,即疾病往往进入更具挑战性的阶段,临床应加强随访及时调整治疗策略。

指南共识:分子检测成为临床决策的“基石”
基于上述证据,国内外权威指南(如NCCN、ATA、CACA)已达成强烈共识:所有晚期或转移性甲状腺癌患者,均应进行包含BRAF在内的分子检测。
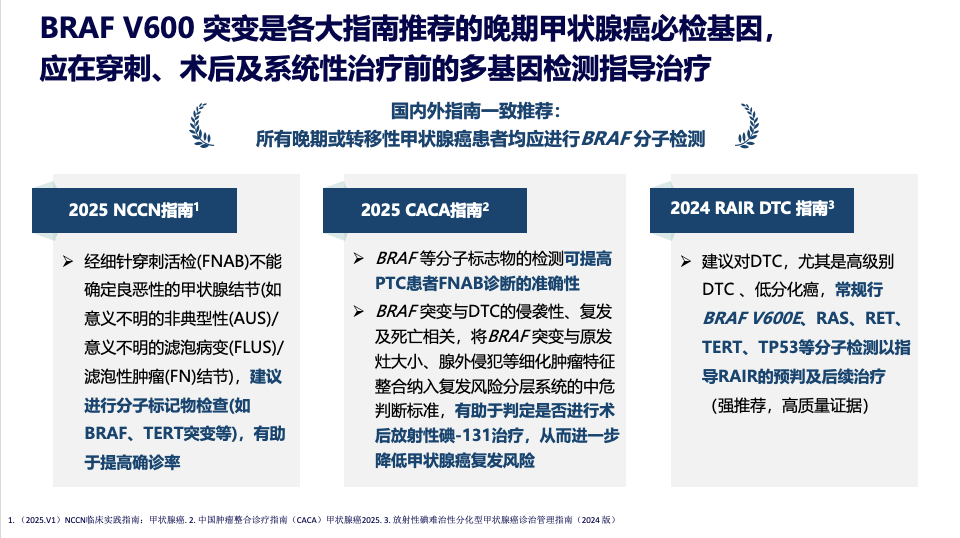
而在检测方法上,BRAF 常用分子病理检测方法目前临床PCR和NGS为主。NCCN及ESMO指南强调,为获取更广泛的分子学信息指导临床用药,强烈推荐NGS作为检测方法。
迈入精准:BRAF V600 DTC治疗进展
对于晚期BRAF V600E突变患者,传统一线治疗是多靶点激酶抑制剂(mTKIs)。然而,高血压、手足综合征等不良反应常导致患者无法耐受。在2025年最新发布的 ATA指南中,明确推荐,对于BRAF V600E RAIR DTC一线治疗,考虑无法耐受mTKI治疗患者,可一线选择达拉非尼联合曲美替尼(D+T)治疗。这是由于近年来D+T这一组合显著改变了BRAF V600E突变DTC治疗格局,其不仅带来了卓越的疗效数据,还具有显著的安全性优势。
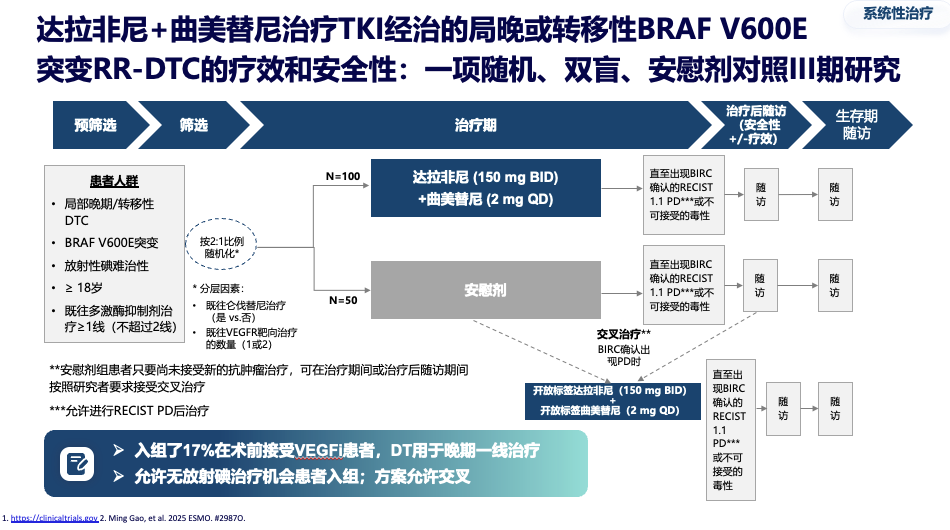
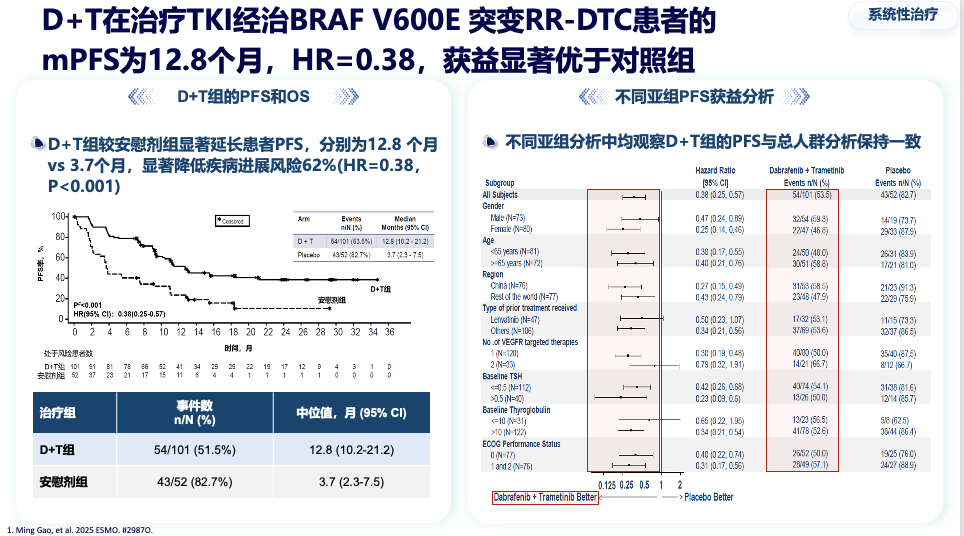
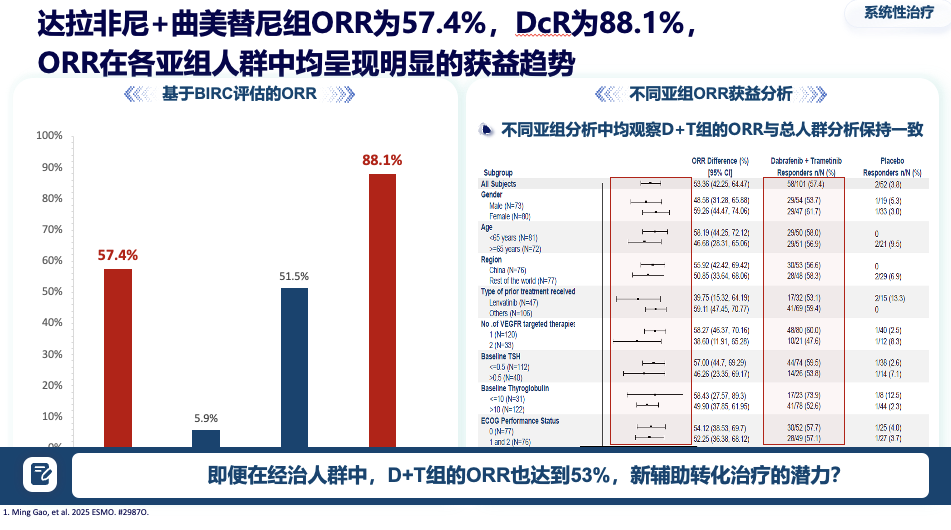
一项关键的III期研究针对TKI经治的局晚或转移性患者显示:达拉非尼+曲美替尼组的中位无进展生存期达到 12.8个月,远超安慰剂组的3.7个月,疾病进展或死亡风险降低62%。客观缓解率高达 57.4%,疾病控制率达88.1%。
真实世界研究进一步证实了其一线治疗的潜力:在中国和西班牙的真实世界数据中,该方案一线治疗的中位无进展生存期分别达到 19.6个月 和 17-18个月,疗效与经典的仑伐替尼相当。
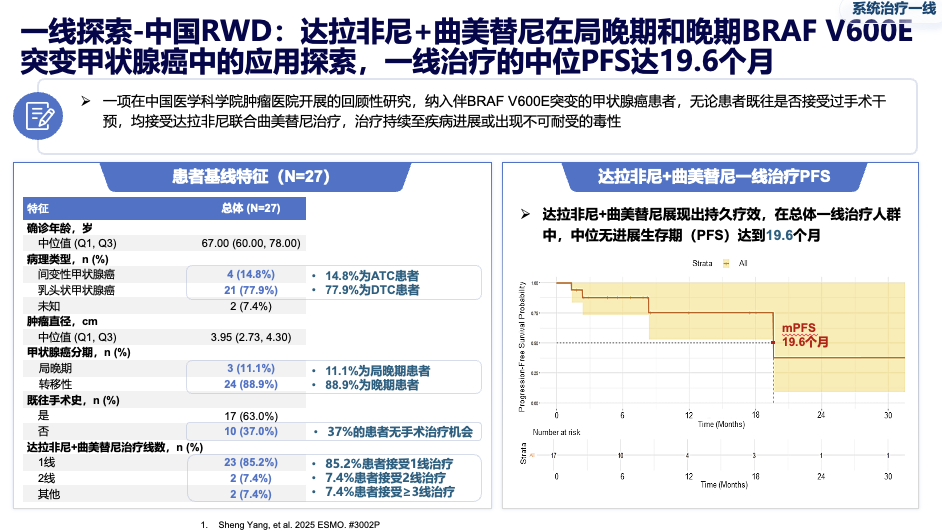
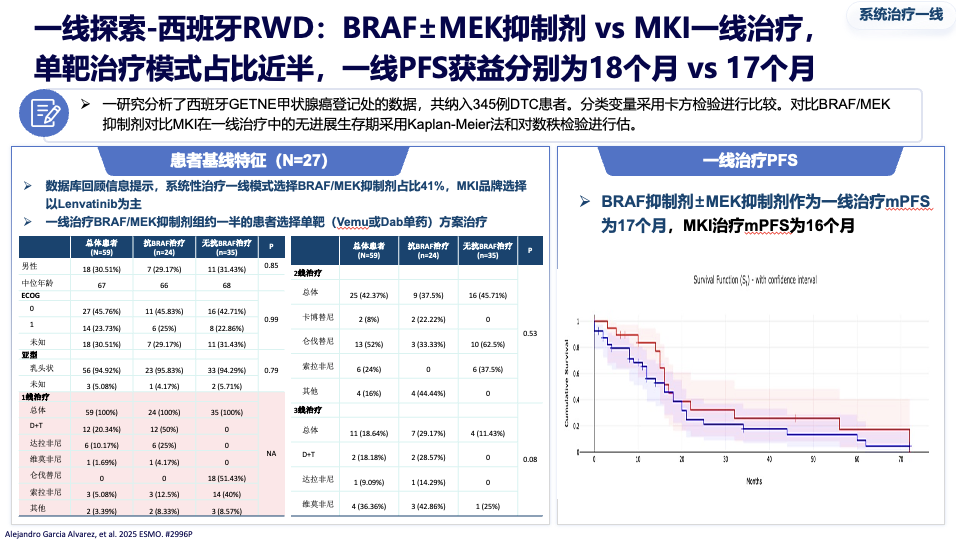
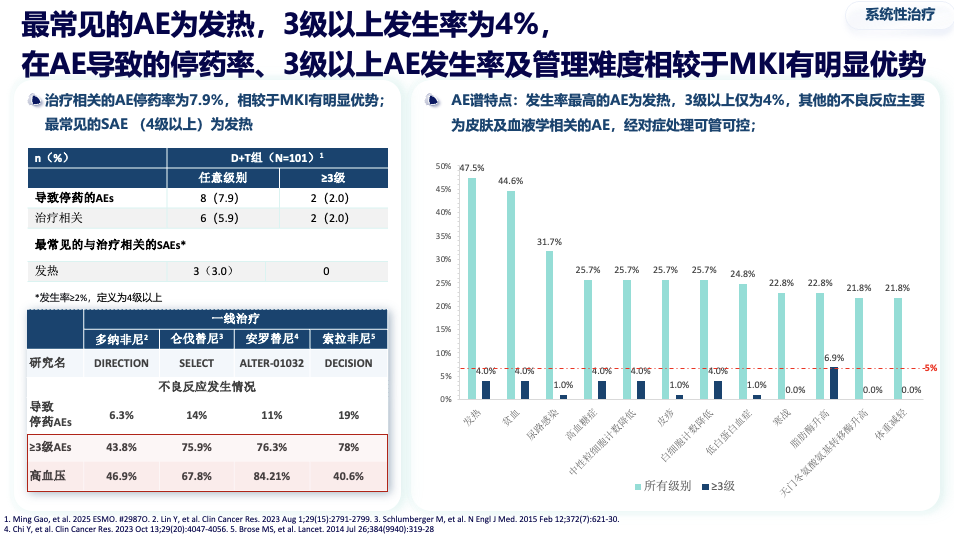
该组合最常见的不良反应是发热,但3级以上严重不良反应发生率很低(约4%)。在因不良反应导致的停药率、高级别事件管理难度上,均明显优于传统的多靶点抑制剂,为患者提供了更安全、更易长期坚持的治疗选择。
更令人振奋的是,达拉非尼联合曲美替尼能够部分逆转MAPK通路对肿瘤细胞分化的抑制,恢复其碘摄取能力。MERAIODE研究表明,经过42天的双靶诱导治疗后,部分放射性碘难治性患者成功恢复了碘-131摄取,为后续接受有效的放射性碘治疗创造了条件,实现了从“无药可治”到“有路可循”的转化。
总结与展望
甲状腺癌的诊疗已步入精准时代。BRAF V600E突变是其中至关重要的驱动因素和治疗靶点。临床实践应超越简单的突变检测,关注AF值、分子亚型及共突变状态,实现更精细的风险分层。
在治疗上,达拉非尼联合曲美替尼为代表的靶向联合方案,凭借其确切的疗效、良好的耐受性以及诱导再分化的独特潜力,已成为BRAF V600E突变晚期甲状腺癌患者,尤其是无法耐受传统靶向药患者的重要一线选择。它不仅延长了生存,更改善了生活质量。
未来,随着更多研究的深入,我们有望看到更优化的治疗顺序、更有效的联合策略(如靶向联合免疫),以及针对不同共突变谱的个体化方案,最终让每一位甲状腺癌患者都能获得最适合自己的精准治疗。
排版编辑:肿瘤资讯-WJH











 苏公网安备32059002004080号
苏公网安备32059002004080号


