急性髓系白血病(AML)作为成人中最常见的急性白血病类型,约占所有急性白血病病例的 80%,其预后极差,5年相对生存率仅为32.9%,而65岁以上患者的5年生存率更是低至10.5%。在AML患者中,约20%存在异柠檬酸脱氢酶1(IDH1)或IDH2基因突变,其中IDH1突变发生率为7%~14%。这类突变会导致致癌代谢物2-羟基戊二酸积累,扰乱表观遗传调控并阻断细胞分化,最终驱动疾病进展。对于携带IDH1突变的复发/难治性(R/R)AML患者,传统治疗手段疗效有限,临床亟需新型靶向治疗方案。近日,Journal of Hematology & Oncology杂志公布了口服选择性IDH1抑制剂Olutasidenib治疗R/R mIDH1 AML的5年最终随访结果,数据显示该药物具有持久的疗效和可控的安全性,为这一高危人群提供了重要的治疗选择。

研究背景:靶向IDH1突变,破解R/R AML治疗困局
IDH1突变在AML的发生发展中扮演关键角色,与患者年龄较大、预后较差密切相关。传统化疗对于R/R mIDH1 AML患者的疗效不佳,且老年患者往往无法耐受高强度化疗,治疗选择极其有限。虽然已有IDH1抑制剂获批用于临床,但长期疗效和安全性数据仍有待完善,尤其是对于经多线治疗的患者、老年患者等特殊人群的获益情况尚不明确。
Olutasidenib作为一种强效、高选择性口服mIDH1抑制剂,能够特异性结合并抑制单突变和双突变IDH1变体,同时保留野生型IDH1的正常生理功能,避免对机体代谢、表观遗传调控等关键过程造成干扰。此前基于2期注册临床试验的中期分析结果,Olutasidenib已获美国FDA批准用于治疗携带IDH1突变的R/R AML患者。为进一步验证其长期疗效和安全性,研究团队开展了为期5年的最终随访分析,为临床应用提供更坚实的证据支持。
研究方法:多中心、开放标签的2期关键队列研究设计
本研究为一项正在进行的多中心、开放标签、1b/2 期临床试验(NCT02719574),其中2期关键队列的研究数据为本次5年随访分析的核心。研究在9个国家的57家医疗中心开展,纳入了2018年4月至2020年6月期间确诊的153例R/R mIDH1 AML患者,所有患者均经中心实验室确认存在IDH1 R132突变,且对标准治疗无效或复发。
研究的主要疗效终点为研究者根据修订后的国际工作组(IWG)AML疗效标准评估的完全缓解(CR)+ 伴部分血液学恢复的完全缓解(CRh)率;次要疗效终点包括总缓解率(ORR)、缓解持续时间(DOR)、输血独立性(TI)、无进展生存期(PFS)和总生存期(OS)等。
研究结果:持久疗效与可控安全性,覆盖多类高危人群
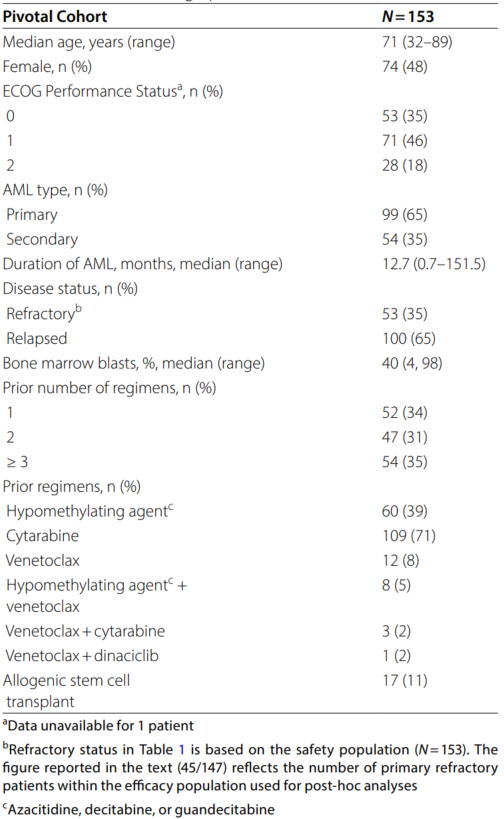
入组患者中位年龄为71岁(范围32-89岁),其中女性占48%(74/153)。65%(99/153)为原发性AML,35%(54/153)为继发性AML;65%(100/153)为复发患者,35%(53/153)为难治性患者。患者既往接受治疗方案的中位数为2线(范围1-7线),39%(60/153)接受过去甲基化药物(HMA)治疗,71%(109/153)接受过阿糖胞苷治疗,8%(12/153)接受过维奈克拉治疗,11%(17/153)接受过异基因造血干细胞移植(allo-HSCT)。东部肿瘤协作组(ECOG)体能状态评分为0分者占35%,1分者占46%,2分者占18%。
表1. 患者基线特征
疗效数据:缓解率稳定,长期生存获益显著
中位随访至2023年6月15日(最长随访时间57.1个月),147例疗效可评估患者中,51例达到CR/CRh,CR/CRh率为35%(P<0.0001),与中期分析结果一致;其中32%(47/147)的患者达到CR。ORR为48%(71/147),包括CR、CRh、伴不完全血液学恢复的完全缓解(CRi)、部分缓解(PR)和形态学无白血病状态(MLFS)。
表2.Olutasidenib的缓解和缓解持续时间总结
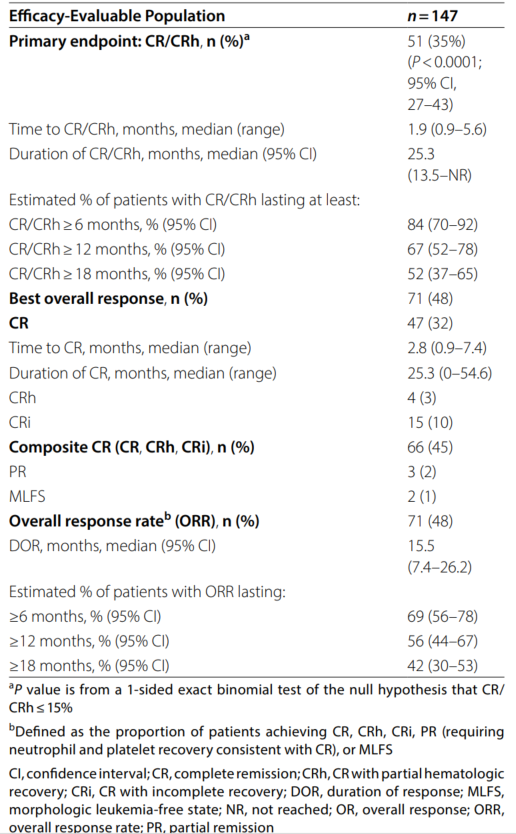
CR/CRh患者的中位DOR为25.3个月,6个月、12个月和18个月的DOR率分别为84%、67%和52%;所有缓解者的中位DOR为15.5个月。
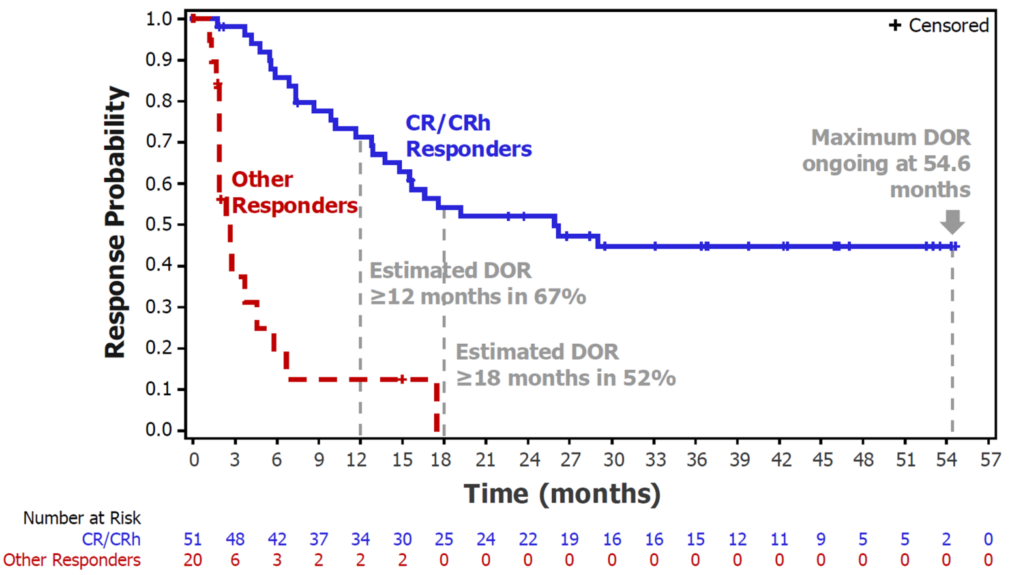
疗效可评估人群的中位OS为11.5个月;CR/CRh患者的中位OS未达到,而所有缓解者的中位OS长达32.7个月。
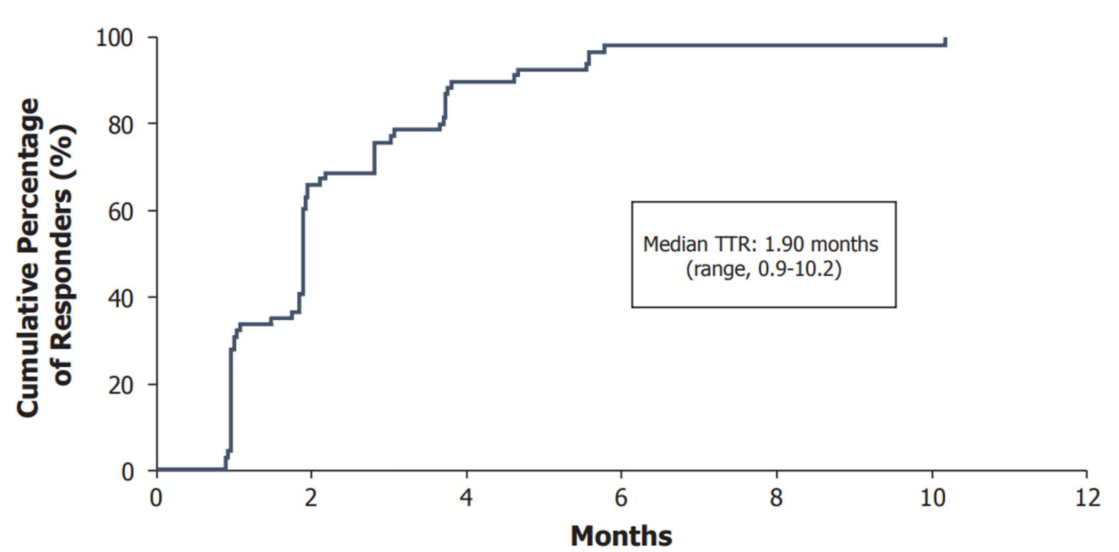
CR/CRh的中位起效时间为1.9个月(范围 0.9-5.6个月),55%的缓解者在2个月内达到CR/CRh,33%需要2-4个月,12%需要4个月以上;总缓解的中位起效时间同样为1.9个月(范围 0.9-10.2个月),66%在2个月内起效。
亚组疗效:覆盖重度预处理、老年及特殊治疗后人群
按既往治疗线数分层:接受1-2线既往治疗的患者CR/CRh率为41%,ORR为54%,中位OS为13个月;接受≥3线既往治疗的患者CR/CRh率为24%,ORR为39%,中位OS为8.9个月,提示早期使用可能带来更优获益,但重度预处理患者仍能获得一定疗效。
表3. Olutasidenib缓解者的患者特征和至缓解时间
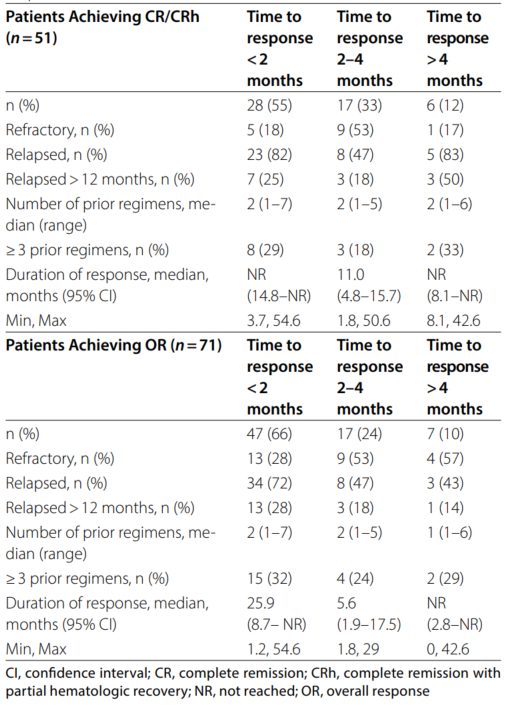 老年患者:≥75岁患者的CR/CRh率为31%,ORR为47%,中位OS为10个月,12个月生存率为44%,安全性与年轻患者一致,表明Olutasidenib对老年患者具有良好的耐受性和疗效。
老年患者:≥75岁患者的CR/CRh率为31%,ORR为47%,中位OS为10个月,12个月生存率为44%,安全性与年轻患者一致,表明Olutasidenib对老年患者具有良好的耐受性和疗效。
原发难治性患者:45例原发性难治性患者的ORR为51%,CR/CRh率为31%,中位DOR为 17.6 个月,中位OS为8.9个月,为这类预后极差的患者提供了新的治疗选择。
维奈克拉治疗后患者:12例既往接受过维奈克拉治疗的患者中,CR/CRh率为33%,ORR为50%,中位OS为16.2个月,3例患者的CR/CRh持续时间超过22个月,显示出在维奈克拉耐药后的治疗潜力。
移植后患者:17例既往接受过allo-HSCT的患者ORR为29%,其中CR率为12%,部分患者后续成功接受了二次移植,表明Olutasidenib可作为移植桥接治疗选择。
基因突变与疗效关联
不同IDH1突变亚型患者的疗效存在差异:R132C突变患者的CR/CRh率最高(42%),中位DOR为25.3个月;R132L/G/S突变患者CR/CRh率为33%,中位DOR未达到;而R132H突变患者CR/CRh率较低(17%),中位DOR为13.5个月。
此外,共突变数量对疗效有一定影响,无共突变患者ORR达75%,而4-7个共突变患者ORR仅为32%,但部分携带FLT3、TP53等不良预后突变的患者仍能达到CR/CRh。
安全性数据:长期耐受良好,无新安全信号
所有153例患者均报告至少1例治疗相关不良事件(TEAE),88%的患者出现3-4级TEAE,但多数不良事件可控,且无新的安全信号出现。
最常见的TEAE(发生率≥20%)包括恶心(39%)、便秘(27%)、红细胞计数降低(26%)、白细胞计数升高(25%)、发热(24%)、疲劳(23%)、发热性中性粒细胞减少(22%)、低钾血症(22%)、腹泻(21%)、血小板计数降低(21%)等。
特殊关注的不良事件中:
分化综合征(DS)发生率为14%,其中3级占8%,5级占0.7%,无新增病例,均通过标准治疗控制;
肝毒性发生率为23%,3-4级占13%,中位起效时间为32天,中位至缓解时间为13天,仅5例患者因肝毒性停药;
QT间期延长发生率低,3级仅1例,且与治疗无关,无新增病例。
值得注意的是,3年后未出现新的不良事件,也无因不良事件导致的治疗中断,表明Olutasidenib长期治疗的安全性稳定。此外,69例基线输血依赖的患者中,41%实现血小板输血独立;87例基线红细胞输血依赖的患者中,39%实现红细胞输血独立,CR/CRh患者的输血独立率更高(血小板 100%,红细胞 89%)。
总结
Olutasidenib治疗R/R mIDH1 AML的5年最终随访结果,为其长期疗效和安全性提供了强有力的证据支持。该药物展现出稳定的缓解率(CR/CRh率 35%,ORR 48%),且缓解持续时间持久(中位CR/CRh持续时间25.3个月),缓解者的中位OS长达32.7个月,显著优于传统治疗方案。尤为重要的是,Olutasidenib在老年患者、重度预处理患者、原发难治性患者以及维奈克拉治疗后患者等多个高危亚组中均能带来临床获益,拓宽了适用人群范围。
总体而言,Olutasidenib凭借持久的疗效、可控的安全性以及广泛的适用人群,已成为R/R mIDH1 AML治疗的关键药物。5年随访数据不仅巩固了其在复发难治性患者中的地位,也为其向更早线治疗推进提供了重要依据,有望为更多IDH1突变AML患者带来长期生存希望。随着精准医疗的不断发展,靶向IDH1突变的治疗将持续优化,为AML患者带来个体化的治疗新选择。
Cortes J, Curti A, Fenaux P, et al. Olutasidenib for mutated IDH1 acute myeloid leukemia: final five-year results from the phase 2 pivotal cohort[J]. Journal of Hematology & Oncology, 2025, 18(1): 102
排版编辑:mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


