2025年圣安东尼奥乳腺癌研讨会(SABCS)期间,备受关注的美国食品药物管理局(FDA)专场论坛聚焦激素受体阳性(HR+)转移性乳腺癌。曾几何时这一领域仅有寥寥数种治疗手段,如今却因CDK4/6抑制剂、口服选择性雌激素受体选择性雌激素受体降解剂(SERD)、PI3K/AKT/mTOR通路抑制剂及抗体药物偶联物(ADC)的集中涌现而陷入极度“拥挤”的格局。在本次专场论坛中,FDA肿瘤卓越中心与学术界专家齐聚于此,不仅详细复盘了德达博妥单抗(Dato-DXd)、德曲妥珠单抗(T-DXd)、Imlunestrant三款新药获FDA批准背后的核心数据,更围绕监管科学如何适配临床实际展开了深度探讨。当总生存期(OS)不再是衡量疗效的唯一金标准,当病理科医生不得不重新界定HER2超低表达的判定边界,当临床试验的对照组标准在研究中途就已落后于临床实践——FDA的审评逻辑正发生着怎样的变革?【肿瘤资讯】特别整理,以飨读者。
ADC药物的精细化突围——数据博弈与审评逻辑转变
FDA肿瘤疾病办公室的Melanie Royce教授率先登台,系统阐释了Dato-DXd与T-DXd两款药物的获批历程,直观展现了FDA面对不同数据类型时,如何通过“替代设计”与“证据权重”定义临床获益。
Dato-DXd:OS获益平平,安全性成破局关键
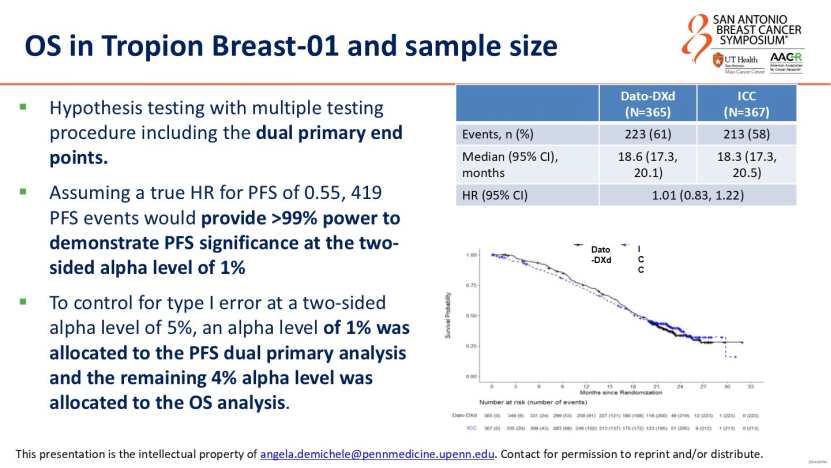
Dato-DXd的获批基于TROPION-Breast01研究。在主要终点无进展生存期(PFS)方面,Dato-DXd对比研究者选择的化疗(ICC)展现出统计学显著性,疾病进展或死亡风险降低37%(HR=0.63,95% CI: 0.52-0.76),中位PFS从化疗组的4.9个月延长至6.9个月。但双主要终点之一的OS却成为最大挑战:最终分析显示,Dato-DXd组与化疗组的生存曲线几乎重合,HR值为1.01(95% CI: 0.83-1.22),中位OS分别为18.6个月和18.3个月。
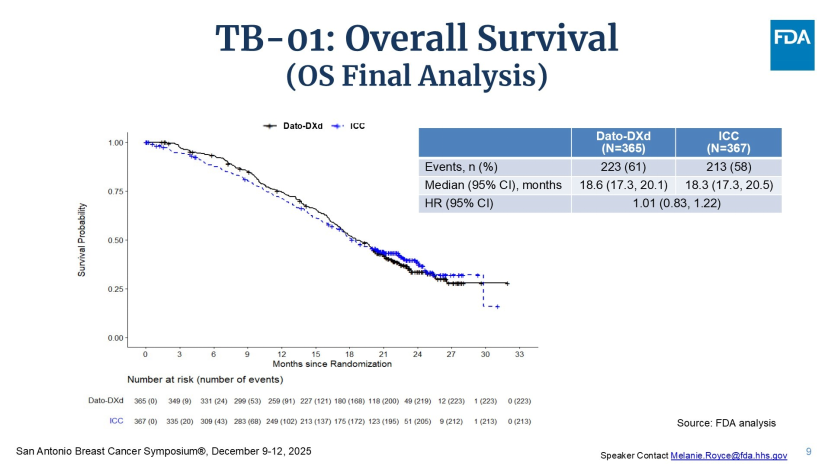
FDA的审评逻辑:为何批准一款无OS明显获益的药物?
针对这个问题,Royce教授提出了“替代设计(Replacement Design)”的概念。她指出,TB-01研究中,Dato-DXd并非作为现有疗法的“叠加(Add-on)”方案,而是二线或三线化疗的“替代者”。在此设计下,FDA并未强求Dato-DXd必须展现OS优效性,核心评判标准是:在疗效不劣于化疗的前提下,能否提供具有差异化的安全性价值?
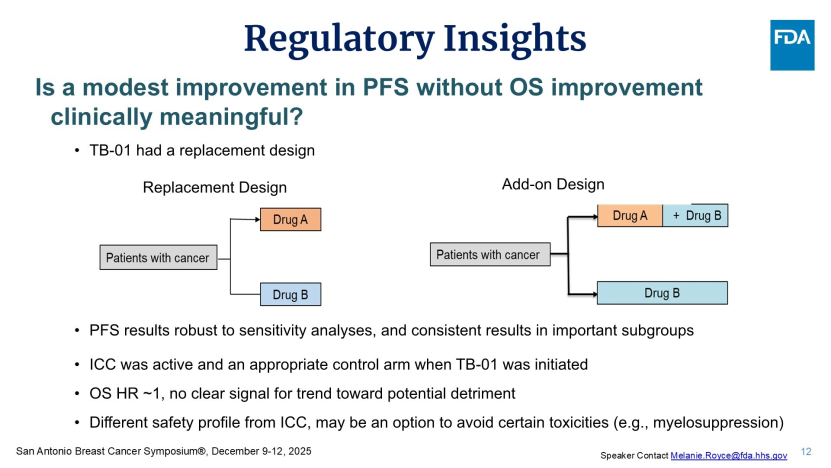
TROPION-Breast01研究数据给出了肯定答案。Dato-DXd大幅减少了最令患者困扰的化疗血液学不良事件发生率:结果显示,Dato-DXd组3级及以上中性粒细胞减少症发生率仅1.6%,而化疗组高达35%。尽管Dato-DXd会增加口腔炎(发生率约59%)和眼部毒性风险,但对于骨髓功能储备不足或无法耐受严重化疗反应的患者而言,这种差异化的不良事件具有较高的临床价值。FDA最终认可这一价值,批准Dato-DXd作为不可切除或转移性HR阳性、HER2阴性乳腺癌患者化疗的替代方案。

T-DXd:从低表达到超低表达的“冒险”跨越
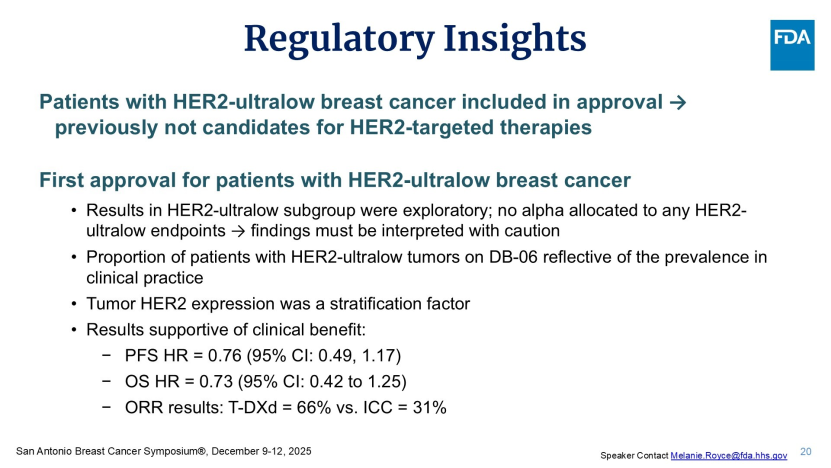
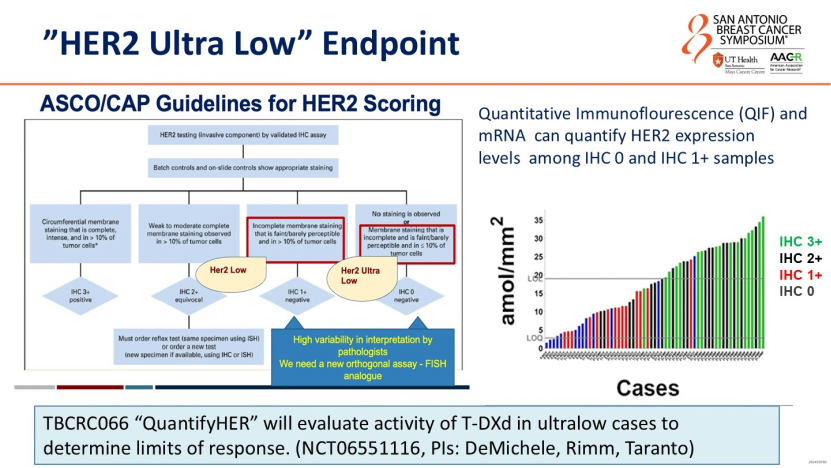
如果说Dato-DXd是横向的治疗替代,那么T-DXd基于DESTINY-Breast06研究的获批,则是一次纵向的治疗突破。DB-06研究中,HER2低表达人群(IHC 1+或2+/ISH-)的获益明显,中位PFS为13.2个月vs化疗组8.1个月(HR=0.62, 95% CI: 0.52-0.75)。但令监管机构注意的是占比约18%的HER2超低表达(IHC 0但存在微弱膜染色)亚组——该亚组分析仅为探索性分析,未预设α值控制统计学误差。数据显示该亚组中位PFS从化疗组的8.3个月延长至15.1个月(HR=0.76,95% CI: 0.49-1.17),客观缓解率(ORR)高达66%,远超化疗组的31%。
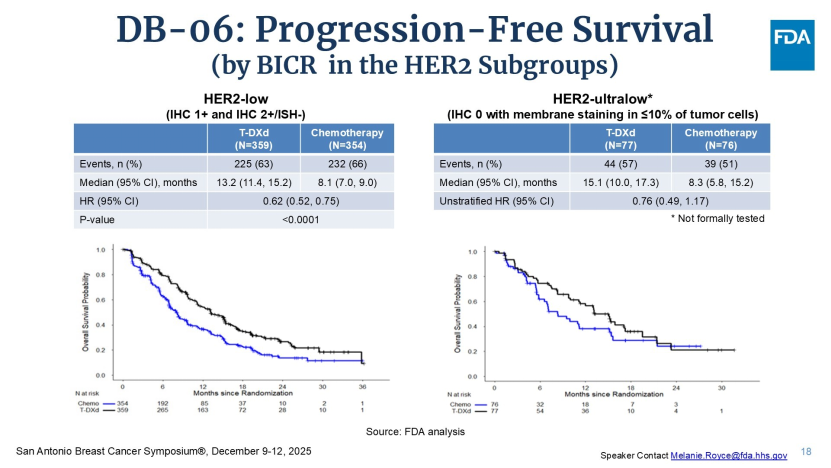
FDA的审评逻辑:为何基于探索性数据批准适应症?
Royce教授解释,T-DXd在HER2超低表达适应症的获批并非盲目决策,而是基于“整体证据权重(Totality of Evidence)”的综合考量:
生物学合理性:HER2超低表达人群的获益趋势与低表达人群高度一致(HR 0.76 vs 0.62),证实T-DXd作用机制在HER2超低表达水平下仍有效;
未被满足的临床需求:这部分患者此前被归为HER2阴性,无法获得靶向治疗;
样本代表性:尽管是探索性亚组,但入组速度和患者特征与真实世界流行病学特征相符。
因此,FDA的这一决策,不仅促成了药物适应症的获批,更要求病理学界修改HER2检查标准,以识别那些曾被忽略的微弱膜染色信号。
内分泌治疗的“口服”复兴——在混合人群中挖掘精准获益
随后,FDA肿瘤疾病办公室的Maria Garcia-Jimenez教授带来新型口服SERD药物Imlunestrant(基于EMBER-3研究)的深度解析。这一案例清晰展示了当全人群研究未达预期时,如何通过精准的生物标志物筛选,挽救药物的临床价值。
EMBER-3数据详解:ESR1突变是关键“分水岭”
EMBER-3研究结果呈现出明显的差异特征:在意向治疗人群(ITT)分析中,Imlunestrant单药对比标准内分泌治疗(氟维司群或依西美坦)未显示出统计学显著的PFS获益。然而,在ESR1突变亚组中,Imlunestrant使疾病进展或死亡风险降低38%(HR 0.62,95%CI 0.46-0.82,P=0.0008),中位PFS从对照组的3.8个月延长至5.5个月;此外,客观缓解率(ORR)和缓解持续时间也均优于对照组。
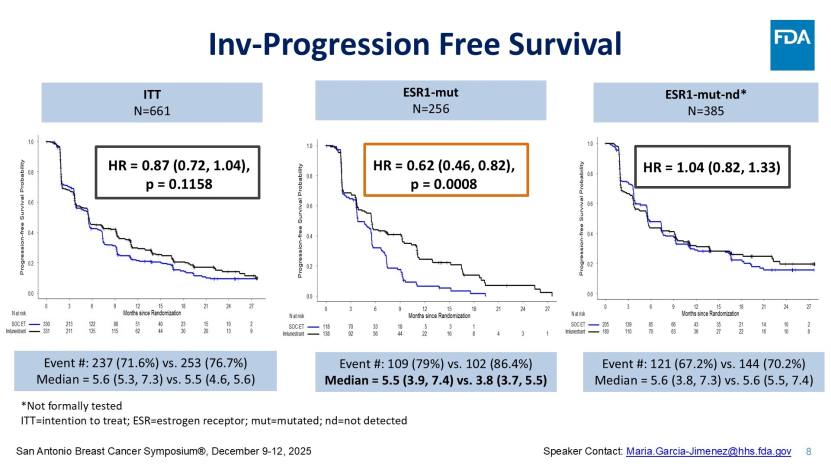
FDA的审评逻辑:有限获益下,便利性与精准性是加分项
Garcia-Jimenez教授指出,尽管PFS绝对提升幅度有限(1.7个月),但Imlunestrant的价值体现在两大维度:
给药方式革新:相较于对照组中需每月肌肉注射的氟维司群,口服制剂Imlunestrant大幅提升患者治疗依从性与便利性;在ESR1突变亚组疗效优效的前提下,这种便利性将显著改善患者生活质量;
安全性可控:尽管Imlunestrant组胃肠道毒性(腹泻、恶心)和血脂异常发生率略高,但多为低级别不良反应,且未出现严重心脏或眼部毒性,整体风险可控。
因此,尽管全人群数据未达获批标准,FDA仍批准Imlunestrant用于ER阳性/HER2阴性、ESR1突变且在至少接受过一线内分泌治疗后疾病仍发生进展的晚期或转移性乳腺癌成人患者,并同步批准Guardant360 CDx作为伴随诊断试剂。

在“拥挤”赛道中迷失?——对临床试验设计的深刻反思
最后登台的宾夕法尼亚大学Angela DeMichele教授,并未沉浸于新药获批的喜悦,而是以临床医生的视角,直指当前注册临床试验与真实世界需求间的巨大鸿沟,解析当前药物研发格局并提出建设性展望。
核心痛点:对照组的“极速过时”
DeMichele教授首先点出临床医生的尴尬现状——当临床试验结果公布时,其对照组往往已不再是临床标准治疗(SOC)。她以Imlunestrant的EMBER-3研究为例:该研究对照组为单药内分泌治疗(氟维司群或依西美坦),但随着MAINTAIN研究及后续Post-MONARCH研究数据的公布,对HR+转移性乳腺癌患者的临床实践已发生改变——CDK4/6抑制剂治疗进展后,使用其他内分泌治疗药物联合CDK4/6抑制剂(如氟维司群+瑞波西利/阿贝西利)的疗效已证实优于单药内分泌治疗。
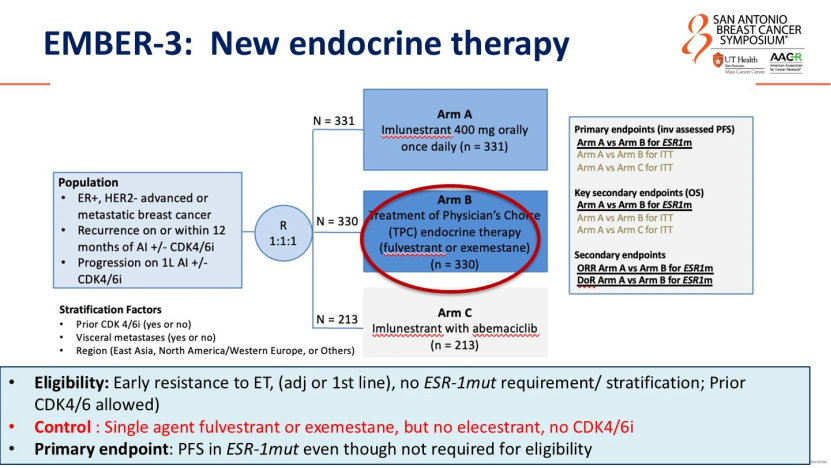
“若将已落后的单药方案作为对照,新药展现的优效性含金量究竟如何?”DeMichele教授的反问引人深思。她呼吁,未来针对HR+转移性乳腺癌的临床试验设计需更具前瞻性,允许对照组纳入CDK4/6抑制剂,否则将难以评估新药在真实临床场景中的价值。
关于OS的灵魂拷问:“追求口感,还是更少负担?”
DeMichele教授借用经典啤酒广告语“Great taste or less filling?”( 追求口感,还是更少负担?),对OS作为疗效金标准的合理性提出质疑。她指出,HR+乳腺癌属于长生存疾病:患者在试验药物进展后,通常还会接受多线治疗。这些后续治疗严重稀释了试验药物对OS的影响,使得从统计学上较难证实OS获益。更关键的是,为追求OS的统计学显著性,研究者将宝贵的α值(检验水准)分配给OS终点,导致临床试验规模被迫扩大、耗时延长、成本攀升——正如TROPION-Breast01研究,为兼顾OS终点,样本量和观察时间大幅增加,最终却仅得到HR 1.01的结果。
DeMichele教授指出,许多临床试验为体现OS差异,禁止对照组患者交叉使用新药。这对于无法获取新药的受试患者而言,既不符合伦理,甚至可能剥夺其唯一的生存机会。因此,她建议将PFS2(至第二次疾病进展时间)列为OS的替代终点,并认可疗效相当但毒性显著降低(Substantially Less Toxic)的价值,让治疗回归提升患者生活质量的本质。
诊断与测序的“黑洞”
最后,DeMichele教授指出Dato-DXd与T-DXd相继获批后带来的临床决策难题:一方面是病理诊断的不稳定性——尽管ASCO/CAP指南定义了HER2超低表达,但实际病理学判读中,不同医生对“微弱膜染色”的判读差异显著。
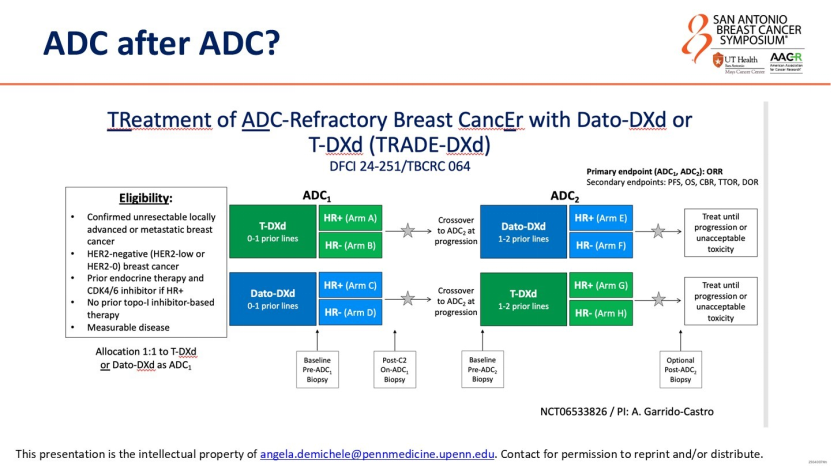
另一方面是“ADC药物序贯使用”的知识空白:接受过T-DXd治疗的患者,后续使用Dato-DXd是否仍有效?目前注册临床试验往往排除既往使用过ADC药物的患者,导致临床医生只能根据经验用药。DeMichele教授强调,这一问题无法仅靠药企解决,须依托TRADE-DXd试验这类研究者发起的研究(IIT)填补相应空白。
总结:从“数据为王”到“价值回归”
2025 SABCS这场FDA专场论坛,清晰勾勒出HR+乳腺癌治疗领域的演进方向。从监管机构的审评逻辑调整,到临床专家的深度反思,在HR+乳腺癌步入长生存、多手段的慢病化管理时代后,临床价值的定义正被重新书写:
价值在于选择:为患者提供无脱发、无严重骨髓抑制的新治疗选择(Dato-DXd);
价值在于便利:让患者居家口服药物,无需频繁前往医院注射(Imlunestrant);
价值在于精准:不遗漏任何可能获益的HER2超低表达患者(T-DXd)。
这场会议不仅是对三款新药的“加冕”,更是对未来临床试验设计和临床价值更新的重要启示。
排版编辑:肿瘤资讯-slb











 苏公网安备32059002004080号
苏公网安备32059002004080号


