在2025年圣安东尼奥乳腺癌研讨会(SABCS)的“Year in Review”环节,美国国立综合癌症网络(NCCN)乳腺癌临床实践指南主席、西北大学William Gradishar教授为全球乳腺癌领域同道梳理了2025年早期乳腺癌治疗的关键进展。Gradishar教授敏锐捕捉到当前早期乳腺癌治疗领域两个看似相反、实则殊途同归的核心趋势:在局部治疗领域,外科医生主导推进“降阶梯”策略,力求在不牺牲疗效的前提下减少医源性损伤;在全身治疗领域,临床医生通过引入抗体药物偶联物(ADC)、新型内分泌治疗药物及免疫联合疗法,开展精准的“升阶梯”策略,以期实现更高的治愈目标。
美国临床肿瘤学会 (ASCO) 肿瘤培训计划委员会主席
美国国立综合癌症网络(NCCN)乳腺癌临床实践指南主席
美国西北大学Robert H. Lurie综合癌症中心血液科/肿瘤科主任
美国西北大学Maggie Daley癌症中心妇女肿瘤治疗中心主任
FDA肿瘤药物咨询委员会顾问
局部治疗:外科“降阶梯”理念的持续落地
Gradishar教授在演讲开篇打趣道,内科医生做年度回顾时,往往仅用最后30秒匆匆提及局部治疗,但他选择将外科进展置于首位——因为外科医生在“降阶梯”理念上,数十年来始终“言行一致”:从Halsted根治术到保乳手术,再到如今腋窝处理的简化,“减法”这一趋势从未中断。
腋窝处理是内科医生相对不熟悉的领域,也是当前局部治疗“降阶梯”的探索焦点。Gradishar教授结合近期发表的SOUND、INSEMA研究,以及本次SABCS公布的AXSANA试验,深入解析了“能否完全豁免腋窝手术”这一核心问题。他指出,这些研究设计的初衷十分明确:即便微创的前哨淋巴结活检(SLNB),仍可能导致患者出现上肢淋巴水肿、感觉异常等并发症;若能在不影响预后的前提下省去该步骤,将大幅提升患者的生活质量。
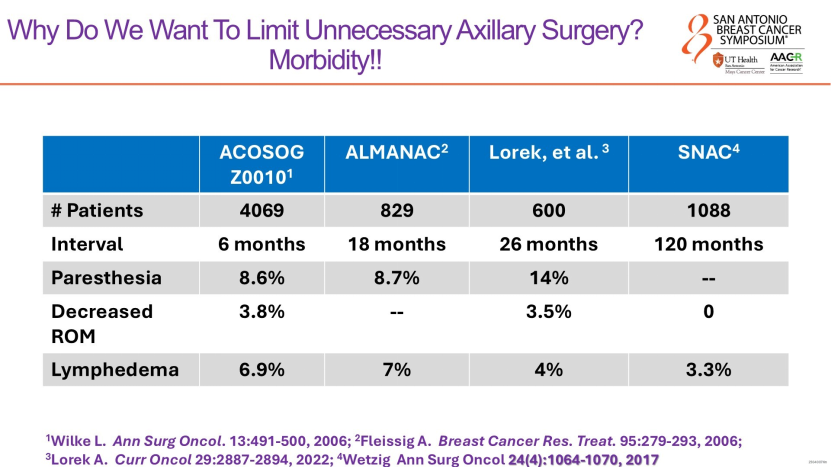
SOUND研究为低危患者豁免SLNB提供了有力证据。该研究纳入临床T1N0且术前腋窝超声阴性的患者,对比SLNB与不进行腋窝手术的结局。Gradishar教授分析,尽管SLNB组检出13.7%的阳性淋巴结(且8.6%为微转移),但两组5年无远处转移生存率(DDFS)无差异。这意味着,对于绝经后、50岁以上、激素受体阳性(HR+)/HER2阴性的低危患者,若病理结果不会改变后续辅助治疗决策,豁免腋窝手术安全可行。这一结论也推动2025 版ASCO指南更新,明确建议符合特定条件的低危患者可豁免SLNB。

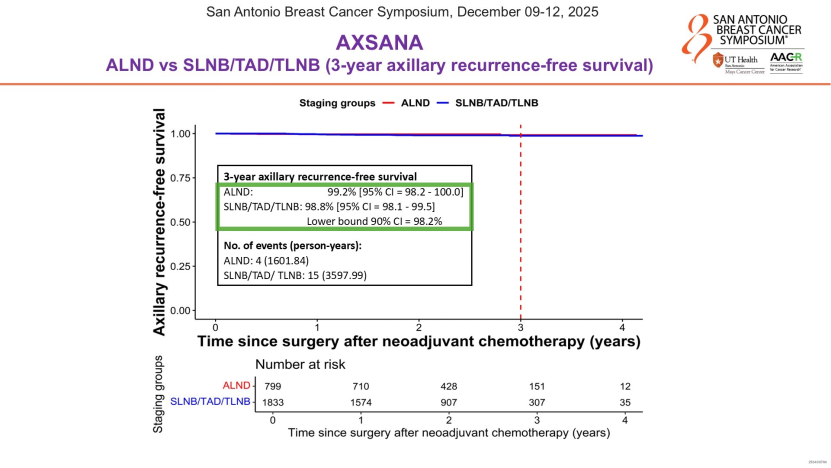
本次大会公布的AXSANA研究则聚焦新辅助治疗后淋巴结转阴的患者。这项前瞻性注册研究显示,随访3年时,接受SLNB或靶向腋窝清扫(TAD)患者的腋窝无复发生存率曲线,与全腋窝清扫患者几乎重合,且统计学无显著差异。Gradishar教授对此予以肯定,但也从内科医生的角度严谨提醒:当前随访时间较短,未来需持续关注长期复发风险,以及放疗靶区对结局的影响,不过“降阶梯”已成为当前外科治疗的趋势。
HER2阳性乳腺癌:ADC药物的全面渗透与临床抉择
将目光转向内科治疗领域,Gradishar教授指出,HER2阳性乳腺癌治疗正经历由ADC药物主导的变革,今年的热门议题是:如何将德曲妥珠单抗(T-DXd)精准整合至新辅助或辅助治疗中?
在辅助强化治疗方面,DESTINY-Breast05研究数据颇为亮眼。Gradishar教授特别强调该研究的入组人群特征——多数初始不可手术或肿瘤负荷大,且新辅助治疗后存在残存病灶(non-pCR)。在此背景下,相较于恩美曲妥珠单抗(T-DM1),T-DXd使患者浸润性无病生存期(iDFS)绝对获益提升约8.7%,并显著减少包括脑转移在内的远处复发。
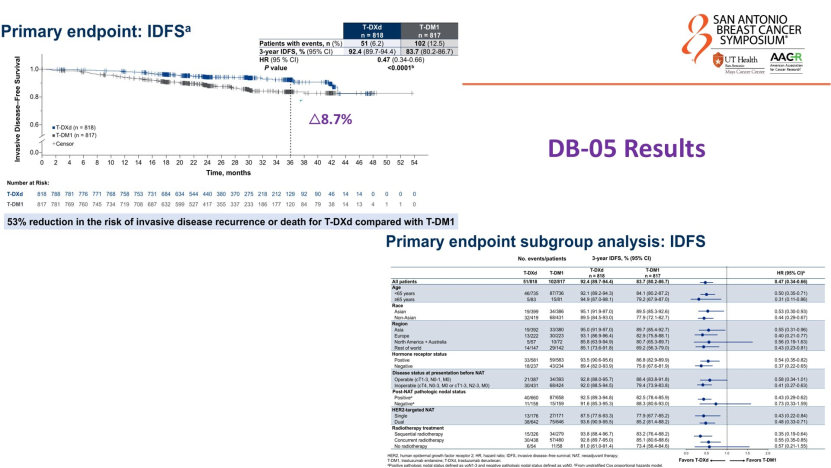
但他也提出临床思考:既然T-DXd疗效显著,是否所有non-pCR患者都需接受14个周期的治疗?对于风险相对较低或合并HR阳性的患者,如何在追求疗效的同时,如何平衡ADC药物与内分泌治疗叠加带来的安全性问题?这是数据之外,临床医生需权衡的现实问题。
若前移至新辅助阶段,ADC药物的疗效如何?DESTINY-Breast11研究给出了初步答案。该研究在术前用T-DXd替代传统蒽环类药物,结果显示T-DXd序贯THP方案(曲妥珠单抗+帕妥珠单抗+多西他赛)的病理完全缓解率(pCR)高达67.3%,且安全性良好。
 Gradishar教授认为这一数据极具吸引力,但也抛出了临床决策难题:如何判断患者是否需要使用T-DXd?若新辅助阶段使用T-DXd后患者仍未达到pCR,后续治疗策略如何选择?这类因药物前移引发的治疗顺序问题,是未来研究需解答的重点。
Gradishar教授认为这一数据极具吸引力,但也抛出了临床决策难题:如何判断患者是否需要使用T-DXd?若新辅助阶段使用T-DXd后患者仍未达到pCR,后续治疗策略如何选择?这类因药物前移引发的治疗顺序问题,是未来研究需解答的重点。
HR阳性乳腺癌:内分泌治疗的精细化“加法”
对于最常见的HR+乳腺癌,Gradishar教授认为当前核心策略是“做加法”——通过叠加治疗手段降低高危患者的复发风险。
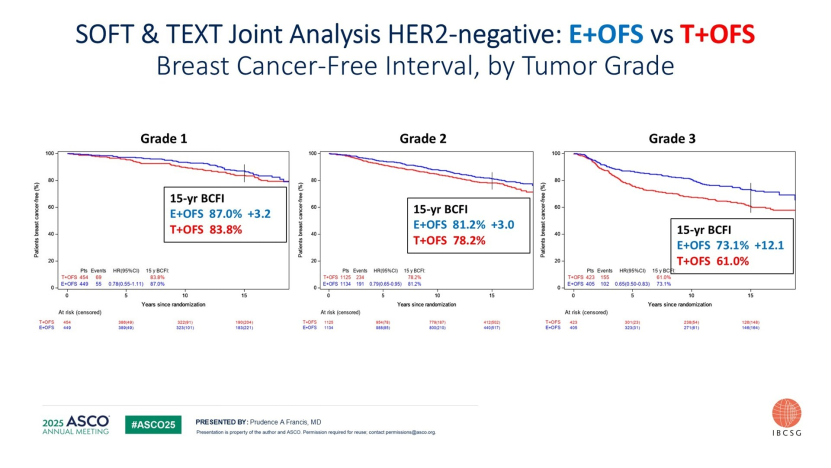
他首先对SOFT/TEXT研究给予高度评价,并称其为“持续产出新发现的宝藏数据库”。2025年ASCO更新的数据再次证实,对于年轻高危患者,卵巢功能抑制(OFS)联合芳香化酶抑制剂(AI)的治疗策略可带来明确的生存获益。Gradishar教授特别指出,肿瘤分级越高(如3级),联合治疗的获益幅度越大,这提示临床应更多依据肿瘤生物学特征筛选OFS的获益人群。
在CDK4/6抑制剂领域,Gradishar教授对比了monarchE和NATALEE两项重磅研究:随着随访时间延长,monarchE研究中阿贝西利联合内分泌治疗显现出统计学显著的总生存(OS)获益。尽管1.8%的绝对获益在外科医生看来可能并不突出,但在内分泌治疗领域,这已是里程碑式的突破。
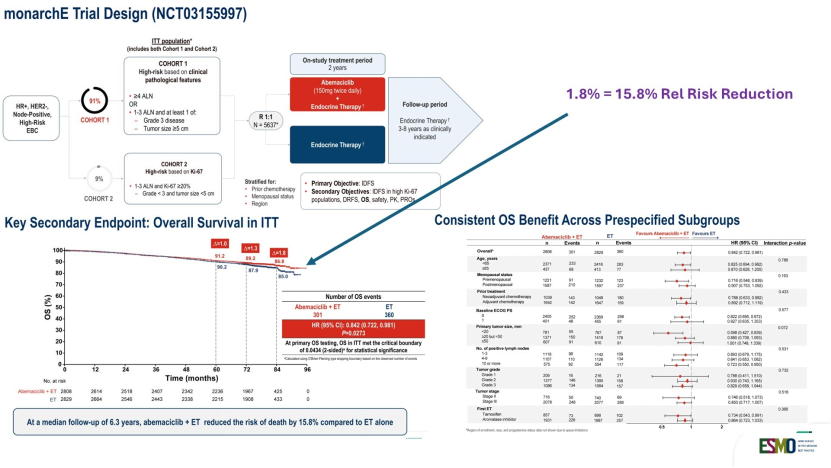
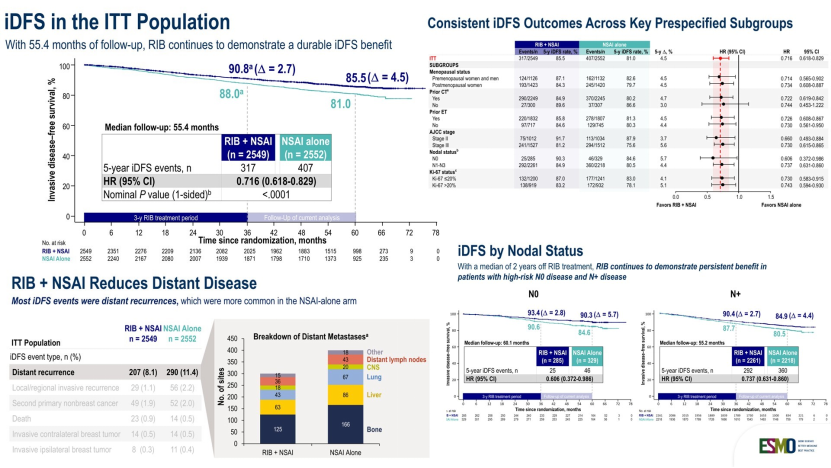
而NATALEE研究5年随访结果则证实,瑞波西利在更广泛人群(包括无淋巴结转移的高危患者)中可带来iDFS获益;尽管OS曲线尚未分离,但其预防远处转移的趋势令人鼓舞。
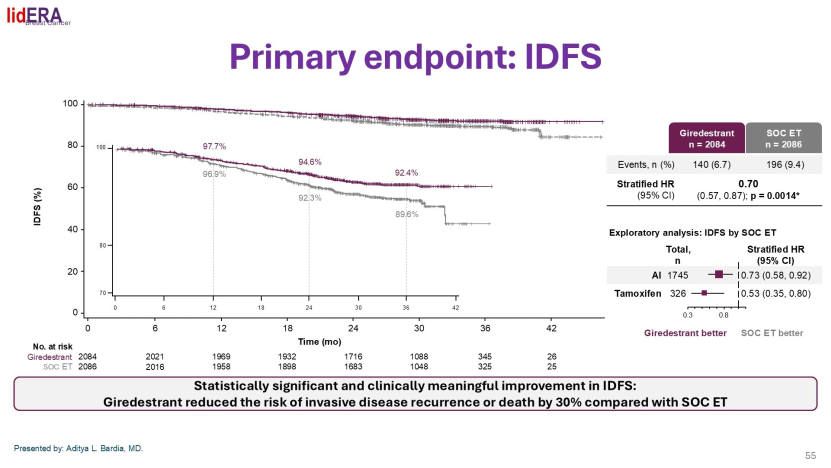
此外,Gradishar教授重点介绍了本次SABCS大会的突破性研究——lidERA研究。该研究显示,新型口服SERD药物Giredestrant(兼具雌激素受体降解+雌激素受体拮抗)在辅助治疗中对比标准内分泌治疗(他莫昔芬/阿那曲唑/来曲唑/依西美坦),可显著降低30%的复发风险,且安全性良好,未观察到明显心脏毒性信号。未来,随着CAMBRIA、EMBER、ELEGANT等系列研究的推进,辅助内分泌治疗的标准或将被改写。
三阴性乳腺癌:铂类的基石地位与“去蒽环”的探索
最后谈及三阴性乳腺癌(TNBC),Gradishar教授指出,尽管免疫治疗(KEYNOTE-522模式)已成为标准方案,但化疗方案的优化仍值得关注。
他通过一系列含铂方案的荟萃分析指出,在TNBC新辅助或辅助化疗中加入卡铂,可显著提高无事件生存率(EFS),且年轻患者的获益更为显著。因此,即便进入免疫治疗时代,铂类药物的化疗基石地位仍不可动摇;尤其对于无法接受免疫治疗的患者,优化化疗方案(加入铂类)的意义更为突出。
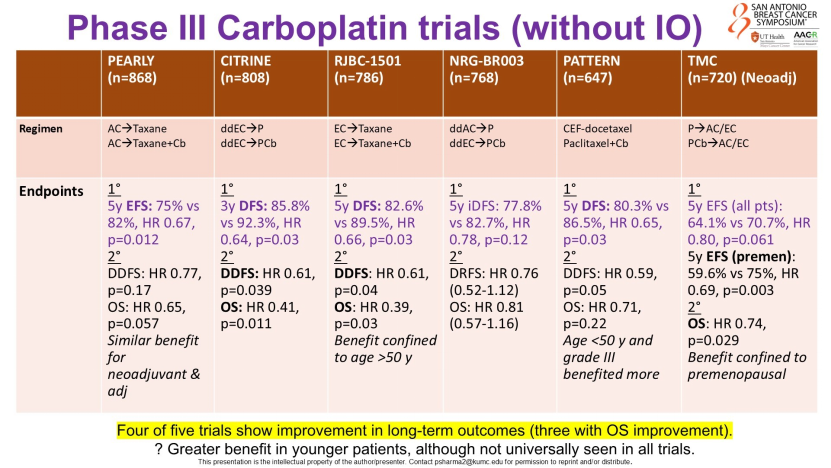
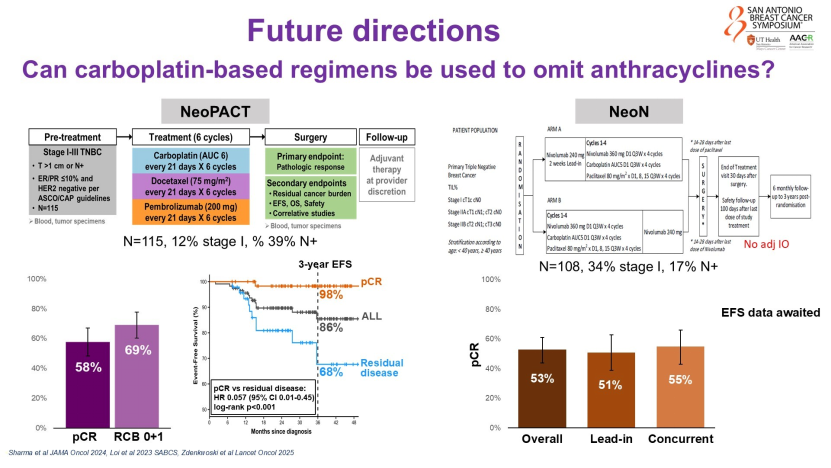
更值得关注的是“去蒽环”的探索趋势。Gradishar教授引用NeoPACT、NeoN等研究数据提出:既然铂类疗效确切,能否舍弃心脏毒性较大的蒽环类药物?数据显示,“非蒽环类铂类方案+免疫治疗”可实现50%-60%的pCR率,疗效可观。他期待正在开展的SCARLET等随机对照试验能给出最终答案,让临床医生有足够的循证依据让TNBC患者规避蒽环类药物的心脏毒性风险。
结语
最后Gradishar教授总结道,早期乳腺癌治疗的趋势是外科与内科的有机结合:外科医生通过一系列严谨的随机对照试验,成功实现了“降阶梯”;而内科医生则在各个亚型中,针对不同高危患者,通过引入多种药物进行了精准的“升阶梯”。尽管这两种策略看似方向相反,但最终都指向同一个目标——治愈乳腺癌。
排版编辑:肿瘤资讯-slb











 苏公网安备32059002004080号
苏公网安备32059002004080号


