三阴性乳腺癌(TNBC)因具有高度异质性且缺乏明确治疗靶点,长期以来是临床管理的难点。在2025年圣安东尼奥乳腺癌研讨会(SABCS)上,“如何治疗三阴性乳腺癌——三阴性不再消极(How to Treat TNBC—Triple-Negative Not so Negative Anymore)”教育专场整合最新循证医学证据,向学界传递出明确信号:TNBC的治疗逻辑正发生根本性转变。本次专场由Marlene Kok教授主持,汇聚了早期、局部晚期及转移性乳腺癌领域的权威专家与患者权益代表,旨在为临床医生提供一份更新的TNBC全病程管理指引。
I期TNBC的治疗决策
I期TNBC(肿瘤≤2cm,无淋巴结转移)的治疗决策始终是临床争议焦点。Elie Rassy教授通过详实的数据分析,探讨了如何在保障疗效的前提下,规避过度治疗带来的长期毒性。
1. 辅助化疗的分层标准
尽管指南通常建议TNBC患者接受化疗,但Rassy教授指出,并非所有I期患者均可从中获益。通过回顾美国监测、流行病学与最终结果(SEER)数据库(n=8601)及多项回顾性研究,他提出了更精细的分层建议:
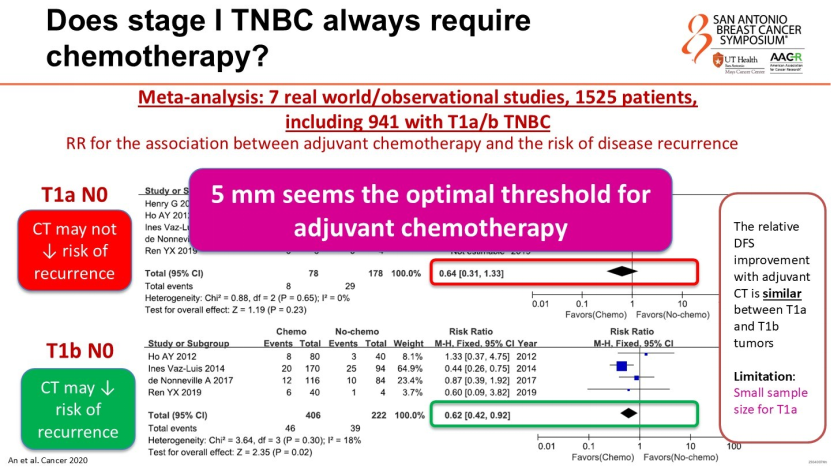
T1a N0(肿瘤<5mm):此类患者预后极佳,化疗并未显著降低复发风险,因此通常不推荐辅助化疗;
T1c N0(肿瘤>10mm):这是明确的化疗指征区间。依据美国临床肿瘤学会(ASCO)和欧洲肿瘤内科学会(ESMO)指南,此类患者以辅助化疗为标准治疗;对于存在高危因素(如Ki-67高表达、脉管侵犯、肿瘤贴近切缘需保乳)的人群,可考虑新辅助治疗以优化手术策略;

T1b N0(肿瘤5-10mm):这是临床决策的难点。数据显示,化疗虽能降低该亚群患者的复发风险,但绝对获益有限。Rassy教授建议将肿瘤5mm作为考虑化疗的起始值,并结合患者年龄、身体状态实施个体化治疗决策。
2. 蒽环类药物的去留
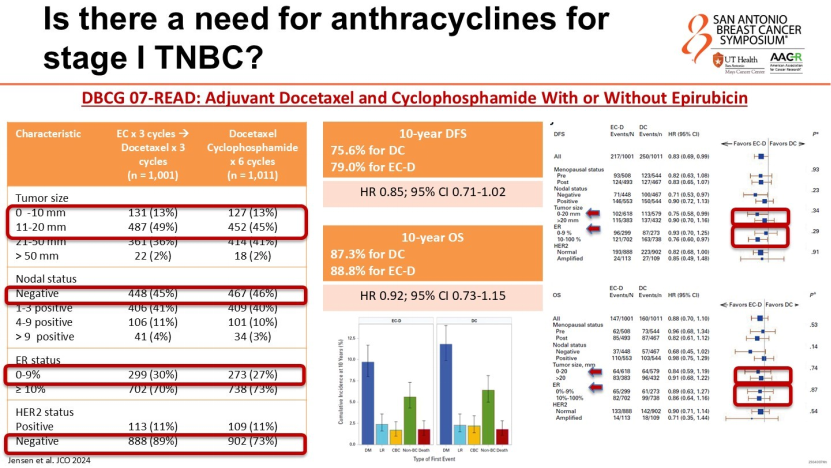
下一个问题是,确定需化疗后,是否必须包含蒽环类药物?Rassy教授引用丹麦乳腺癌协作组(DBCG)07-READ研究、PlanB研究等关键数据指出,在I期TNBC患者中,无蒽环方案(如TC方案:多西他赛+环磷酰胺,6周期)的10年无病生存期(DFS)和总生存期(OS),与含蒽环方案(如EC-T方案)相比无统计学差异。因此,对于心脏毒性风险较高或希望降低治疗毒性的I期TNBC患者,去蒽环方案已成为循证医学支持的标准选择。
3. TILs:超越解剖分期的预后指标
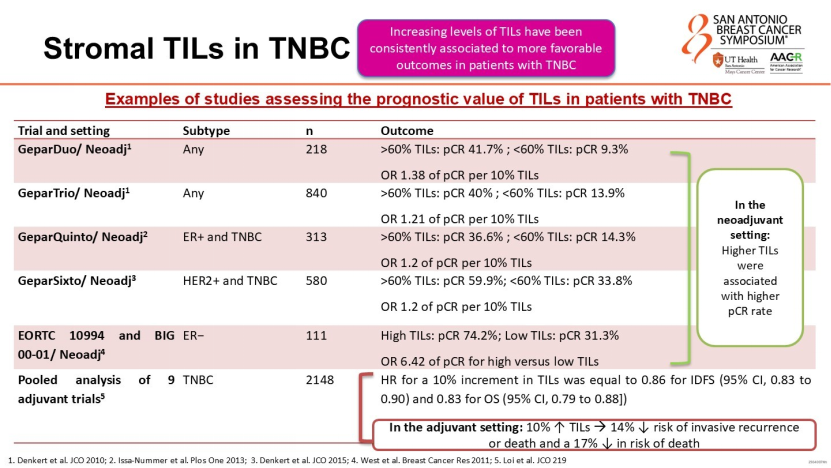
肿瘤浸润淋巴细胞(TILs)不仅是免疫微环境的反映,更是极强的预后保护因素。Rassy教授展示了多中心汇总分析的数据:
未接受化疗的I期TNBC患者中,TILs水平每增加10%,侵袭性疾病复发或死亡风险降低约14%;
当TILs≥30%时,患者预后显著改善;而TILs≥50%时,患者5年总生存率可达95%以上,且该获益独立于化疗。
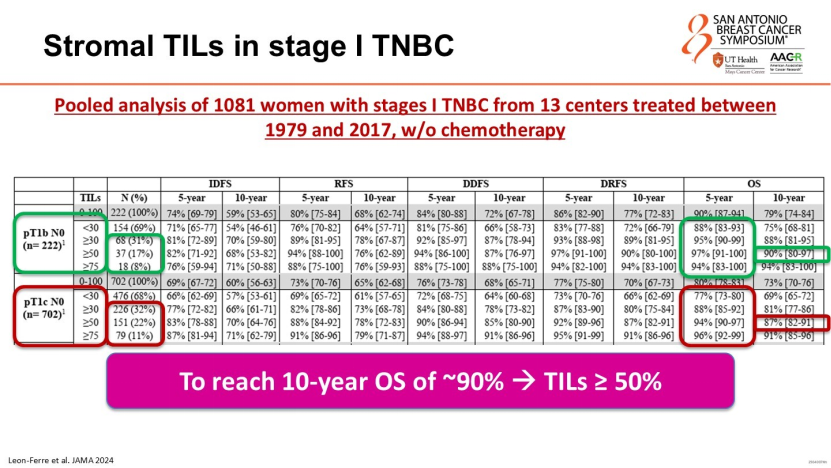
这些数据提示,高TILs水平的I期TNBC患者未来或可完全豁免化疗。目前,ETNA、OPTImaL等前瞻性临床试验正基于此逻辑,旨在验证基于TILs豁免化疗的可行性,有望改写未来的诊疗指南。
II/III期TNBC的强化治疗
对于复发风险较高的II/III期TNBC,治疗目标明确指向病理学完全缓解(pCR)——这是患者长期生存的替代终点。Gustavo Werutsky教授详细梳理了此类人群的新辅助治疗的现状及未来方向。
1. KEYNOTE-522:“欲戴王冠,必承其重”
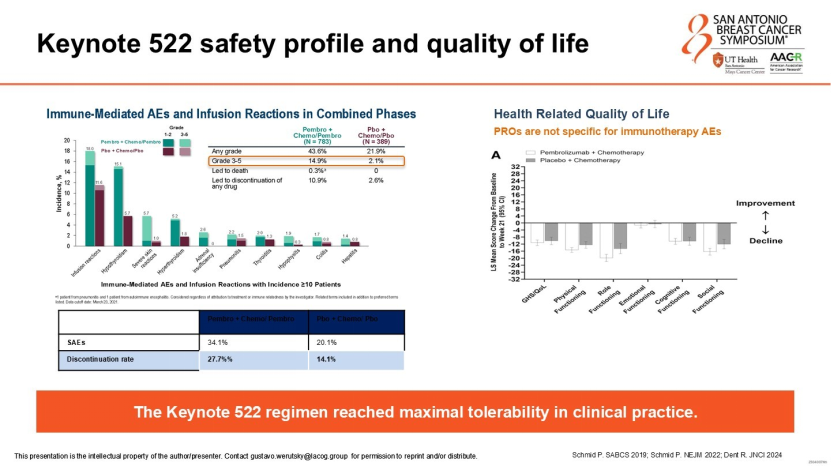
目前,高危早期TNBC的标准治疗已确立为“帕博利珠单抗+化疗(含卡铂)”新辅助方案(KEYNOTE-522模式)。该方案将pCR率提升至64.8%,并显著改善无事件生存期(EFS)。然而,Werutsky教授强调,临床医生必须正视其伴随的挑战:
免疫相关不良事件(irAEs):约14.9%的患者会出现3级及以上irAEs,甲状腺功能异常、肾上腺功能不全等内分泌毒性往往需要终身治疗;
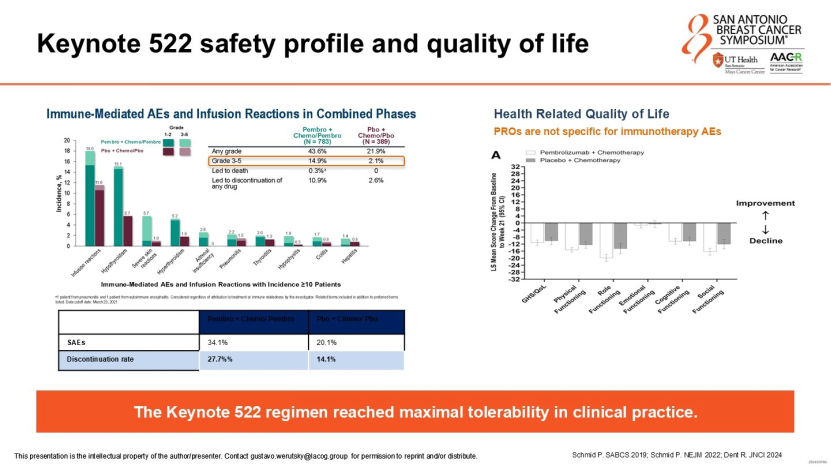
真实世界数据与临床试验的差距:真实世界研究显示,受剂量强度调整、不良反应管理等因素影响,实际pCR率略低于临床试验数据,且停药率更高;
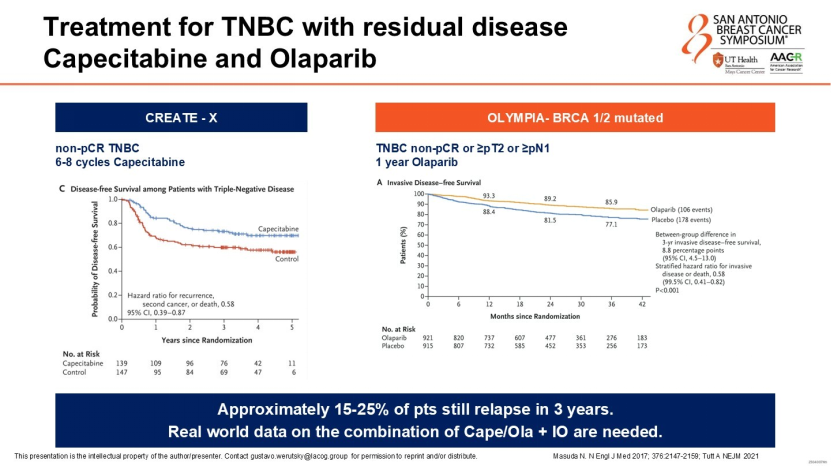
2. 针对Non-pCR患者的治疗升级
新辅助治疗后仍有残留病灶(Non-pCR)的TNBC患者预后较差,目前的标准辅助治疗包括卡培他滨(CREATE-X研究)或奥拉帕利(OlympiA研究,针对gBRCA突变患者)。
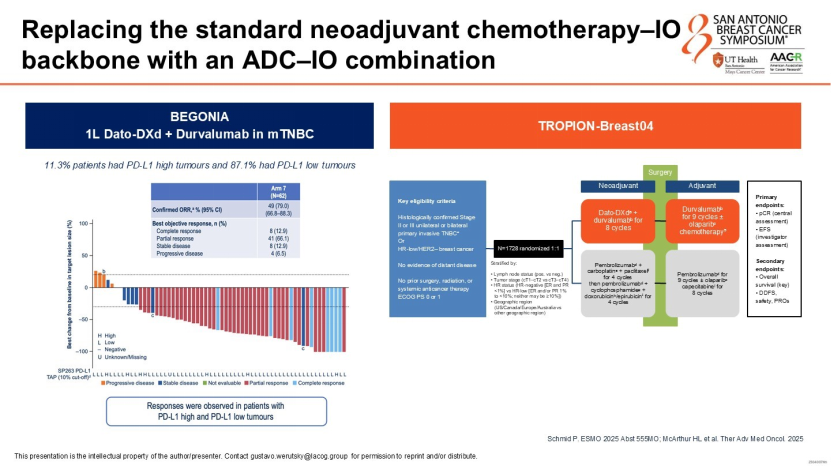
Werutsky教授指出,未来的发展趋势是将抗体药物偶联物(ADC)前移至新辅助阶段。例如,TROPION-Breast04研究正探索Dato-DXd联合免疫治疗在新辅助阶段的应用,试图替代传统化疗,以期在降低治疗毒性的同时提高pCR率,从源头改善高危患者的预后。
3. ctDNA:指导治疗调整的动态标尺
如何更早识别高危患者?Werutsky教授重点介绍了循环肿瘤DNA(ctDNA)的应用前景:
新辅助阶段:ctDNA的早期清除与pCR高度相关,可作为早期疗效的预测指标;
辅助阶段:ctDNA阳性是复发的预测因子之一,通常早于影像学检查发现复发迹象。
未来的治疗模式或将基于ctDNA状态进行动态调整——例如ZEST试验对术后ctDNA阳性患者使用PARP抑制剂进行干预。这种以微小残留病灶(MRD)为驱动的治疗策略,将比传统解剖学分期更为精准。
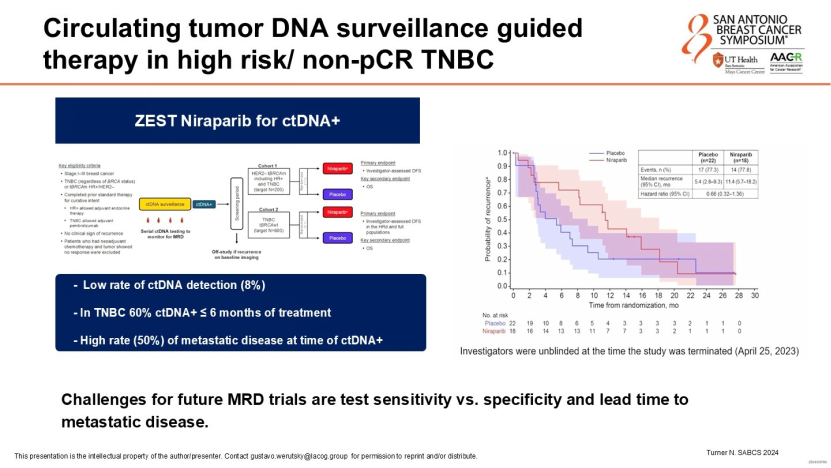
晚期TNBC的治疗格局
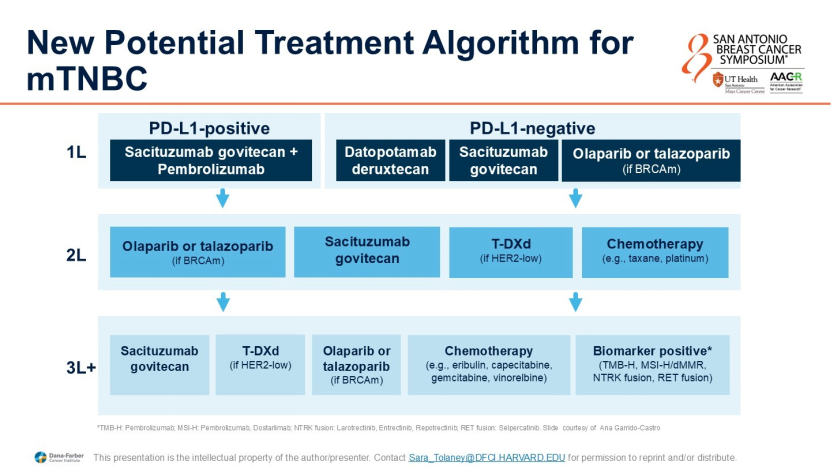
晚期TNBC的治疗已发生颠覆性变化。Sara Tolaney教授通过梳理一线及后线治疗的最新数据,描绘了以ADC药物为核心的治疗图谱。
1. 一线治疗:免疫联合与ADC的博弈
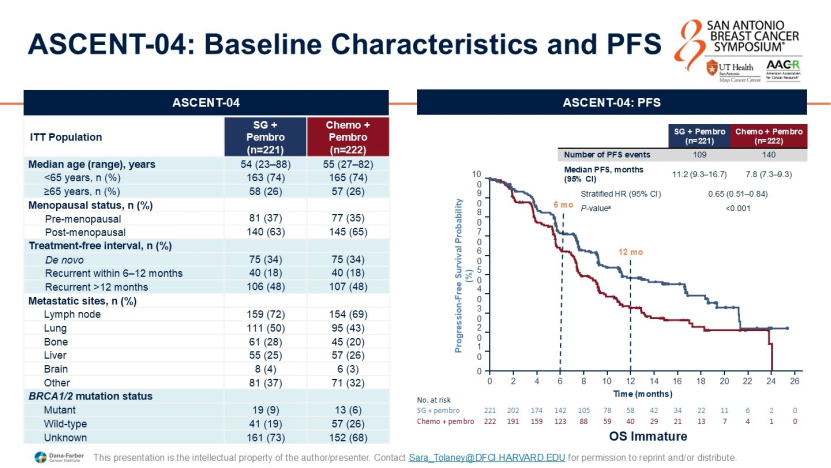
PD-L1阳性(CPS≥10):目前的标准方案为化疗联合帕博利珠单抗(KEYNOTE-355研究)。但最新的ASCENT-04研究显示,戈沙妥珠单抗(SG)联合帕博利珠单抗相比化疗联合免疫治疗,显著延长了无进展生存期(PFS,HR 0.65),且总生存期(OS)呈现获益趋势。这一组合有望成为PD-L1阳性晚期TNBC患者新的优选方案;
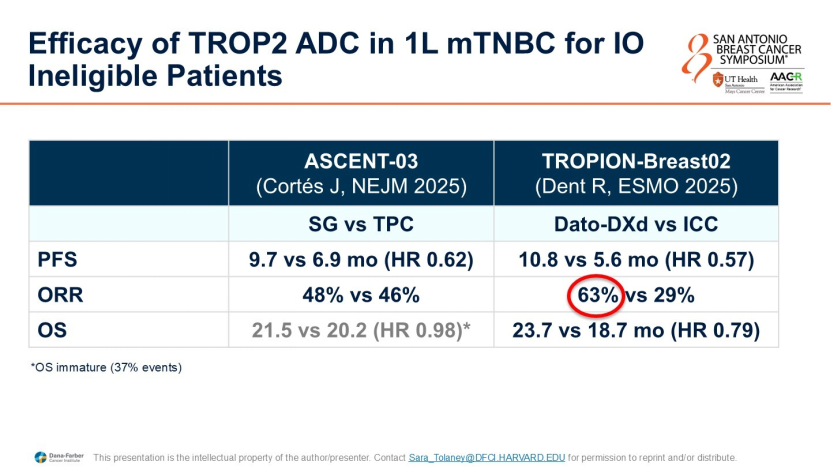
PD-L1阴性:这是传统化疗疗效最差的人群。ASCENT-03(SG)和TROPION-Breast02(Dato-DXd)两项研究均证实,ADC药物在一线治疗中显著优于传统化疗。
药物选择策略:Tolaney教授建议根据毒性谱选择药物。SG的主要毒性为中性粒细胞减少和腹泻,Dato-DXd则需重点关注口腔炎和干眼症;此外,Dato-DXd在早期复发(<6个月)人群中拥有更具体的数据支持。

2. 特殊人群:gBRCA突变患者的排兵布阵
对于携带gBRCA突变的晚期TNBC患者,治疗选择需综合考量PD-L1状态:
PD-L1阴性:鉴于PARP抑制剂的生活质量获益优于化疗和ADC,且一线应用时PFS获益更显著,建议优先使用PARP抑制剂;
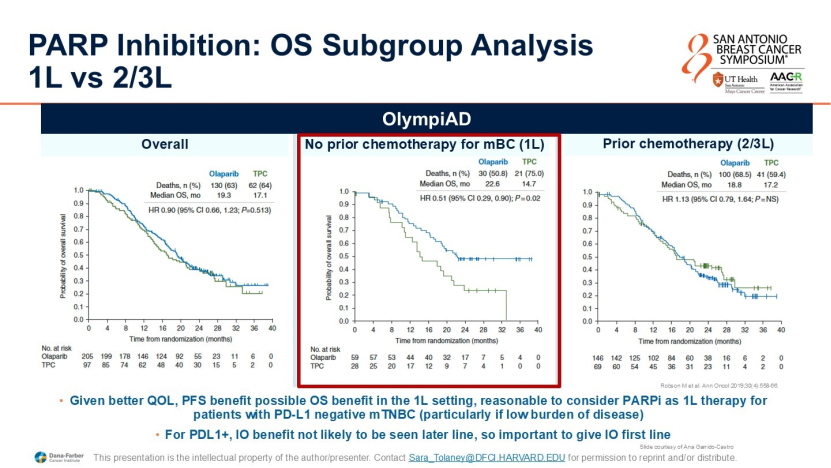
PD-L1阳性:鉴于免疫治疗在后线应用时疗效大幅下降,建议一线优先使用含免疫方案(如免疫+化疗或免疫+ADC),将PARP抑制剂留作后线治疗。
3. 后线治疗困境与ADC序贯使用
随着ADC药物前移至一线治疗,二线及后线治疗面临新的挑战。Tolaney教授指出,ADC治疗进展后转回传统化疗的疗效极差(PFS仅约2~3个月)。
目前的探索方向是ADC的序贯使用(如SG进展后使用T-DXd)。尽管拓扑异构酶载体交叉耐药等机制导致疗效有所降低,但真实世界数据显示,其PFS仍优于化疗。此外,针对HER2超低表达(Ultra-low)人群的T-DXd应用、靶向B7H4等新靶点的ADC药物研发,是解决后线耐药问题的关键突破口。
患者视角的治疗考量
会议最后,一位晚期TNBC长期幸存者Janice Cowden女士结合患者分享了自己就诊多年的真实体验。作为患者权益代表,Cowden女士指出临床研究在追求疗效数据的同时,须关注患者的实际生存质量。
1. 真实世界中的ADC毒性负担
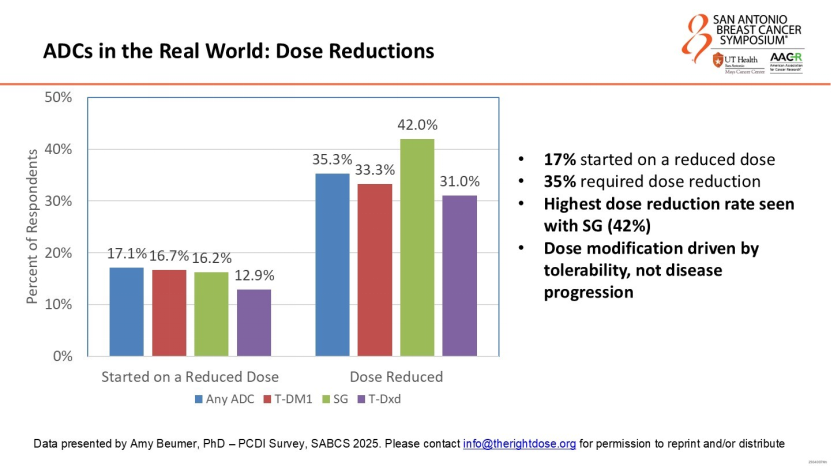
Cowden女士分享了一项由患者组织发起的ADC药物体验调查(PCDI)结果:超过80%的患者经历了严重影响日常生活的副作用,其中使用SG的患者中约42%需要下调剂量。这提示临床试验中报告的不良反应数据可能低估了患者在真实生活中的困扰。
“最大耐受剂量”与“患者中心剂量”
她提出了一个引人深思的观点:肿瘤学传统剂量设定多基于最大耐受剂量,但晚期乳腺癌需长期维持治疗,属于慢病管理模式;许多患者通过主动调整剂量,反而获得了更长的治疗持续时间和更好的生活质量。因此,Cowden女士呼吁临床医生制定治疗方案时,应结合患者的耐受性和生活诉求灵活调整剂量,避免因治疗毒性过高导致患者过早终止有效治疗。
总结
2025年SABCS的这场TNBC专场会议,清晰勾勒出该领域从“解剖学分期”向“生物学分层”演进的轨迹:
在早期TNBC领域,利用TILs等生物标志物筛选低危人群,推行化疗降阶梯策略;
在高危局部晚期TNBC领域,通过新辅助免疫联合治疗及潜在的ADC前移应用,最大化pCR获益;
在晚期TNBC领域,ADC药物已全面重塑一线及后线治疗格局,即便是PD-L1阴性患者也迎来了强效治疗选择。
未来的挑战将集中在两方面:一是如何利用ctDNA等工具实现动态精准监控;二是如何在患者生存时间不断延长的背景下,通过剂量优化以提升患者的生活质量。
排版编辑:肿瘤资讯-slb











 苏公网安备32059002004080号
苏公网安备32059002004080号


