在2025年的美国圣安东尼奥乳腺癌研讨会(SABCS)上,人工智能(AI)已不再是充满未来感的科幻话题,而是成为亟需解决临床痛点的工具。尽管医学领域的人工智能研究成果日益增多,但在临床一线的使用率仍十分有限。本次“Real Impact with Artificial Intelligence”的教育专场,摒弃了空泛的愿景描绘,由病理学家Johan Hartman教授、数据专家Tufia Haddad教授、计算生物学家Amrita Basu教授以及患者权益倡导者Carole L. Baas教授组成的跨界团队,共同剖析了人工智能从微观病理到宏观卫生系统,再到患者床边的真实落地路径。
数字病理——从形态到分子的“降维打击”
病理诊断不仅是肿瘤治疗的“金标准”,也是人工智能成果显著的领域之一。在第一场“Digital Biomarkers and Risk Prediction”的汇报中,Johan Hartman教授并未停留在介绍人工智能如何计数细胞,而是展示了其如何挖掘人类病理学家肉眼无法感知的信息,以解决传统病理学面临的主观性难题。
破解人为判读的“罗生门”
Ki67指数和肿瘤浸润淋巴细胞(TILs)是乳腺癌预后和疗效预测的关键指标,但在实际操作中,不同实验室、不同病理医生的判读差异极大(组内/组间差异),这直接干扰了临床决策的标准化。Hartman教授团队在三阴性乳腺癌(TNBC)的新辅助治疗研究中证实,人工智能量化的TILs不仅消除了这种人为误差,其计算出的TILs水平能比人工判读更精准地预测患者是否可达到病理完全缓解(pCR)。这种客观准确性的提升,使TILs从模糊的参考项真正转变为可靠的伴随诊断标志物。
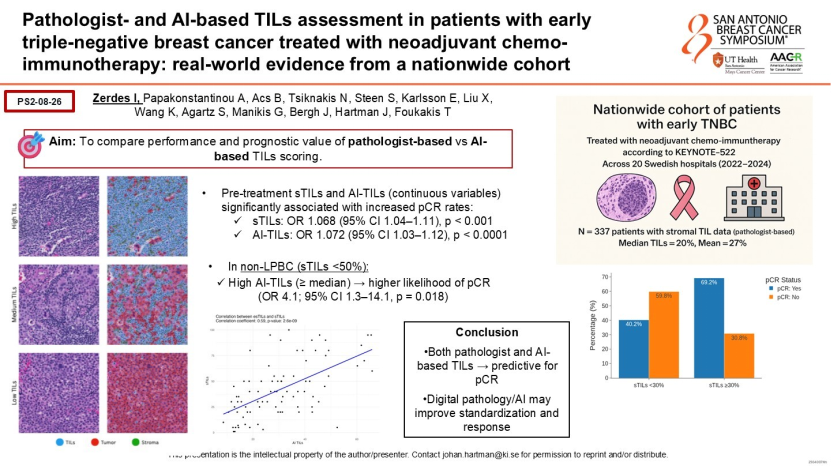
用H&E切片替代昂贵的分子检测
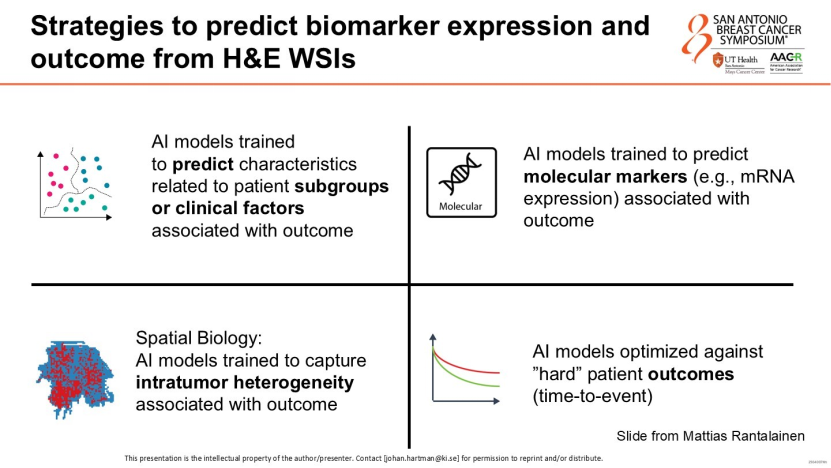
传统的空间转录组学虽能揭示肿瘤内部的异质性,但成本高昂且技术复杂,难以在临床普及。Hartman教授展示了人工智能的“虚拟染色”能力——通过深度学习模型,人工智能可直接从最常规、最廉价的H&E染色切片中,预测出基因的表达水平和空间分布。这意味着一张切片在人工智能眼中蕴含着数千元分子检测的信息量,实现了从形态学到分子生物学的低成本跨越。
Stratipath如何破解风险分级难题?
在乳腺癌诊疗中,约50%的雌激素受体阳性(ER+)/HER2阴性(HER2-)患者被分级为“组织学2级”。这是一个极具争议的结果,其生物学行为介于低风险和高风险之间,医生对于其是否需要化疗往往存在分歧。Hartman教授介绍了已经临床使用的人工智能工具Stratipath——该模型基于数万例患者数据训练,能够敏锐捕捉人类肉眼难以察觉的微观形态学特征,将原本模糊的“组织学2级”患者精准重新划分为高风险或低风险组。
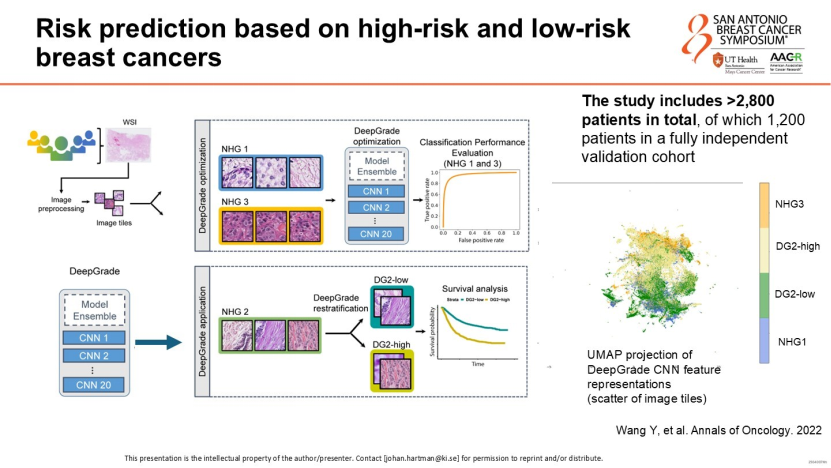
这一分层结果具有独立的预后价值,且相较于传统方案优势显著:
极速与便捷:基于云端分析,仅需上传切片扫描件,几分钟内即可出具报告,而非数周。
成本骤降:相比于Oncotype DX等昂贵的基因检测,成本降低90%以上。这对医疗资源匮乏地区实现精准医疗具有重要意义。
打破数据孤岛——用“产品思维”重塑医疗系统
当我们拥有海量数据时,为何癌症死亡率的下降速度仍赶不上医学知识的增长速度?Tufia Haddad教授在“Big Data to Solve Big Problems”的汇报中从宏观视角指出,这一问题的答案不在于缺少算法,而在于缺乏解决问题的“产品思维”。
从“回答问题”到“解决问题”
Haddad教授提出了一个发人深省的观点:当前的人工智能项目大多是在回答问题,而非解决问题。以MRI补充筛查为例,对于“这位女性是否符合筛查条件?”这一问题时,传统人工智能模型可能给出“是”的答案,然而现实中的患者仍可能不去做检查。若运用“产品思维”需要解决的问题则是:“为何符合条件的女性大多未接受筛查?”此时,人工智能系统不再是简单的预测模型,而是一个逻辑闭环:识别高危人群-自动触发电子病历中的转诊流程-向医生发送决策支持信号-自动向患者发送科普教育,确保“从识别到行动”的全流程顺利执行。

破局之道:联邦学习(Federated Learning)
在实现这一愿景的过程中,医疗数据的隐私保护和“数据孤岛”是两座继续翻越的大山。Haddad教授介绍了梅奥诊所平台采用的“联邦学习”架构——“数据不动模型动”。全球的合作医院无需将患者数据上传到中心服务器,而是让人工智能模型去各家医院学习。模型在医院本地学习后,仅将学到的智慧(参数更新)传回,原始数据始终保留在本地(数据不外出)。这种机制既保护了隐私,又让模型接触到更多样化的数据,极大提升了人工智能在不同人种、不同地域患者中的泛化能力,以避免算法“偏见”。
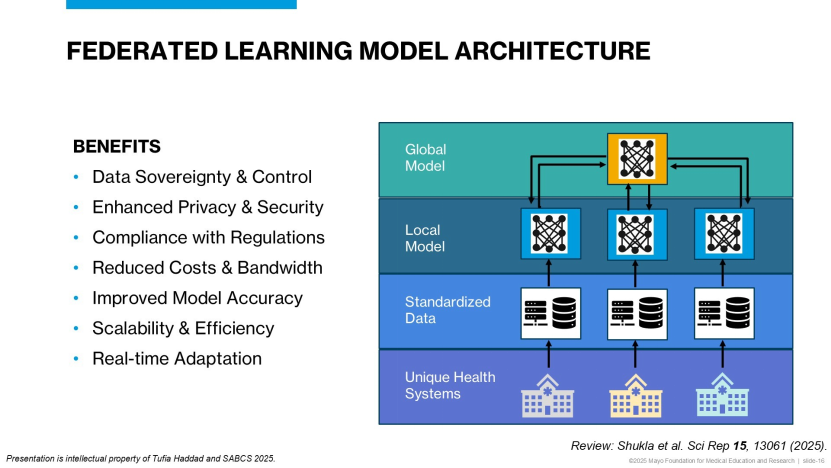
在Haddad教授描绘的未来图景中,我们将走向“学习型卫生系统”:利用真实世界数据进行模拟试验,甚至为患者构建“数字生命”。每一次临床诊疗的数据都会实时反哺系统,让人工智能越来越智能,最终实现从“千人一药”到“一人一策”的跨越。

重新定义症状管理——人工智能编织的“隐形安全网”
随着抗体药物偶联物(ADC)和免疫治疗的普及,治疗相关毒性管理变得空前复杂。Amrita Basu教授在“The PROmise of Patient Reported Outcomes”报告中指出,传统的不良反应记录方式已显滞后,我们需要利用人工智能挖掘患者报告结局(PROs)中的深层价值。
信息论视角:捕捉“风暴前的蝴蝶振翅”
Basu教授创造性地引入“信息论”审视症状数据。她认为,长期稳定的症状(如持续的轻微乏力)信息量很低,而突发的、波动的症状(非线性拐点)才是高价值信号。人工智能的任务就是从海量PROs数据中识别这些高信息量的拐点。
I-SPY试验提供了极具说服力的案例。针对一种易引起间质性肺病(ILD)的新药,研究团队部署了一套人工智能监测系统。该系统并未等待患者出现严重呼吸困难才报警,而是综合分析PROs(患者自述气短)、肺功能数据和影像学变化。结果显示,系统成功在15%的患者中捕捉到极早期的1级ILD。由于发现及时,医生迅速干预,最终没有一位患者发展为危及生命的严重不良事件(SAEs)——这正是人工智能作为“哨兵”的真实价值。
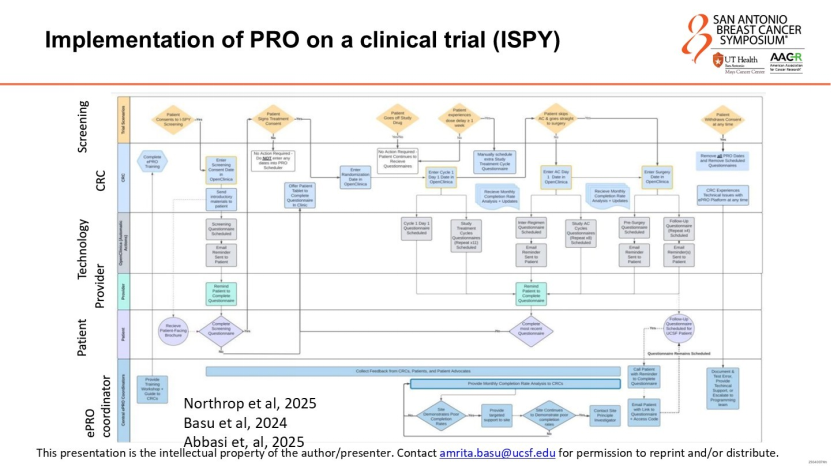
避免幻觉:知识图谱与智能分诊
目前的大语言模型(LLM)虽能与患者对话,但容易产生医学上的“幻觉”。Basu教授提出,须构建知识图谱作为LLM的“大脑皮层”。知识图谱将零散的数据(如“患者自述右臂无力”、“既往有骨转移病史”、“近期步数下降”)编织成一张有逻辑关联的网。当人工智能分析时,它并非凭空猜测,而是基于医学逻辑推导:如骨转移+肢体无力+活动量下降=高度疑似脊髓压迫。
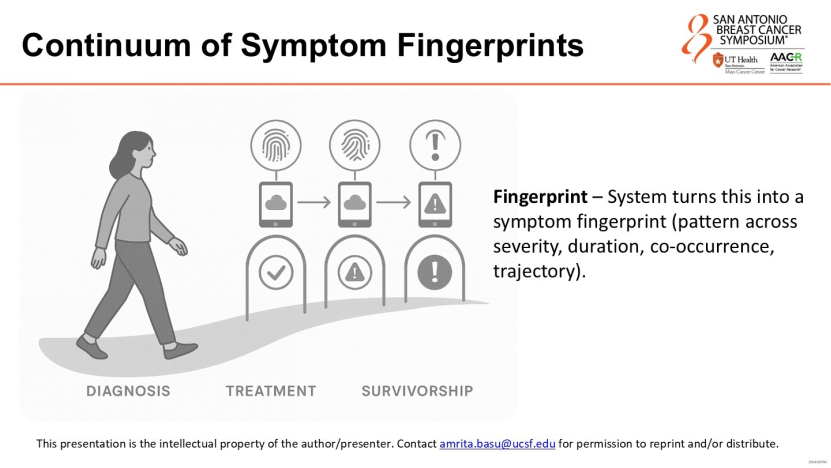
基于此,人工智能能为每位患者绘制独特的“症状指纹”,动态对比患者今日状态与历史基线:
低风险时,人工智能自动回复居家护理建议(如“多喝水”);
高风险时,人工智能直接向护士站发送红色预警,并附上如“患者正在使用免疫治疗,现出现3级腹泻迹象”的精准描述。这不仅释放了医护人员的精力,更确保了高危患者能得到快速响应。
患者倡导者视角——信任是人工智能落地的“最后一公里”
会议最后,生物医学工程师、两次乳腺癌的幸存者Carole L. Baas博士走上讲台,以演进的形式提醒在座的科学家和医生们:若没有患者的信任,所有高科技都将束之高阁。
Baas博士指出,部分媒体将AI渲染为“怪物”,让公众深感不安。有数据显示,75%的美国人认为医疗AI发展过快,其中女性对人工智能介入医疗的不适感(66%)远高于男性(54%)。考虑到乳腺癌患者绝大多数是女性,这意味着在推广AI工具时,面临着比其他癌种更大的信任阻力。然而,患者并不排斥技术,她们欢迎人工智能用于改善预约流程、监测健康或加速新药研发;但她们反对由人工智能决定止痛药剂量(因其缺乏同情心),也不希望在确诊癌症这样的重大时刻面对冷冰冰的机器人。
因此,建立信任的方式之一是早期介入,即在项目的“发现阶段”,便应邀请患者代表进入实验室,解释人工智能的工作原理,展示它是医生的“助手”而非“替代者”。只有当患者理解人工智能是来保护她们,这种信任才会建立。
总结与展望:技术向善,以人为本
本次教育专场通过四位讲者的接力,勾勒出了一幅完整的人工智能医疗图景:
技术端(Hartman):挖掘肉眼不可见的信息,实现低成本、高精度的诊断。
系统端(Haddad):打破数据壁垒,构建自我进化的学习型卫生系统。
应用端(Basu):通过智能监测,捕捉早期毒性信号,提升生存质量。
患者端(Baas):直面信任危机,同步进行伦理构建和患者教育。
最后,关于人工智能与医生的关系,正如Johan Hartman教授在会议现场所强调的:它不会取代病理学家,而是为治疗医师提供决策支持的工具。(So this is a risk stratification that does not replace the pathologist, it is a decision support tool primarily for the treating physician.)
排版编辑:肿瘤资讯-slb











 苏公网安备32059002004080号
苏公网安备32059002004080号


