2025年12月9日至12日,全球乳腺癌学术界的目光再次聚焦于美国德克萨斯州圣安东尼奥。作为乳腺癌领域规模最大、最具影响力的国际性学术会议,第48届圣安东尼奥乳腺癌研讨会(SABCS)盛大召开。
作为本次大会的重要环节,“转移性乳腺癌年度回顾(Metastatic Breast Cancer: Year in Review)”专场由范德堡大学医学中心的Sonya Reid教授担任主讲嘉宾 。
Reid教授系统梳理了2025年乳腺癌领域的关键临床研究进展,重点阐述了三阴性乳腺癌(mTNBC)、HER2阳性乳腺癌及激素受体阳性(HR+)/HER2阴性乳腺癌的治疗格局变化 。【肿瘤资讯】整理如下,以飨读者。

三阴性乳腺癌(mTNBC):ADC进军一线,免疫联合治疗确立新标杆
三阴性乳腺癌因其侵袭性强、预后差,长期以来被称为乳腺癌治疗的“洼地”。然而,2025年无疑是mTNBC治疗格局发生剧变的一年。Sonya Reid 教授指出,抗体偶联药物(ADC)正从后线大举进军一线,重塑了治疗版图。
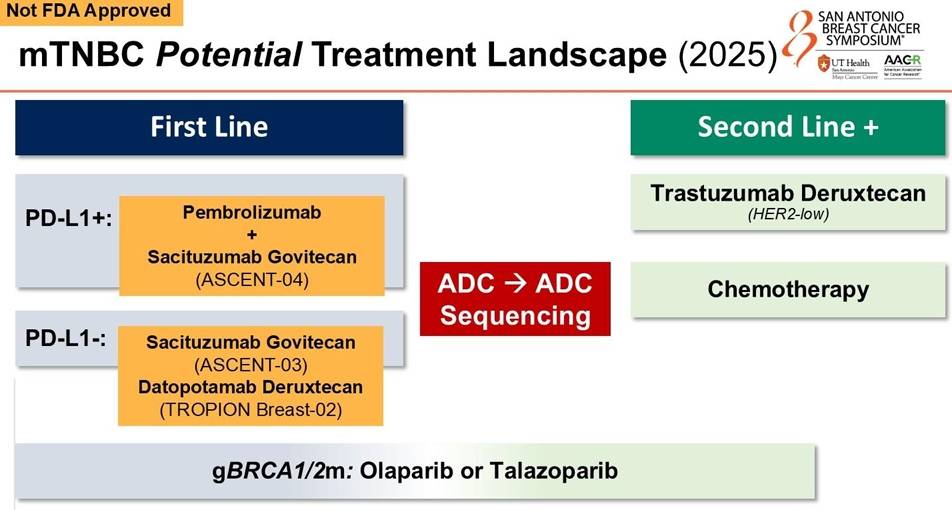
1. 免疫联合ADC:ASCENT-04 重写PD-L1阳性人群一线标准
在PD-L1阳性mTNBC患者的一线治疗中,化疗联合免疫治疗曾是标准方案。然而,ASCENT-04 研究的惊艳数据彻底打破了这一局面。
研究设计:该研究对比了戈沙妥珠单抗(SG)联合帕博利珠单抗(Pembrolizumab)与化疗联合帕博利珠单抗在一线治疗PD-L1阳性mTNBC患者中的疗效。
重磅数据:结果显示,SG联合免疫组的中位无进展生存期(PFS)达到了 11.2个月,显著优于化疗联合免疫组的 7.8个月(HR 0.65, 95% CI 0.51-0.84, P<0.001)。更令人振奋的是,SG联合组的12个月PFS率高达48%,远超对照组的33%。尽管总生存期(OS)数据尚未成熟,但已显示出获益趋势(HR 0.89)。
2. ADC单药的一线突围:ASCENT-03 与 TROPION-Breast02
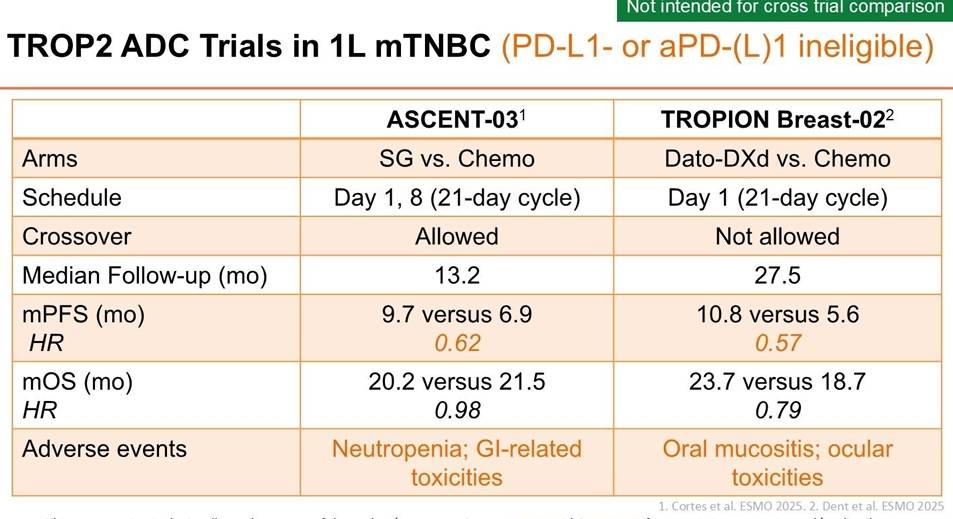
对于PD-L1阴性或不适用免疫治疗的患者,化疗的地位也岌岌可危。两项针对TROP2 ADC的重磅研究——ASCENT-03和TROPION-Breast02,分别从不同角度证实了ADC单药优于传统化疗。
ASCENT-03研究:评估了SG单药对比医生选择的化疗(TPC)在一线治疗PD-L1阴性或免疫不适用人群中的疗效。结果显示,SG组的中位PFS达到 9.7个月,显著长于化疗组的6.9个月(HR 0.62, P<0.0001)。然而,OS并未显示出统计学显著差异(20.2个月 vs 21.5个月),这可能与允许交叉治疗有关。
TROPION-Breast02研究:探索了另一款TROP2 ADC——德达博妥单抗(Dato-DXd)在一线治疗中的表现。数据显示,Dato-DXd组的中位PFS达到了 10.8个月,几乎是化疗组(5.6个月)的两倍(HR 0.57, P<0.0001)。更重要的是,该研究在OS上也取得了阳性结果(23.7个月 vs 18.7个月,HR 0.79),成为该人群中首个证实OS获益的TROP2 ADC研究。
针对上述研究,Sonya Reid 教授在报告中提出了深刻的临床思考:
药物选择的考量:虽然ASCENT-03和TROPION-Breast02均证实了ADC的PFS获益,但两者在安全性谱上存在显著差异。SG的主要不良反应为中性粒细胞减少和胃肠道毒性,而Dato-DXd则更多表现为口腔黏膜炎和眼部毒性。临床医生需根据患者的具体耐受情况进行个体化选择。
OS数据的解读差异:为何ASCENT-03未见OS获益而TROPION-Breast02不仅PFS获益且OS显著?Reid教授指出,ASCENT-03允许对照组患者交叉使用SG,这在很大程度上稀释了OS获益;而TROPION-Breast02不允许交叉,从而更清晰地展现了药物的生存优势。
未解之题:随着ADC前移至一线,二线治疗该如何排兵布阵?“ADC之后能否再用ADC(ADC Sequencing)?”成为了目前最大的悬念。Reid教授强调,目前尚缺乏生物标志物来指导ADC的序贯使用,这需要未来的临床试验给出答案。
HER2阳性乳腺癌:一线治疗的“天花板”再被打破
HER2阳性晚期乳腺癌的一线治疗长期以“妥妥双靶”联合化疗(THP方案)为标准,2025年的主要进展集中在一线治疗方案的升级及维持治疗的强化。
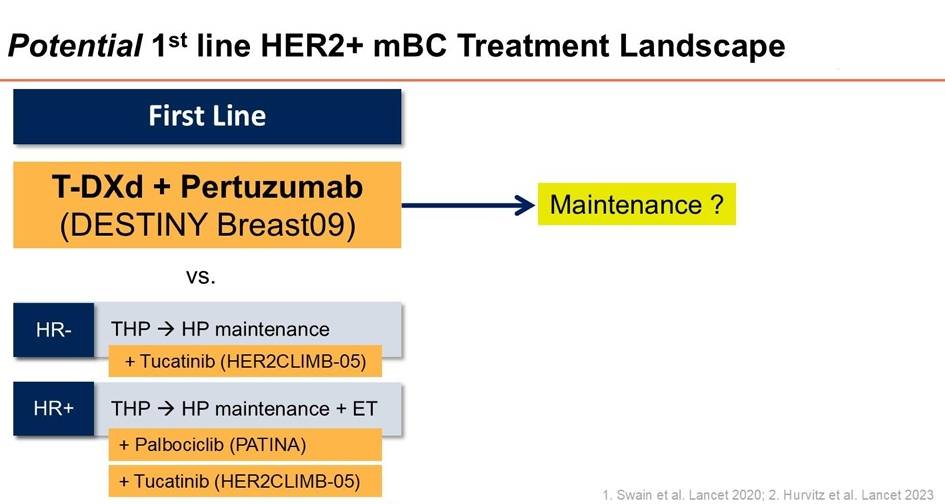
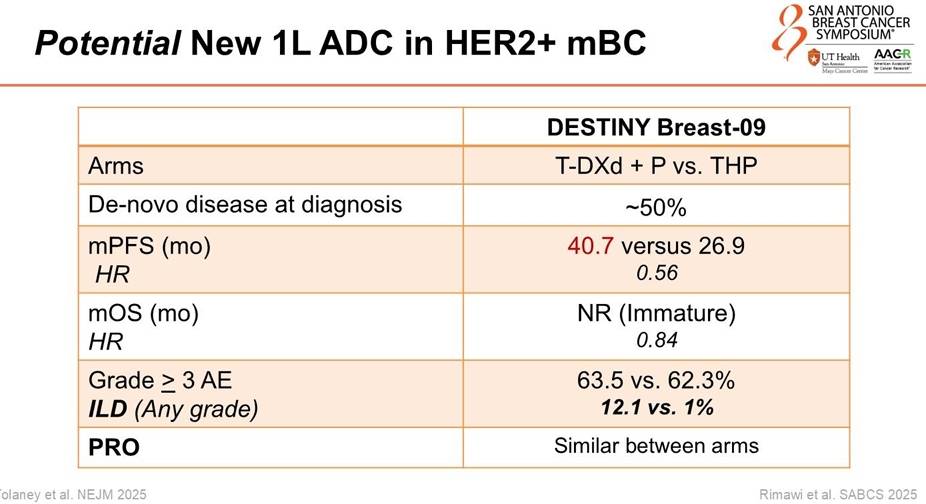
1. DESTINY-Breast09:T-DXd+帕妥珠单抗刷新PFS纪录
数据:这项III期临床试验对比了 T-DXd(德曲妥珠单抗)+帕妥珠单抗(P)与标准THP方案。结果显示,T-DXd+P组的中位PFS达到了惊人的 40.7个月,而标准THP组为26.9个月(HR 0.56, P<0.00001)。这意味着患者在接受一线治疗后,平均超过3年不发生疾病进展,突破了既往所有一线治疗的生存记录。
亚组一致性:无论患者是新发转移还是复发转移,无论HR状态如何,甚至在脑转移患者中(HR 0.30),T-DXd+P方案均显示出压倒性的优势。
安全性与PRO:尽管疗效显著提升,但患者报告结局(PRO)显示,T-DXd+P组的治疗副作用困扰程度与THP组相似,未显著降低患者生活质量。间质性肺病(ILD)发生率为12.1%,但多为低级别,需密切监测。
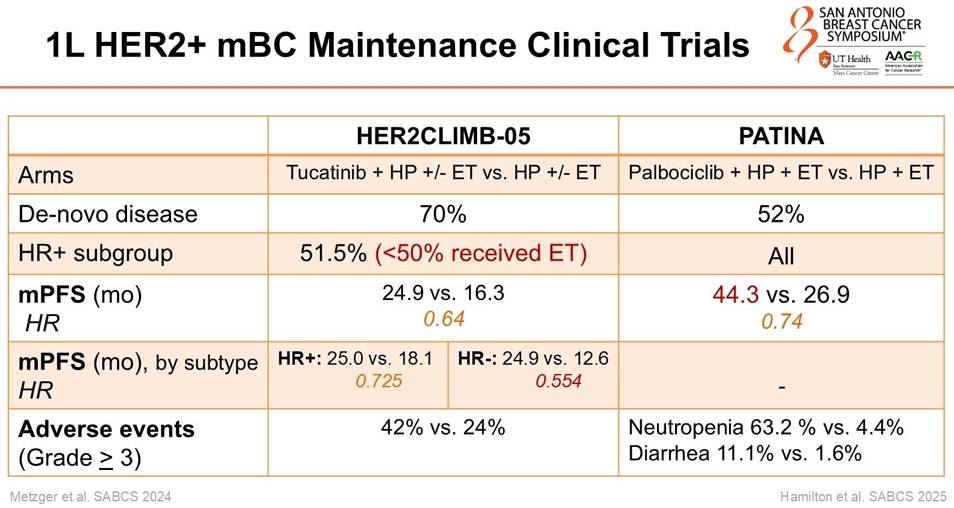
2. HER2CLIMB-05:一线维持治疗的新策略
对于接受了THP诱导治疗后病情稳定的患者,如何进一步延缓复发?HER2CLIMB-05研究给出了“加法”策略。
研究发现:在标准的HP维持治疗基础上加入小分子TKI图卡替尼(Tucatinib),将中位PFS从16.3个月延长至 24.9个月(HR 0.64, P<0.0001)。特别是在HR阳性亚组中,PFS获益更为显著(25.0个月 vs 18.1个月)。
Sonya Reid 教授在总结HER2+治疗格局时,提出了“疗效与耐受性平衡”的关键命题:
一线方案的抉择:面对DESTINY-Breast09的超长PFS和HER2CLIMB-05的维持治疗策略,临床该如何选择?Reid教授认为,对于肿瘤负荷大、急需缩瘤的患者,T-DXd+P无疑是首选;而对于那些希望避免ADC潜在毒性(如ILD)或追求全口服维持治疗的患者,THP诱导后接续Tucatinib维持可能是一个更温和的选择。
脑转移患者的福音:DESTINY-Breast09在脑转移亚组中展现出的0.30的HR值令人印象深刻,这进一步巩固了T-DXd在脑转移控制中的地位。
诱导治疗的探索:Reid教授还提到了正在进行的DEMETHER研究,探讨是否可以通过短期的T-DXd“诱导”治疗(6周期),随后转换为HP维持,从而在保证疗效的同时降低毒性。这种“去阶梯”的思维可能是未来的重要方向。
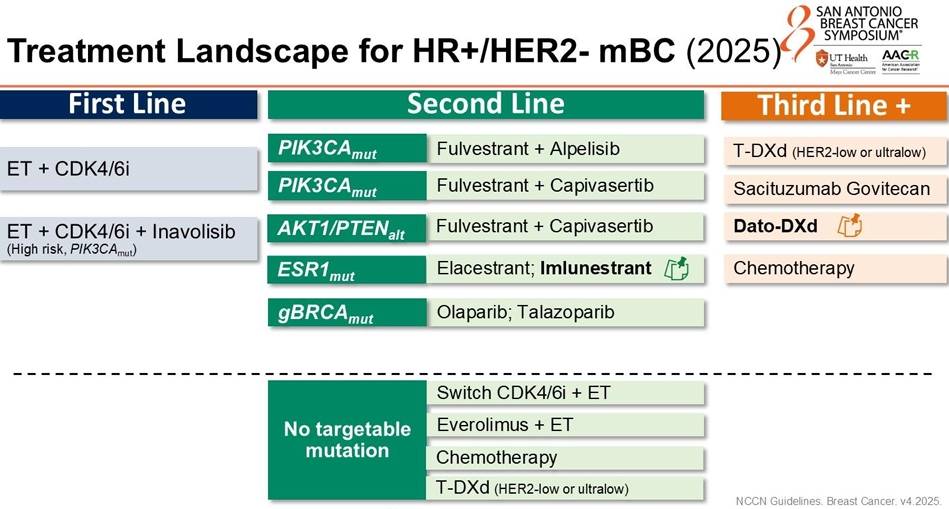
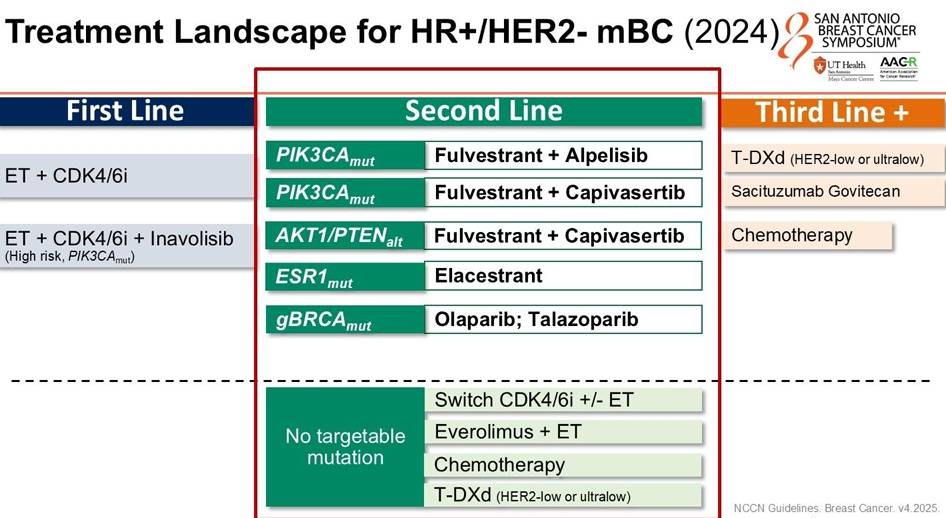
HR+/HER2-乳腺癌:口服SERD百花齐放,精准靶向全面升级
HR+/HER2-mBC是乳腺癌中占比最大的人群,CDK4/6抑制剂耐药后的治疗一直是难点。2025年,随着多款新型口服选择性雌激素受体降解剂(SERD)及PI3K/AKT通路抑制剂的成功,后线治疗迎来了“精准化、口服化”的春天。
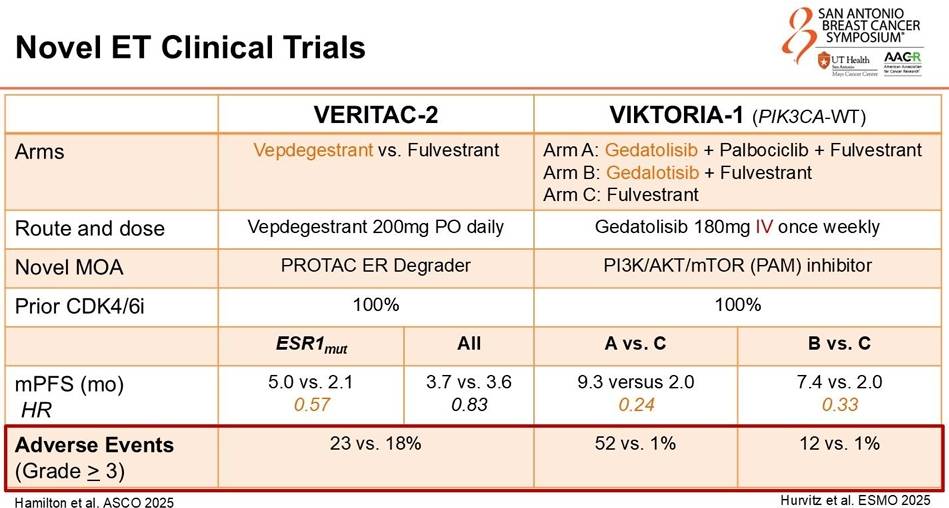
1. 口服SERD的崛起:VERITAC-2、eVERA 与 SERENA-6
VERITAC-2(Vepdegestrant):作为一种PROTAC技术的ER降解剂,Vepdegestrant在二线治疗中对比氟维司群展现了显著优势,特别是在ESR1突变人群中,中位PFS从2.1个月提升至 5.0个月(HR 0.57)。这表明新型降解剂能更有效克服ESR1突变导致的耐药。
eVERA(Giredestrant + 依维莫司):这项研究探索了口服SERD与mTOR抑制剂的全口服联合方案。在ESR1突变人群中,Giredestrant联合依维莫司将中位PFS延长至 9.99个月,显著优于标准SOC联合依维莫司的5.45个月(HR 0.38),且安全性可控。
SERENA-6(Camizestrant):该研究创新性地采用ctDNA监测,在患者尚未影像学进展但出现ESR1突变时,即从AI切换为Camizestrant(同时继续CDK4/6i治疗)。结果显示,这种“分子复发”阶段的干预将PFS显著延长(16.0个月 vs 9.2个月,HR 0.44),开创了基于ctDNA指导的精准换药新模式。
2. PI3K/AKT/mTOR通路的全面围剿:VIKTORIA-1 与 Inavolisib
VIKTORIA-1(Gedatolisib):针对PIK3CA野生型这一难治人群,泛PI3K/mTOR抑制剂Gedatolisib联合氟维司群+哌柏西利的三药方案,将PFS提升至 9.3个月(对照组2.0个月,HR 0.24)。这填补了PIK3CA野生型患者靶向治疗的空白。
伊那利塞(Inavolisib):作为新一代PI3K抑制剂,Inavolisib联合一线治疗不仅PFS获益,更在近期公布了OS数据(34.0个月 vs 27.0个月,HR 0.67),成为首个显现OS优势的PI3K抑制剂方案,为PIK3CA突变的高危患者确立了一线强化治疗的新标准。
面对琳琅满目的新药,Sonya Reid 教授梳理了HR+/HER2- mBC的治疗逻辑:
生物标志物是核心:未来的治疗路径将严格依赖于基因检测。PIK3CA突变者一线首选Inavolisib联合方案;ESR1突变者在后线可优先考虑口服SERD(如Imlunestrant, Camizestrant);而PIK3CA野生型患者则可从Gedatolisib或Capivasertib中获益。
口服药物的便利性:Reid教授强调,eVERA等研究展示的全口服方案(All-Oral Regimen)不仅疗效优异,更极大提升了患者的依从性和生活质量,是未来“去针剂化”治疗的重要趋势。
向愈而生,未完待续
Sonya Reid 教授的年度盘点,为我们勾勒了一幅激荡人心的2025乳腺癌治疗画卷。从mTNBC的ADC一线“双子星”,到HER2+领域T-DXd创下的“40个月PFS”奇迹,再到HR+领域精准靶向的精细化布局,乳腺癌诊疗正在以前所未有的速度向“慢病化”迈进。



然而,挑战依然存在。ADC药物的耐药机制、最佳序贯策略、以及如何利用液体活检(ctDNA)更早地指导治疗调整,仍是摆在临床医生面前的“未解之题”。正如Reid教授在幻灯片最后所列出的“Unanswered Questions”那样:科学的探索永无止境,每一次数据的更新,都是为了让患者活得更长、活得更好。
排版编辑:肿瘤资讯-Kelly











 苏公网安备32059002004080号
苏公网安备32059002004080号


