在非小细胞肺癌(NSCLC)的精准治疗版图中,间变性淋巴瘤激酶(ALK)重排被称为“钻石突变”,其对应的靶向药物通常能带来显著的生存获益。然而,除了我们熟知的EML4-ALK经典融合外,临床上还存在着约10%的非经典/罕见融合类型[1]。这些罕见融合伙伴是否会影响ALK蛋白的结构?是否同样对ALK-TKI敏感?一直是临床医生关注的焦点。
在此,有幸邀请到江苏省人民医院查王健教授针对“ALK罕见融合诊疗现状及临床实战经验”进行分享。同时也邀请到江苏省人民医院苏梅教授对该病例进行了精彩点评,为我们揭示了罕见融合背后的精准诊疗逻辑。
江苏省人民医院
英国国立心肺研究所访问学者
江苏省医师协会呼吸医师分会呼吸放射与病理学组委员
江苏省研究型医院协会光动力治疗专家委员会委员
以第一作者在SCI及中华结核和呼吸杂志发表论文多篇
研究方向为肺部肿瘤多学科综合治疗。擅长气管镜下肿瘤活检、消融、淋巴结穿刺、肺癌化疗/靶向/免疫治疗及耐药后管理
江苏省人民医院呼吸内科
中国医师协会睡眠专业委员会委员
中国睡眠研究会睡眠障碍委员会委员
江苏省医学会呼吸分会睡眠学组委员
江苏省医师协会睡眠专委会委员
ALK融合的“标准模型”:基因重排机制与EML4-ALK图谱
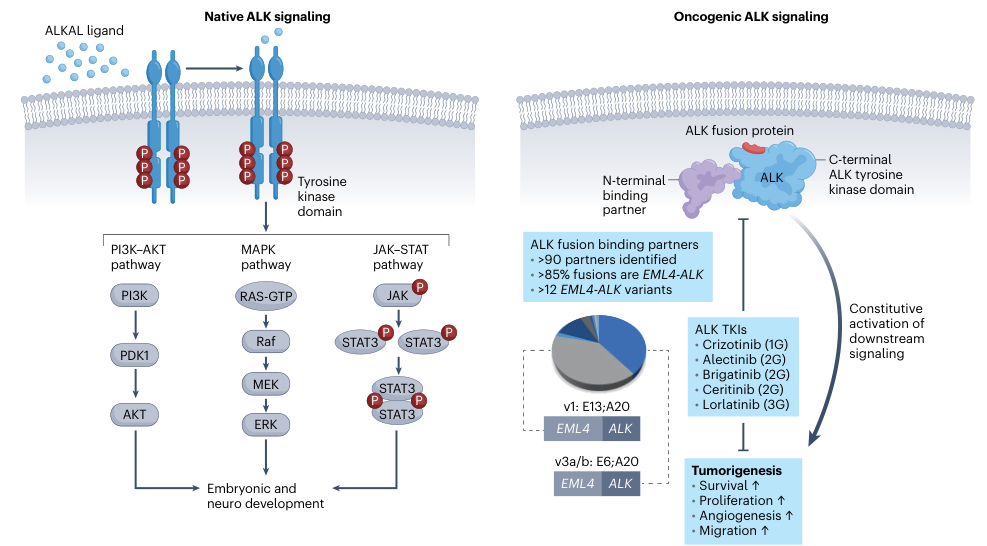
ALK属于胰岛素受体蛋白酪氨酸激酶家族,野生型ALK蛋白对神经系统的发育和功能起到至关重要的作用。ALK基因位于2p23.2-p23.1染色体区域,编码一个由26个外显子和1620个氨基酸残基组成的蛋白质[2]。在癌细胞中,ALK信号主要通过三种机制被激活:基因融合(基因重排导致与其他基因融合)、基因扩增和点突变。2007年,首次在NSCLC患者中发现ALK基因重排,揭示了肺癌中棘皮动物微管相关类蛋白4(EML4)和ALK之间的融合[3]。EML4-ALK融合仍是ALK阳性NSCLC最常见的融合类型,约占85%。其中EML4-ALK变体v1(E13;A20)和变体v3a/b(E6;A20)是最常见的EML4-ALK融合变体。ALK融合在基因表达水平上驱动ALK的活性,并通过ALK激酶域的多聚化,激活下游通路(MAPK 、PI3K/AKT、MEKK2/3、CRKL/C3G、JAK/STAT和MEK5-ERK5等),促进包括细胞分化、增殖和抗凋亡在内的多种生物学功能,最终导致肺癌的发生[4],如图1。
揭开“钻石突变”的另一面:ALK融合的多样性与挑战
作为NSCLC的重要驱动因素,ALK基因融合见于约3%-7%的患者。尽管其总体上被称为“钻石突变”,但这一称呼之下掩盖了极高的分子异质性。从发生机制来看,ALK融合并非千篇一律,它通常源于染色体层面的复杂重排:既包括两条不同染色体之间物质交换的“染色体间易位”(如TFG-ALK、KIF5B-ALK),也包括同一条染色体内部片段倒转的“染色体内倒位”,其中最经典的EML4-ALK即属于此类(2号染色体短臂倒位)。此外,其他染色体内重排还包括缺失和复制,如STRN-ALK和C2orf44-ALK。[1]
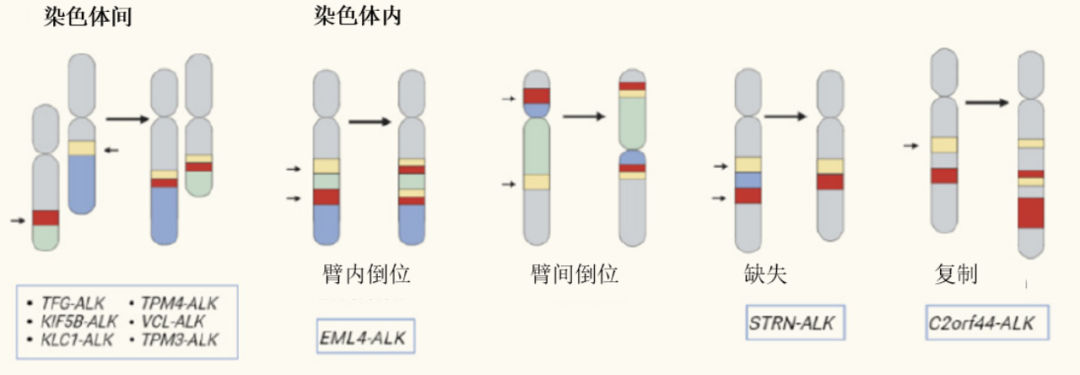
随着高通量测序(NGS)技术的广泛应用,ALK基因的融合图谱被进一步解析。除了EML4这位占据90%以上份额的绝对主角外,目前已报道的ALK融合伴侣已超过90种,包括STRN、KIF5B、HIP1、TPM-3/-4、DCTN1、GCC2、TFG等[1] 。这些融合类型的出现,给临床诊疗带来了双重挑战:一方面是“诊断难”,传统的PCR或FISH检测往往针对已知常见位点设计,极易漏检非经典融合;另一方面是“治疗不确定性”,虽然大多数保留了ALK激酶域的融合理论上对ALK-TKI敏感,但不同的融合伴侣可能改变蛋白的空间构象、稳定性或亚细胞定位,进而导致患者对同一药物的敏感性千差万别。因此,积累罕见融合的临床治疗数据,对于指导后续患者的用药至关重要。
罕见不再“遇冷”:数据显示ALK-TKI对罕见融合疗效与经典EML4-ALK无显著差异
长期以来,临床对于非经典融合是否预示着较差的预后,以及是否能从标准ALK-TKI治疗中获益存在疑虑。然而,结合2025年ASCO大会的最新研究成果、CROWN研究的长期随访数据以及真实的临床病例报告,这一迷雾正逐渐被驱散,证据表明罕见融合患者同样能从ALK-TKI治疗中获得与经典融合无异的生存获益。
2025年ASCO大会上发表的一项多中心回顾性研究(Poster #8625)[5] 为这一观点提供了有力的循证医学支持。该研究分析了来自29个中心的ALK阳性患者数据,发现尽管罕见ALK融合患者在基线特征上与经典型存在显著差异——例如患者发病年龄普遍较大(中位年龄66岁 vs 59岁),且吸烟者比例更高——但这些不利的临床特征并未削弱靶向治疗的获益。生存分析数据显示,在一线接受ALK-TKI治疗后,罕见ALK融合组的中位无进展生存期(mPFS)为23个月,与经典EML4-ALK组的25个月相比,差异无统计学意义(HR 0.9,P=0.7);同样,在中位总生存期(mOS)上,两组分别为40个月和57个月,统计学上亦未见显著差异(HR 0.9,P=0.6)。这一结果有力地打破了“罕见即难治”的刻板印象,证明了只要存在ALK激酶域的激活,ALK-TKI药物就能发挥同等的抗肿瘤效力。这种跨越融合亚型的高效控制力,在以洛拉替尼为代表的第三代ALK-TKI中表现得尤为突出。在具有里程碑意义的CROWN研究[6,7]中,洛拉替尼展现了前所未有的长期疗效,其5年随访结果显示全球人群的5年PFS率高达60%,中位PFS至今未达到。更为瞩目的是,在亚洲亚组及中国人群中,5年PFS率分别高达63%和70%。这种长生存疗效,配合其高血脑屏障透过率,使其能够覆盖包括各类罕见变体在内的广泛靶点,从而在机制上抹平了不同融合伴侣可能带来的预后差距,为罕见融合患者提供了坚实的生存保障。
临床实践中的具体案例也进一步印证了这一结论。Yan等报道了一例携带极罕见FAM179A-ALK (F1, A19) 融合的肺腺癌病例,患者基线即伴有多发脑转移,病情复杂。在使用洛拉替尼进行治疗后,患者获得了PR,不仅头痛等神经系统症状迅速消失,其无进展生存期更是超过了27个月。更具说服力的是,在长达两年多的治疗随访期间,通过液体活检动态监测发现,患者血浆中的ctDNA持续保持清零状态,显示出药物对该罕见融合突变的持续且彻底的抑制[8] 。从大样本的统计学数据到个体的精准治疗案例,证据链条清晰地表明,ALK罕见融合不应被视为预后不良的“孤儿”,在精准检测的指导下,一线应用ALK-TKI完全有能力让这部分患者实现与经典融合患者同等的“钻石级”长生存。
上述大规模研究与回顾性分析为罕见融合的治疗提供了坚实的理论信心,而真实的临床获益则是对这些数据的最佳注脚。为了进一步印证ALK-TKI在“非经典”融合中的治疗潜力,在此分享一例极具代表性的临床实践病例——罕见LINC00707-ALK融合患者的诊疗经过。
病例介绍
基本信息:患者男,46岁。
初诊日期:2024年11月28日。
主诉:发现肺部占位10天。
现病史:2024-11-18外院体检时行胸部增强CT示:两肺纹理增多,左肺下叶软组织密度影,大小约3.7*3.1cm,边缘见少许毛刺影,周围见少许斑片模糊影,左肺见多发结节影,最大径约9mm。左肺下叶占位,考虑肺癌,请结合纤维支气管镜及生化检查。左肺多发结节,肺内转移不排除。
辅助检查:
影像学检查:
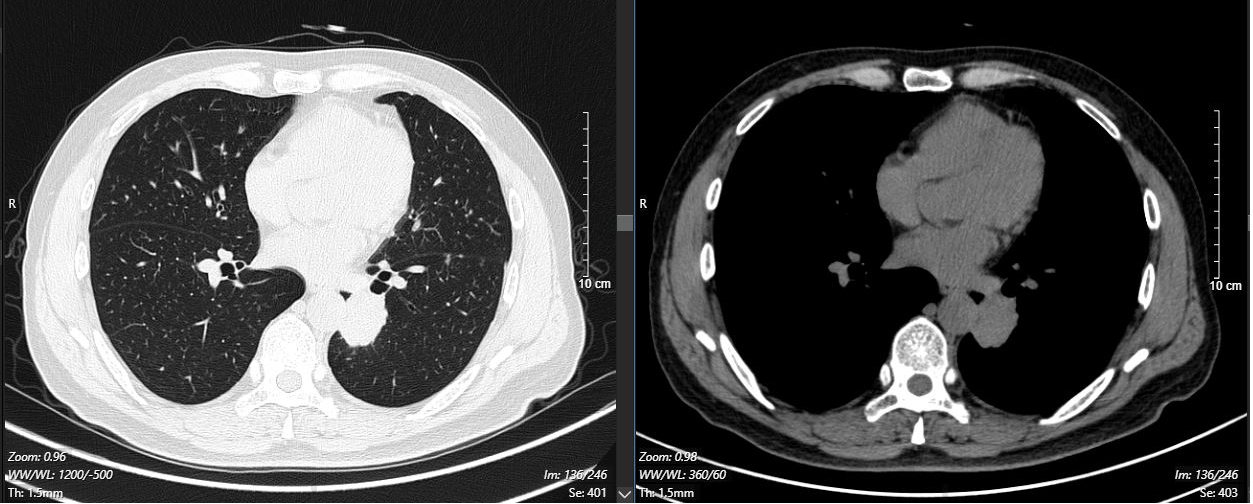
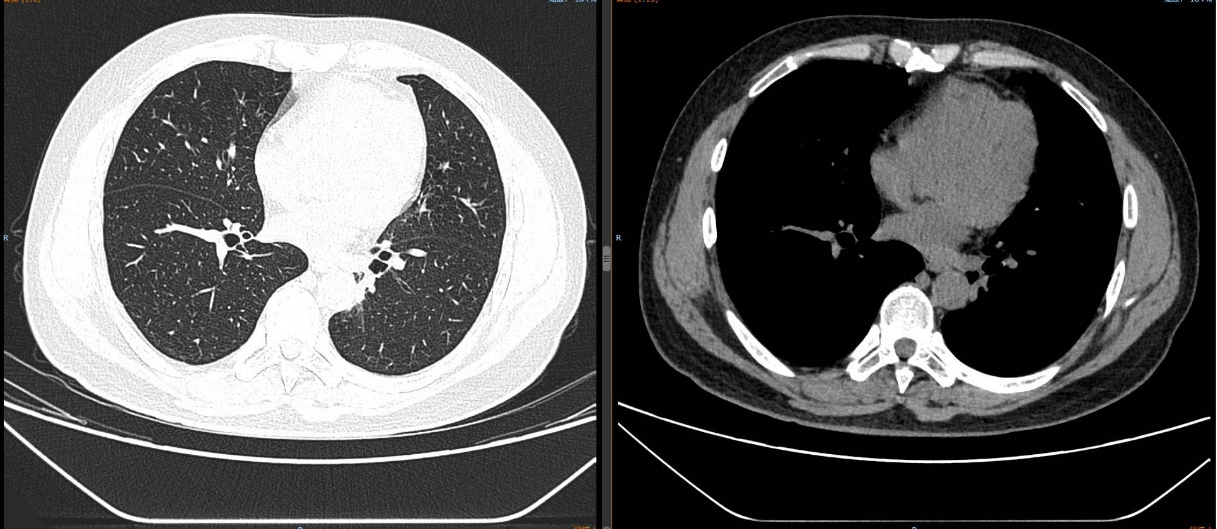
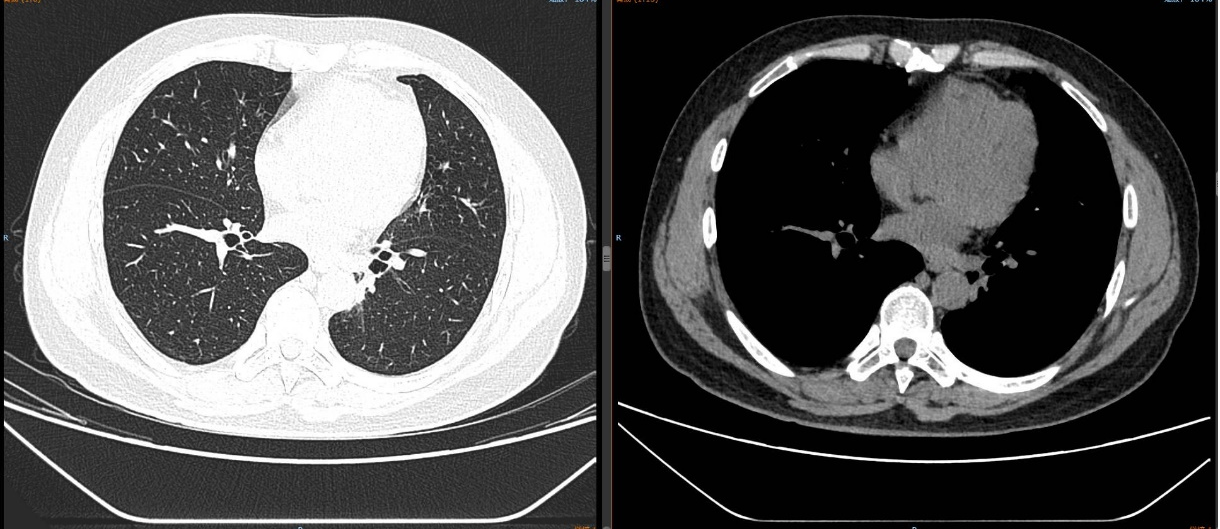
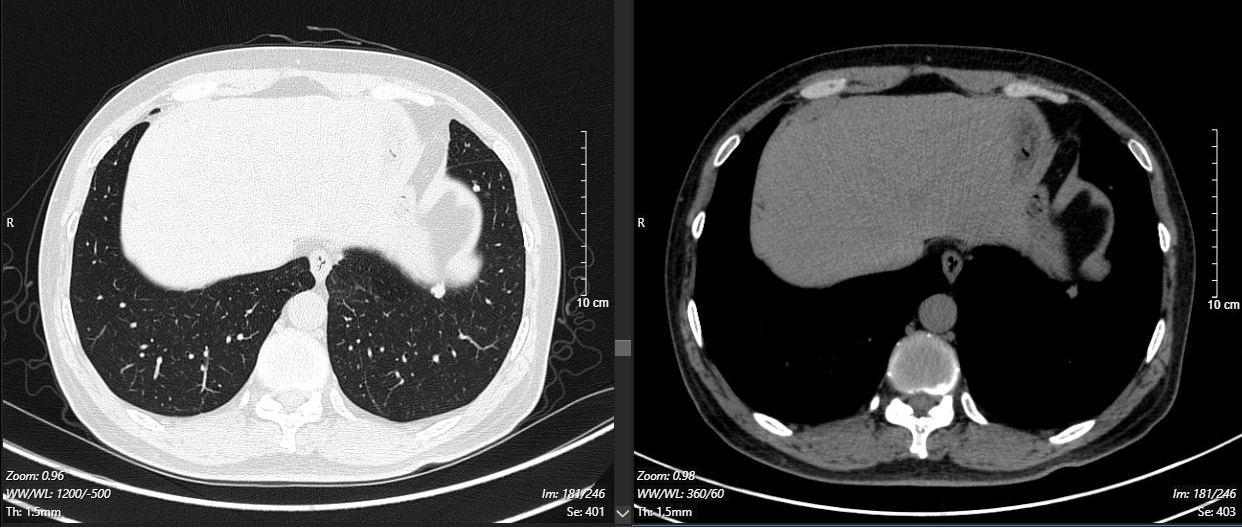
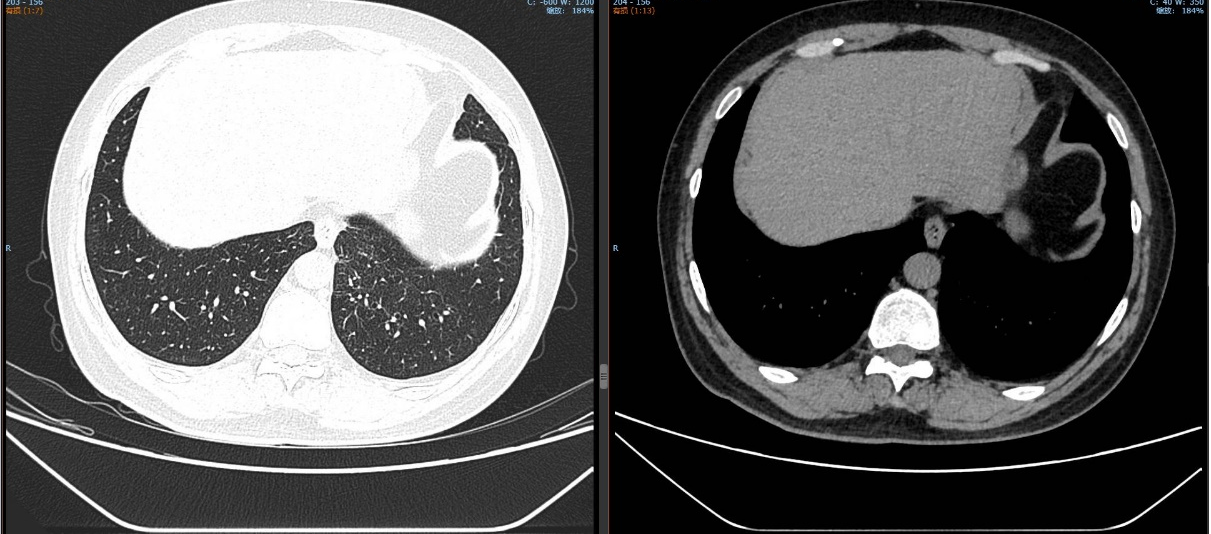
2024-11-26 胸部CT检查示:
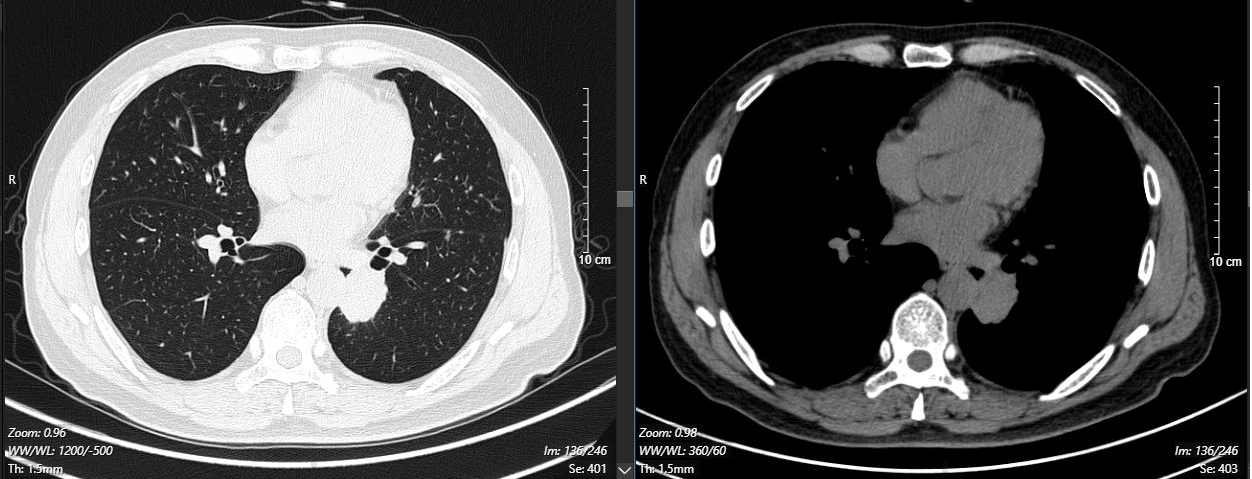
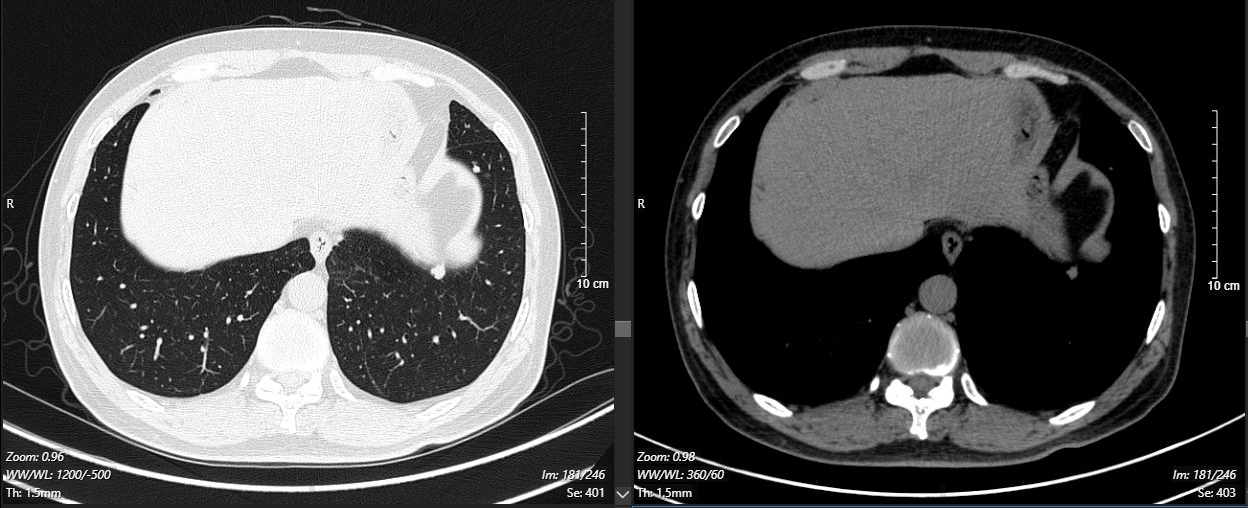
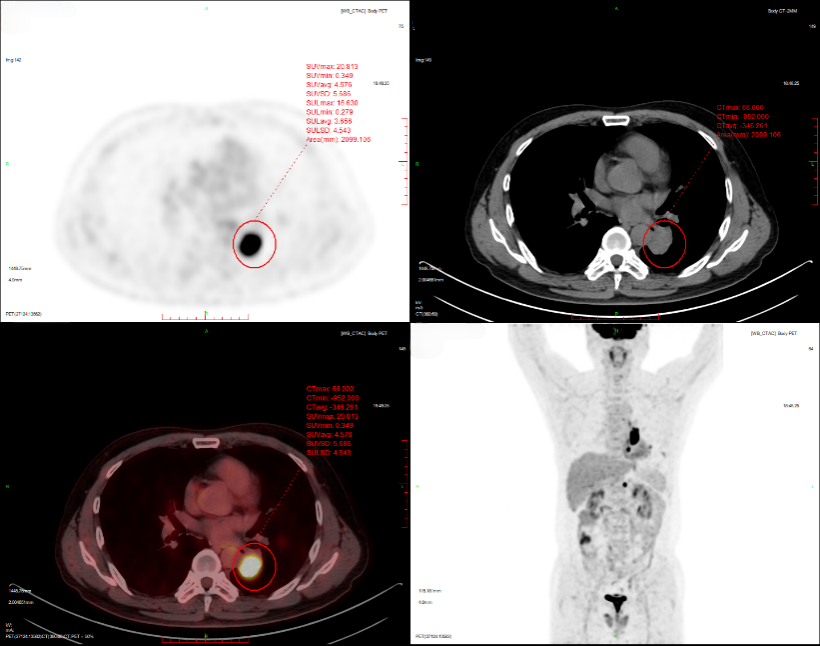
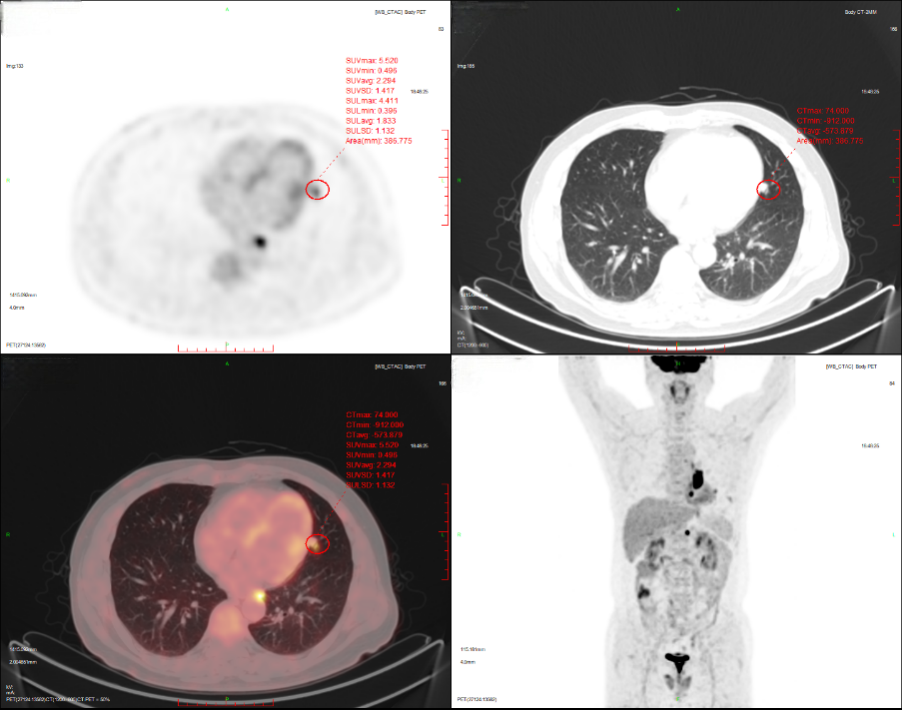
2024-11-26 PET-CT进一步评估:左肺下叶背段近肺门处类圆形分叶状肿块(约32*28mm),FDG代谢异常增高;纵隔内4L组、左下肺门处、左侧膈肌脚内侧见稍大淋巴结FDG代谢增高,左肺内及胸膜下散在多发结节影,FDG代谢不同程度增高,考虑左肺下叶肺癌伴左肺及胸膜多发转移、多发淋巴结转移。
病理与分子诊断:
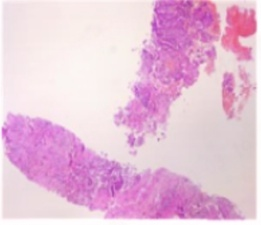
2024-11-29行肺穿刺活检。
病理诊断:(肺组织)穿刺组织镜下示:浸润性癌,待免疫组化检查进一步明确。本院病理B2462910免疫组化结果:(肺组织)肿瘤细胞:CK-L(+),CK7(+),CK20(-),NapsinA(+),TTF-1(+),CDX-2(-),CK5/6(灶散+),P63(散+),P40(-),Syn(-),CgA(-),BRG1(+),INI-1(+),Ki67(热点区约20%+):结合HE切片,本例符合:腺癌,肺来源免疫表型改变,少量肿瘤细胞伴鳞状上皮标记表达。
基因检测:检出I类变异LINC00707(Intergenic)-ALK(Exon20-29)。

最终诊断:
左肺恶性肿瘤(左肺腺癌IVA期,cT2aN2M1a,胸膜),LINC00707-ALK融合,TPS 0%,PS评分1分。
治疗经过:
2024年12月11日,予洛拉替尼100mg QD治疗。
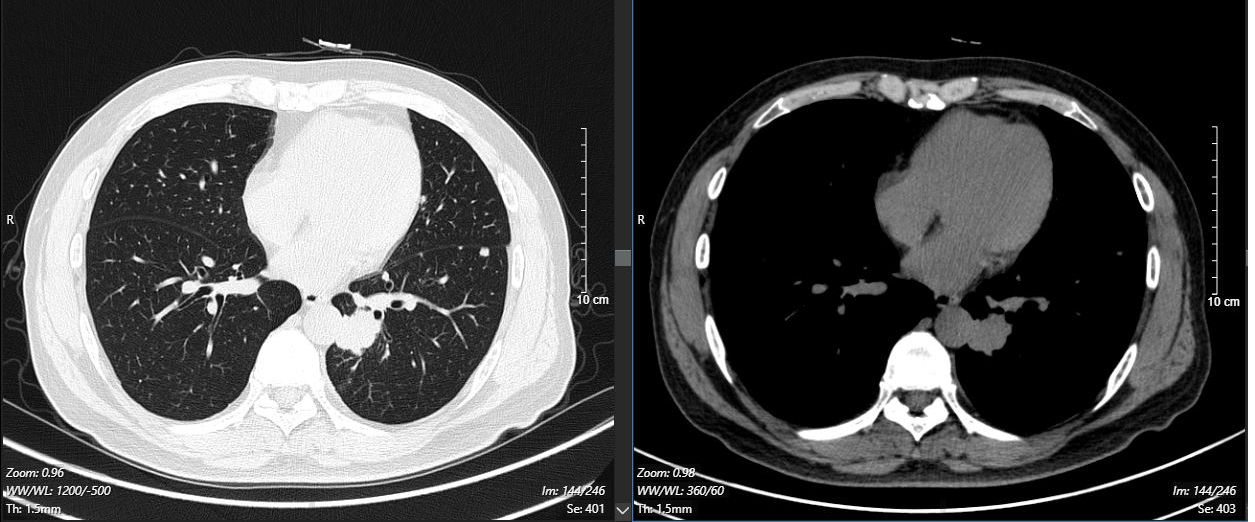
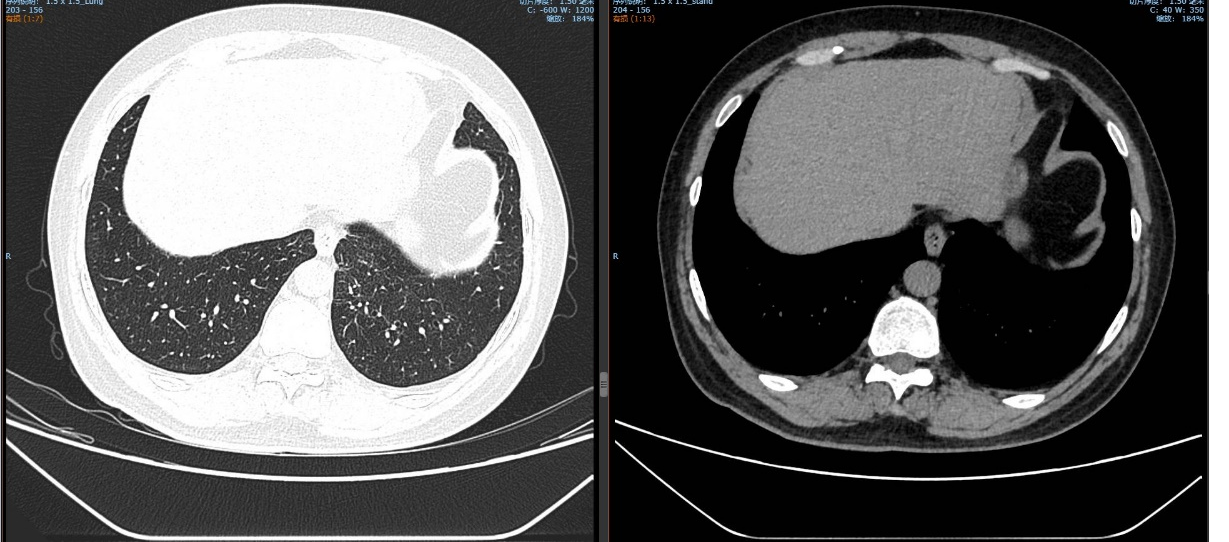
治疗5个月后(2025-05-07):复查CT显示左肺病灶显著缩小,达到PR,肺内结节明显吸收。
治疗过程中患者耐受性总体尚可,主要出现的不良反应轻度可控。
截至目前,PFS已超过10个月,病情持续稳定。
[1] Xiang Y, Zhang S, Fang X, et al. Therapeutic Advances of Rare ALK Fusions in Non-Small Cell Lung Cancer. Curr Oncol. 2022;29(10):7816-7831.
[2] Palmer RH, Vernersson E, Grabbe C, et al. Anaplastic lymphoma kinase: signalling in development and disease. Biochem J. 2009;420 (3):345–361.
[3] Soda M, Choi Y.L, Enomoto M et al. Identification of the Transforming EML4-ALK Fusion Gene in Non-Small-Cell Lung Cancer. Nature 2007, 448, 561–566.
[4] Schneider JL, Lin JJ, Shaw AT. ALK-positive lung cancer: a moving target. Nat Cancer. 2023 Mar;4(3):330-343.
[5] Saalfeld FC, et al. Rare ALK: clinical characteristics and efficacy of targeted therapy in NSCLC with ALK fusions other than EML4::ALK. 2025 ASCO Annual Meeting, Poster #8625.
[6] Solomon BJ, et al. Lorlatinib Versus Crizotinib in Patients With Advanced ALK-Positive Non-Small Cell Lung Cancer: 5-Year Outcomes From the Phase III CROWN Study. J Clin Oncol. 2024;42(29):3400-3409.
[7]周清, 等. 洛拉替尼对比克唑替尼一线治疗亚洲ALK阳性晚期非小细胞肺癌(NSCLC): 来自CROWN研究5年随访结果. 2025 CSCO.
[8]Yan J, Zhou X, Pan D. A case of one lung adenocarcinoma patient harboring a novel FAM179A-ALK (F1, A19) rearrangement responding to lorlatinib treatment. Lung Cancer. 2020;147:26-29.
排版编辑:肿瘤资讯-IR











 苏公网安备32059002004080号
苏公网安备32059002004080号


