在近期召开的2025年圣安东尼奥乳腺癌大会(SABCS)上,一项关于早期三阴性乳腺癌(TNBC)辅助治疗的关键进展引起了广泛关注。由上海交通大学医学院附属瑞金医院沈坤炜教授和陈小松教授团队牵头的RJBC 1501研究(NCT02455141),在大会上进行了口头汇报(Abstract RF2-03),其最终分析结果亦于2025年12月9日同期在线发表于《临床肿瘤学杂志》(JCO)。
作为一项旨在优化早期TNBC治疗策略的多中心、随机、III期临床试验,RJBC 1501研究核心探讨了在标准的蒽环类联合环磷酰胺序贯紫杉类(EC-T)化疗基础上联合卡铂是否能改善患者预后。结果显示,对于接受根治性手术的早期TNBC患者,辅助卡铂治疗在无病生存期(DFS)、无远处转移生存期(DDFS)及总生存期(OS)方面均展现出显著获益。这一研究成果不仅验证了含铂方案的有效性,也为重新定义早期TNBC的标准辅助治疗方案提供了强有力的数据支持。【肿瘤资讯】整理如下,以飨读者。

上海交通大学医学院附属瑞金医院乳腺疾病诊治中心主任、 乳腺外科主任
上海交通大学医学院乳腺疾病诊治中心主任
兼任上海市医学会普外专委会乳腺学组组长、上海市住院医师规范化培训外科学专家组成员
曾任《NCCN(中国版)乳腺癌治疗指南》及《中国抗癌协会乳腺癌治疗指南》编委
主要从事乳腺癌的早期诊断、手术治疗和综合治疗
先后主持或参与 10 余项国家及省部级重点科研项目,发表乳腺疾病相关学术论文 300 篇以上。主编乳腺疾病专著 2 部, 参与编写专著 10 部以上。
上海交通大学附属瑞金医院乳腺疾病诊治中心 副主任
外科学博士,副主任医师,副研究员
美国斯坦福大学访问学者(2013-2014)
负责及参与国自然、市科委自然基金等 20 项课题
发表 SCI 论文 60 余篇,其中以第一/通讯作者发表 SCI 论 文 24 篇,论文在欧洲 EBCC、ESMO 等国际大会进行多次 口头发言交流
作为主编或编者参与 8 本论著编写
研究背景与科学依据
三阴性乳腺癌约占所有乳腺癌病例的15%-20%,以其侵袭性的生物学行为、较高的组织学分级、高增殖指数(Ki67表达升高)以及高远处转移率而著称。在免疫检查点抑制剂(ICI)问世之前,化疗是该类患者主要的系统治疗手段。尽管蒽环类和紫杉类药物的辅助化疗已显著改善了早期TNBC的预后,但患者仍面临较高的复发风险,临床亟需探索更有效的辅助治疗方案。
临床前研究表明,由于BRCA相关DNA修复机制的缺陷,TNBC可能对DNA损伤药物更为敏感 。既往包括CALGB 40603和GeparSixto在内的多项新辅助治疗试验及荟萃分析已证实,在标准蒽环紫杉方案中加入卡铂可显著提高病理完全缓解(pCR)率 。基于此,卡铂已被考虑用于高危早期TNBC的新辅助治疗。然而,关于卡铂在TNBC辅助治疗(即术后化疗)阶段的疗效,既往证据相对有限且存在争议。鉴于此,RJBC 1501研究应运而生,旨在填补这一领域的循证医学空白,验证在标准EC-T辅助化疗基础上联合卡铂能否转化为生存获益 。
研究设计
RJBC 1501试验是一项在中国19家中心开展的随机、开放标签、多中心III期临床研究。研究纳入了年龄在18至69岁之间、经组织病理学确认的侵袭性TNBC女性患者。入组标准要求患者已接受根治性手术(乳房切除术或保乳术)且适合进行辅助化疗。患者需为病理证实的淋巴结阳性,或肿瘤直径≥10 mm的淋巴结阴性患者。HER2阴性定义为IHC评分0或1,或IHC 2+且FISH检测无扩增;雌激素受体(ER)和孕激素受体(PR)阴性最初定义为<1%,后修订为允许<10%的患者入组。
符合条件的患者按1:1的比例被随机分配至EC-T组(对照组)或EC-TCb组(试验组),并根据病理淋巴结状态(N0 vs N1 vs N2-3)进行分层。对照组接受4个周期的表柔比星(90 mg/m²)联合环磷酰胺(600 mg/m²)治疗(每3周一次),序贯4个周期的紫杉类药物治疗。试验组在接受相同的4个周期EC方案后,序贯紫杉类药物联合卡铂治疗。关于紫杉类药物的选择,研究方案允许使用紫杉醇(Paclitaxel,80 mg/m²,每周一次,共4个周期/12周)或多西他赛(Docetaxel,80-100 mg/m²,每3周一次,共4个周期)。在联合卡铂组中,若使用多西他赛,则卡铂剂量为AUC 5-6(每3周一次);若使用紫杉醇,则卡铂剂量为AUC 2(每周一次)。
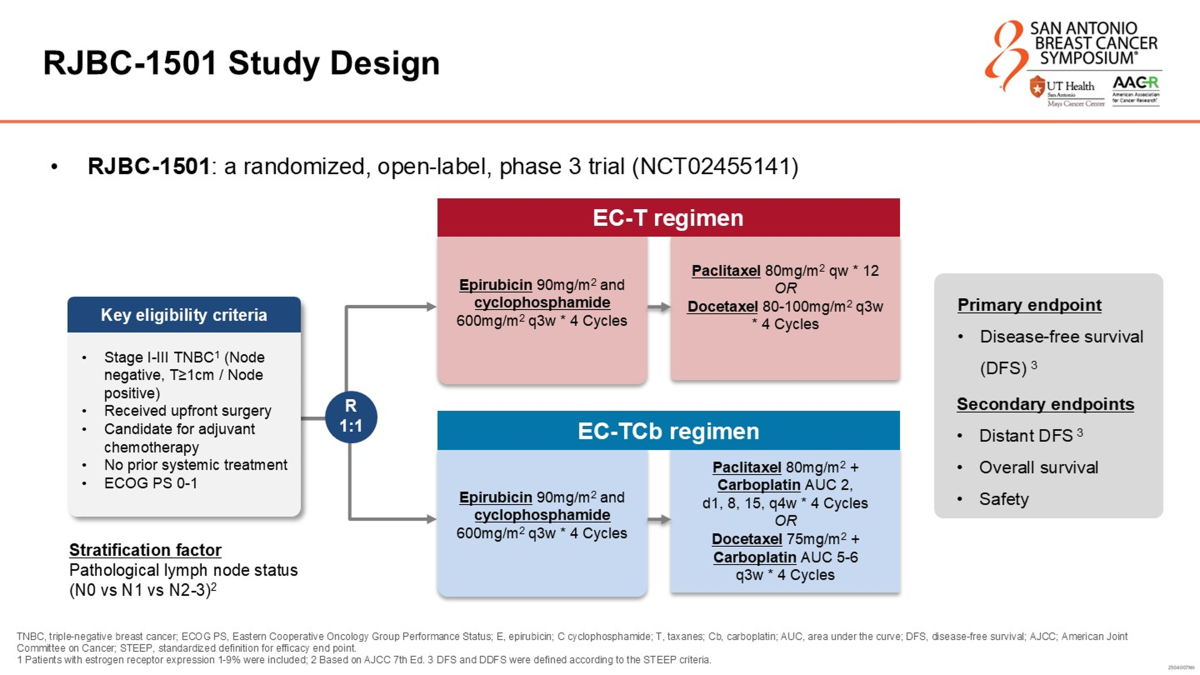
研究的主要终点是无病生存期(DFS),定义为从随机分组到局部或区域复发、远处转移、第二原发恶性肿瘤或全因死亡的时间。次要终点包括无远处转移生存期(DDFS)、总生存期(OS)和安全性。由于入组患者中淋巴结阴性比例较高(约70%),研究者在盲态下重新估算了样本量,最终采用分层对数秩检验(log-rank test)进行统计分析,以确保统计效能。
研究结果:显著的生存获益
自2016年3月至2023年3月,共有786例患者被随机分配至EC-T组(n=391)或EC-TCb组(n=395)。两组患者的基线特征均衡,约一半患者年龄小于50岁,主要为T1期(约46%)和淋巴结阴性(约72%)。绝大多数患者(约75%)接受了多西他赛作为紫杉类治疗药物。

截至2025年3月1日的数据截止日期,中位随访时间为4.52年(IQR, 2.83-6.06)。意向治疗(ITT)人群的分析显示,EC-T组发生了62例DFS事件,而EC-TCb组仅发生41例 25。卡铂的加入显著改善了DFS,风险比(HR)为0.66(95% CI, 0.44-0.97;P=0.034),意味着疾病复发或死亡风险降低了34%。3年DFS率在EC-T组和EC-TCb组分别为89.8%和93.1%;5年DFS率分别为82.6%和89.5%,曲线在随访期间持续分离。

在次要终点方面,联合卡铂同样展现出显著优势。DDFS的HR为0.61(95% CI, 0.38-0.98;P=0.040),表明远处转移风险显著降低。更为重要的是,总生存期(OS)也观察到了显著改善,HR低至0.39(95% CI, 0.16-0.94;P=0.029),这在辅助治疗试验中尤为难得。首次DFS事件的具体分析显示,EC-T组有30例(7.7%)发生远处转移,而EC-TCb组仅有13例(3.3%),进一步证实了卡铂对全身微转移灶的控制能力。

亚组分析:年龄与HER2状态的启示
探索性亚组分析揭示了疗效在不同人群中的潜在差异。虽然大多数亚组均倾向于从卡铂治疗中获益,但在年龄和HER2状态上观察到了显著的交互作用。具体而言,年龄>50岁的患者从卡铂联合治疗中获益更为显著(HR 0.27; 95% CI, 0.13-0.54),而≤50岁的年轻患者获益不明显(HR 1.22; 95% CI, 0.72-2.06;交互作用P=0.001)。在>50岁人群中,两组的3年DFS率差异巨大(87.1% vs 95.7%)。这一发现与GeparSixto研究的二次分析结果相呼应,可能与老年TNBC患者中gBRCA野生型比例较高有关,或者涉及年轻患者中免疫调节亚型较多及雌激素非基因组通路信号的潜在抵抗机制。
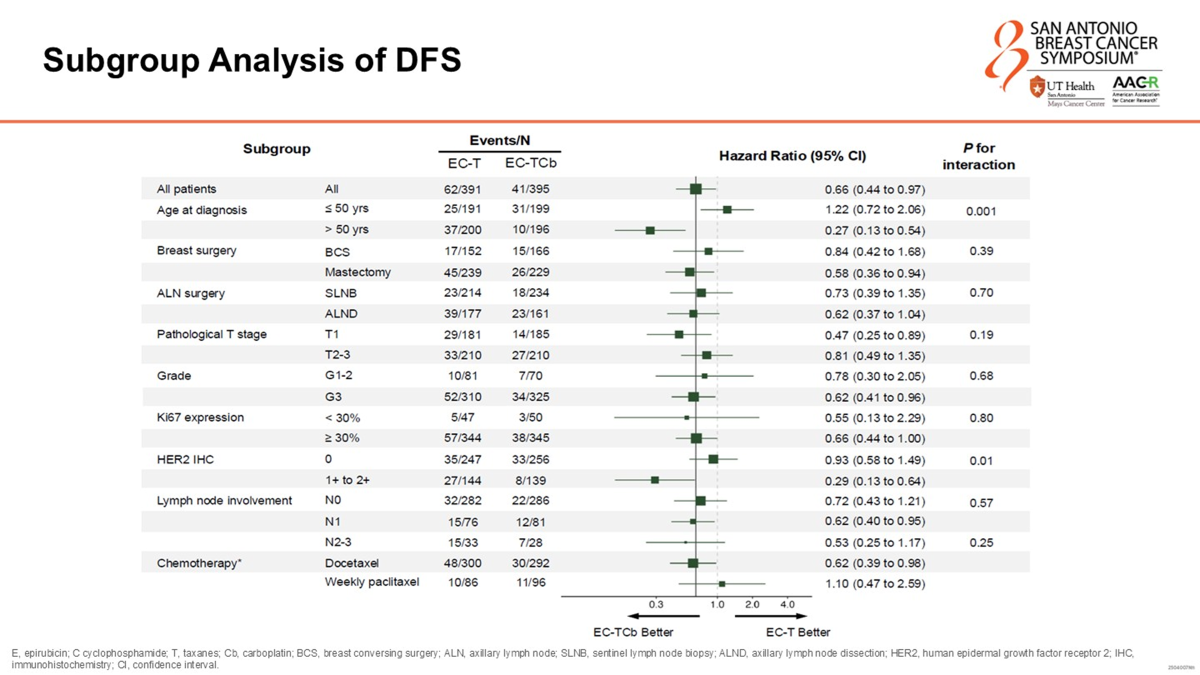
此外,HER2低表达(HER2-low,即IHC 1+或2+)的TNBC患者似乎比HER2-0的患者获益更多(HR 0.29 vs 0.93;交互作用P=0.01)。HER2低表达患者中,EC-T组与EC-TCb组的3年DFS率分别为88.7%和95.5%。既往研究提示HER2低表达肿瘤可能具有更活跃的代谢通路或更高频率的BRCA2突变,从而导致氧化应激增加和DNA损伤加剧,进而对铂类药物更敏感。尽管本研究中仅有部分患者进行了HRR基因检测,但这为未来的精准治疗分层提供了重要线索。
安全性分析
安全性分析集包括774例接受了至少一次紫杉类药物治疗的患者。总体而言,两种方案的耐受性均良好,未发生治疗相关的死亡事件。EC-TCb组的3-4级不良事件(AE)发生率高于EC-T组(49.9% vs 38.7%)。这种差异主要由血液学毒性驱动:联合卡铂组的3-4级中性粒细胞减少症发生率为47.0%(对照组37.8%),血小板减少症为4.5%(对照组0%)。尽管如此,两组的发热性中性粒细胞减少症发生率相似(约2.6%-2.8%)。在非血液学毒性方面,联合组的脱发、疲劳、恶心和呕吐发生率较高,但多为1-2级,3-4级非血液学毒性并未显著增加。因不良事件导致治疗中断的比例在联合组中仅为2.3%,显示出方案的可行性。

总结与展望
RJBC 1501研究作为一项主要基于中国人群的高质量III期临床试验,明确证实了在早期TNBC患者的标准蒽环紫杉辅助化疗中加入卡铂,可以显著降低疾病复发和死亡风险,且毒性可控。尽管近年来新辅助免疫治疗(如KEYNOTE-522模式)已改变了高危TNBC的治疗格局,但临床上仍有大量低危或未接受新辅助治疗直接手术的患者(例如cT1N0),这部分人群存在未被满足的治疗需求。由于辅助免疫治疗尚未显示出生存获益(参考IMpassion030等研究),优化辅助化疗方案显得尤为重要。
该研究不仅填补了卡铂辅助治疗的证据缺口,还通过亚组分析提出了年龄和HER2状态作为潜在疗效预测因子的可能性,为个体化精准治疗指明了方向。当然,研究也存在一定局限性,如开放标签设计可能引入偏倚,且仅有少数患者进行了HRR基因检测,限制了对机制的深入探索。未来仍需开展更多的转化研究(如TILs、基因组图谱等)来筛选最能从含铂方案中获益的优势人群。总体而言,RJBC 1501研究确立了含铂方案在早期TNBC辅助治疗中的重要地位,对于无法获得或不适用新辅助免疫治疗的患者,EC-TCb方案应被视为一种标准且有效的治疗选择。
排版编辑:肿瘤资讯-Kelly
Chen X, et al. Adjuvant Epirubicin Plus Cyclophosphamide Followed by Taxanes With or Without Carboplatin in Early-Stage Triple-Negative Breast Cancer (RJBC 1501): A Randomized Phase III Trial. J Clin Oncol. 2025 Dec.











 苏公网安备32059002004080号
苏公网安备32059002004080号


