2025年圣安东尼奥乳腺癌研讨会(SABCS)正在如火如荼地开展,会上多项前沿研究为乳腺癌治疗领域带来了新的思路与方向。其中,浙江大学医学院附属第一医院傅佩芬教授团队的一项题为“Neoadjuvant pyrotinib, trastuzumab, dalpiciclib, and exemestane in triple-positive breast cancer: a multicenter phase II trial”的研究(Abstract PS3-11-30)[1]入选大会壁报展示。该研究探索了“去化疗”的四药联合方案在三阳性乳腺癌(TPBC)新辅助治疗中的应用。【肿瘤资讯】在大会现场第一时间采访了傅佩芬教授,深度解读该研究的设计初衷、临床数据与未来探索方向。
浙江大学医学院附属第一医院乳腺外科主任
中国临床肿瘤学会乳腺癌专家委员会常委
中国医药教育协会乳腺疾病专业委员会常委
中国医疗保健国际交流促进会乳腺疾病分会常委
中华医学会外科学分会乳腺外科学组委员
中国抗癌协会乳腺癌专业委员会委员
中国医师协会乳腺外科医师委员会委员
浙江省抗癌协会乳腺癌专业委员会副主任委员兼青委主任委员
浙江省数理医学学会乳腺癌临床试验委员会主任委员
浙江省中西医学会乳腺病专业委员会副主任委员
浙江省医师协会乳腺肿瘤委员会副主任委员
浙江省肿瘤诊治质控中心乳腺癌专家委员会副主任委员
专家访谈
Q1. 首先,请您为我们概述当前TPBC的系统性治疗策略,以及在这一领域,您认为最值得关注和亟待解决的临床需求是什么?
傅佩芬教授:TPBC具有独特的生物学特征,即雌激素受体(ER)/孕激素受体(PR)与HER2同时阳性。这意味着在肿瘤发生发展机制上,存在两套驱动基因系统,且ER信号通路与HER2信号通路之间存在复杂的“串扰”(Cross-talk),这使其有别于单纯的HER2阳性乳腺癌。目前,针对HER2阳性乳腺癌(包括三阳性)的标准新辅助治疗策略,仍以化疗联合抗HER2靶向治疗为主,例如TCbHP(紫杉类/卡铂/曲妥珠单抗/帕妥珠单抗)方案。然而,这种高强度的治疗方案并不一定适合所有患者。
临床实践中,我们面临着显著的挑战和未被满足的需求。一方面,鉴于TPBC存在双重驱动通路,理论上同时抑制ER和HER2通路可能产生协同效应,这为“去化疗”提供了理论基础。另一方面,部分患者在抗HER2新辅助治疗中会出现耐药,且存在大量具有特殊需求的患者群体,例如年老体弱无法耐受化疗的患者,以及年轻、处于职业上升期且无法长期脱离工作岗位的女性。她们迫切需要一种不良反应更低、甚至可居家管理的治疗方案。基于此,我们团队设计了这项基于“双靶向抗HER2”联合“双内分泌(CDK4/6抑制剂+AI)”的四药联合方案,旨在探索在去化疗的前提下,能否为患者带来生存获益与生活质量的双重提升。
Q2. 该研究结果显示,总病理完全缓解(tpCR)率为23.3%,残余肿瘤负荷(RCB)0-1级的比例高达76.6%,且客观缓解率(ORR)达到100%,您认为这些数据反映了该方案在哪些方面的潜在优势,您如何解读?
傅佩芬教授:我们这项研究采用了“抗HER2双靶+内分泌治疗+CDK4/6抑制剂”的四药联合去化疗方案,具体为吡咯替尼联合曲妥珠单抗(抗HER2双靶),协同达尔西利(CDK4/6抑制剂)与依西美坦(芳香化酶抑制剂)。
关于疗效数据的解读,我们可以参考国际上的NA-PHER2研究,该研究同样探索了四药联合(曲妥珠单抗+帕妥珠单抗+氟维司群+哌柏西利)去化疗模式,其报告的pCR率为27%[2]。我们的研究结果显示tpCR率为23.3%,两者数据较为接近,验证了此类“靶向+内分泌”联合策略在三阳性群体中的有效性。值得一提的是,我们在设计中引入了国产小分子TKI吡咯替尼替代帕妥珠单抗,这是基于既往研究显示小分子TKI在HR阳性亚群中似乎展现出更快的缩瘤趋势,从而促成了这种“大小分子联合”的策略。
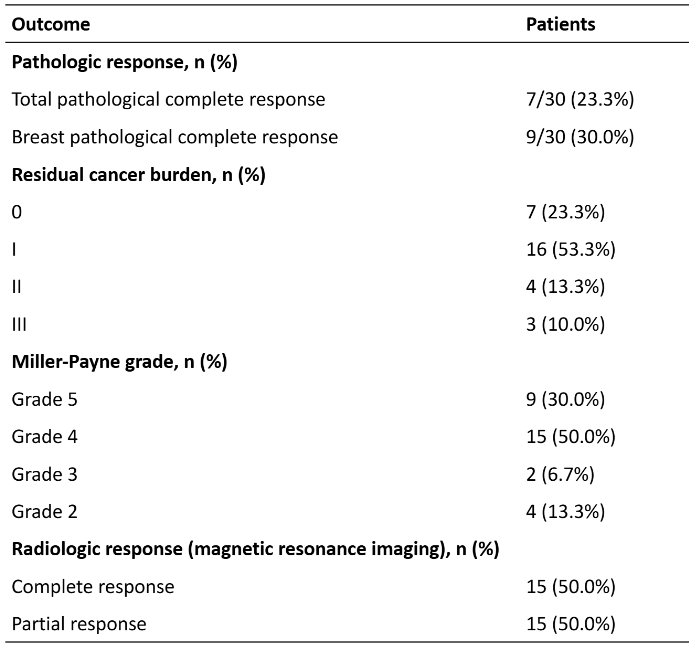
与传统含化疗抗HER2新辅助方案相比,24%的tpCR率虽未呈现突破性提升,但结合研究中其他关键疗效指标,可清晰看到该方案的独特优势。其一,客观缓解率(ORR)达到100%,这意味着所有可评估患者均实现了肿瘤客观缩小,体现了方案强大的肿瘤控制广度,说明该方案对TPBC患者具有广泛的疗效覆盖性。其二,残余肿瘤负荷(RCB)0-1级比例高达76.6%,RCB 0-1级代表肿瘤退缩充分、残余病灶极少,而RCB状态是TPBC患者长期预后的重要预测指标,这一数据提示该方案能实现深度肿瘤退缩,为患者带来潜在的长期生存获益。其三,从动态疗效监测来看,我们对患者进行了循环肿瘤DNA(ctDNA)动态监测,结果显示基线ctDNA阳性的患者在治疗中期全部转为阴性,这表明方案起效迅速,能快速清除肿瘤细胞,为后续手术及长期管理奠定良好基础。
表1 疗效结果
值得注意的是,该方案的优势不仅体现在疗效上,还体现了一定的社会学获益。研究中70%以上的入组患者为绝经前女性,其中近50%的患者在治疗期间仍能坚持全职工作且保持高出勤率,未出现≥4级不良反应,主要3级不良反应为腹泻(30.3%)和中性粒细胞减少(22.6%),且多集中在治疗前两周期,后续毒性反应可控。这种“高效+低毒”的特点,正是该去化疗方案相较于传统含化疗方案的核心竞争力所在,也为职场女性提供了一种无需脱离社会生活的治疗新选择,极大增强了患者的治疗信心。
Q3. 我们关注到您团队在生物标志物方面也进行了深入探索。能否分享一下目前的初步发现?基于研究的安全性和疗效数据,您认为这种“去化疗”方案未来理想的获益人群是哪些?
傅佩芬教授:由于本研究为小样本(N=33)探索性Ⅱ期试验,生物标志物的分析尚处于初步阶段,但我们已经观察到了一些有价值的信号。在分子机制层面,我们通过MRD动态监测和通路分析发现,PIK3CA及WNT通路的突变状态与治疗疗效存在一定关联。此外,团队正在利用治疗前后的组织样本进行空间组学蛋白分析,以期从微环境和蛋白表达层面揭示更深层次的响应机制。
关于该方案未来的适用人群,结合疗效与安全性数据,我认为主要定位于两类有“降阶梯”治疗需求的群体。一类是高龄或体能状态较差的患者,这类人群往往无法耐受标准含化疗方案的毒性,以口服为主的去化疗方案提供了安全有效的替代选择;另一类是有强烈社会功能保留需求的职场女性,对于不愿因化疗脱发、疲乏而中断工作的年轻患者,该方案在保证高肿瘤缓解率的同时,最大程度地保护了患者的生活质量和社会功能。未来,我们期待通过更大样本量的研究及深入的转化医学分析,进一步精准筛选获益人群,优化TPBC的去化疗治疗策略。
研究介绍
背景
TPBC定义为雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)同时表达,约占所有乳腺癌的10%-15%。在该亚型中,结合曲妥珠单抗基础的HER2靶向治疗与化疗的标准新辅助方案疗效有限。耐药机制归因于HER受体的异二聚化、HER2与ER信号通路的cross-talk以及PI3K/AKT/mTOR通路的激活。将HER2靶向治疗与内分泌治疗及CDK4/6抑制剂联合使用,可能有助于克服这种耐药性。NA-PHER2研究证实了去化疗方案(曲妥珠单抗、帕妥珠单抗、哌柏西利和氟维司群)在TPBC中的潜在获益。吡咯替尼是一种不可逆的泛HER酪氨酸激酶抑制剂,在临床前模型中显示出与CDK4/6阻断剂的协同活性。在II期MUKDEN 01试验中,吡咯替尼联合达尔西利和来曲唑在TPBC中显示出应用前景,但疗效仍未达临床预期。基于此理论基础,我们在II-III期TPBC患者中评估了一种新型的去化疗新辅助方案:吡咯替尼、曲妥珠单抗、达尔西利和依西美坦。
方法
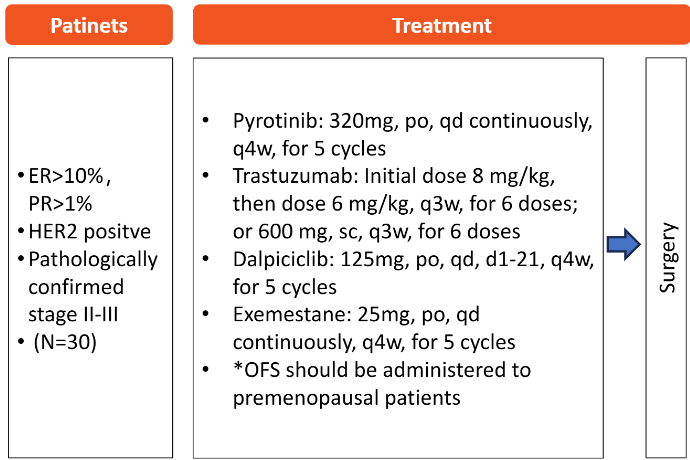
符合入组条件的患者为既往未接受系统治疗的II-III期TPBC,定义为ER >10%,PR >1%,且HER2阳性(免疫组化3+或原位杂交阳性)。患者接受吡咯替尼(320 mg 口服,每日一次,每4周为一个周期,共5个周期)、曲妥珠单抗(静脉给药:负荷剂量8 mg/kg,随后6 mg/kg,每3周一次,共6个周期;或皮下注射:600 mg,每3周一次,共6个周期)、达尔西利(125 mg 口服,每日一次,每4周周期的第1-21天给药,共5个周期)和依西美坦(25 mg 口服,每日一次,每4周为一个周期,共5个周期),随后进行手术。主要终点是总病理完全缓解(tpCR),定义为ypT0/is ypN0。
结果
2022 年 9 月至 2025 年 2 月期间,共纳入 33 例患者。患者中位年龄为 48 岁(范围 29-75 岁)。基线时的疾病分期包括:17 例(51.5%)为 IIA 期、11 例(33.3%)为 IIB 期、4 例(12.1%)为 IIIA 期、1 例(3.0%)为 IIIC 期。25 例患者(75.8%)的基线 Ki-67 表达水平≥30%。
截至 2025 年 6 月 10 日,30 例患者已接受手术。根据可用的病理数据,病理完全缓解(pCR)率为 23.3%(30 例中的 7 例);23 例患者(76.7%)的残留癌负荷为 0-1 级,24 例患者(80.0%)达到 Miller-Payne 分级 4-5 级的疗效。其中 15 例达到完全缓解,15 例达到部分缓解,客观缓解率为 100%。
不良反应在治疗的前两个周期中最常发生,未报告 4 级及以上的不良事件。最常见的 3 级不良事件为腹泻(30.3%)。
结论
这种去化疗的四药联合靶向新辅助方案在早期TPBC中展示了具有前景的抗肿瘤活性和可控的毒性。这些数据支持进一步评估该方案,作为TPBC中标准含化疗新辅助疗法的潜在替代方案。
[1] Peifen Fu, et al. Neoadjuvant pyrotinib, trastuzumab, dalpiciclib, and exemestane in triple-positive breast cancer: a multicenter phase II trial. 2025 SABCS abstract PS3-11-30.
[2] Gianni, Luca et al. Neoadjuvant treatment with trastuzumab and pertuzumab plus palbociclib and fulvestrant in HER2-positive, ER-positive breast cancer (NA-PHER2): an exploratory, open-label, phase 2 study. The Lancet Oncology, Volume 19, Issue 2, 249 - 256
排版编辑:肿瘤资讯-zxy
版权归肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。












 苏公网安备32059002004080号
苏公网安备32059002004080号


