2025 年欧洲肿瘤内科学会亚洲年会(ESMO Asia 2025)于 12 月 5 日至 7 日在新加坡召开。作为亚太地区肿瘤学领域的年度学术盛会,本次会议汇聚全球顶尖专家,聚焦前沿科研成果分享与临床实践经验交流。为第一时间传递领域核心进展,【肿瘤资讯】特对乳腺癌领域的 6 项中国学者口头摘要汇报进行整理汇总,供广大读者参考借鉴。
中文标题:对接受瑞波西利 (RIB) + 非甾体类芳香化酶抑制剂 (NSAI) 治疗的 HR+/HER2−早期乳腺癌 (EBC) 亚洲患者的分析:NATALEE 研究的 5 年结局
英文标题:LBA1 - Analysis of Asian patients (pts) with HR+/HER2- early breast cancer (EBC) treated with ribociclib (RIB) + nonsteroidal aromatase inhibitor (NSAI): 5-year outcomes from NATALEE
讲者:卢彦伸教授 中国台北
研究背景
NATALEE研究显示,在HR+/HER2-早期乳腺癌患者(包括亚洲患者)中,瑞波西利联合非甾体芳香化酶抑制剂相较于单用非甾体芳香化酶抑制剂具有显著的无浸润性疾病生存获益。我们报告NATALEE研究中亚洲和非亚洲患者接受瑞波西利联合非甾体芳香化酶抑制剂治疗的5年里程碑疗效、生活质量和安全性的更新分析(数据截止日期:2025年5月28日)。
研究方法
NATALEE研究纳入II/III期患者(AJCC第8版),其中IIA期N0 G2疾病患者需具备额外高危标准。患者按1:1随机分配至瑞波西利(400 mg/天;36个月)联合非甾体芳香化酶抑制剂组或单用非甾体芳香化酶抑制剂组。无论地理位置如何,均按亚洲/非亚洲人种进行分析。
研究结果
尽管两组中大多数基线特征在治疗组间总体平衡,但亚洲患者(n = 675)和非亚洲患者(n = 4161)在年龄(中位数,48.0岁 vs 53.0岁)、绝经前状态(60.9% vs 41.1%)、N2/3期疾病(31.0% vs 17.0%)以及既往化疗史(96.1% vs 86.3%)方面存在差异。
在亚洲和非亚洲患者中,均观察到瑞波西利联合非甾体芳香化酶抑制剂相较于单用非甾体芳香化酶抑制剂在无浸润性疾病生存、无远处转移生存、无复发生存和无远处复发生存方面一致的获益(见表)。
在两组中,瑞波西利联合非甾体芳香化酶抑制剂组与单用非甾体芳香化酶抑制剂组在EORTC QLQ-C30躯体功能(亚洲:HR,1.03;非亚洲:HR,0.98)和总体健康状况(亚洲:HR,1.04;非亚洲:HR,1.05)的至恶化中位时间相似。亚洲患者的安全性结果与意向治疗人群一致。与非亚洲患者相比,接受瑞波西利联合非甾体芳香化酶抑制剂治疗的亚洲患者因不良事件导致的剂量中断率(84.4% vs 64.4%)和剂量降低率(34.1% vs 21.4%)更高,但因不良事件导致的瑞波西利停药率较低(14.7% vs 22.5%)。
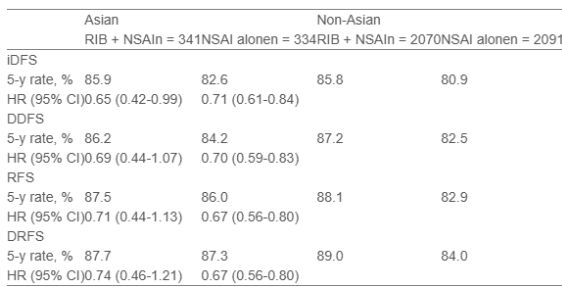
HR,风险比;DDFS,无远处转移生存;DRFS,无远处复发生存;iDFS,无浸润性疾病生存;RFS,无复发生存。
结论
与先前分析一致,这项NATALEE研究的亚组分析表明,在II/III期HR+/HER2-早期乳腺癌亚洲患者中,在非甾体芳香化酶抑制剂基础上加用瑞波西利具有临床意义的疗效获益,且安全性可控,生活质量得以维持。
中文标题:FDA022-BB05在晚期/转移性HER2低表达乳腺癌中的初步疗效与安全性:一项II期研究结果
英文标题:90MO - Preliminary efficacy and safety of FDA022-BB05 in advanced/metastatic HER2 low breast cancer: Results from a phase II study
讲者:刘晓军教授(中国上海)
研究背景
FDA022-BB05是一种新型HER2抗体药物偶联物(ADC)。临床前研究显示其具有增强的稳定性和强效的旁观者杀伤效应。I/IIb期研究在晚期/转移性HER2阳性乳腺癌中展现出显著临床活性。
研究方法
在这项II期研究中,晚期/转移性HER2低表达乳腺癌患者接受FDA022-BB05 5.4mg/kg静脉给药,每3周一次。关键入组标准包括:既往接受过≥1线转移性疾病的化疗;HR阳性患者必须接受过≥1线内分泌治疗或不适合内分泌治疗。主要终点为基于RECIST v1.1的客观缓解率(ORR)和安全性(NCT06413615)。
研究结果
2024年6月5日至2025年6月12日期间,共入组43例HER2低表达乳腺癌患者。中位年龄55岁(范围41-71)。83.7%(36/43)为HR阳性。55.8%(24/43)存在肝转移,44.2%(19/43)肺转移,37.2%(16/43)骨转移,2.3%(1/43)脑转移。中位全身化疗线数为1.5线(范围:1-5线)。
疗效分析集(EAS,n=39):截至数据截止日(2025年6月12日),经确认的ORR为51.3%(20/39)。1例脑转移患者达到确认的部分缓解(PR)。疾病控制率(DCR)为92.3%(36/39),中位无进展生存期(PFS)尚未达到。
安全性分析集(SS,n=43):治疗相关不良事件(TRAEs)发生率为100%(43/43),≥3级TRAEs发生率为79.1%(34/43)。最常见的≥3级TRAEs(发生率≥10%)包括血小板计数降低(51.2%,22/43)、中性粒细胞计数降低(51.2%,22/43)、白细胞计数降低(25.6%,11/43)、贫血(14.0%,6/43)和淋巴细胞计数降低(11.6%,5/43)。1例患者发生间质性肺病。9.3%(4/43)患者因TRAEs暂停用药,4.7%(2/43)患者永久停药,未报告治疗相关死亡事件。多数≥3级血液学毒性经适当处理后可控,未发生出血或系统性感染。
结论
FDA022-BB05在经多线治疗的HER2低表达乳腺癌患者中表现出显著的抗肿瘤活性和可控的安全性特征,支持在该人群中的进一步临床开发。
中文标题:89MO - SMP-656(一种新型的基于艾立布林的HER2的抗体偶联药物)治疗实体瘤的I/Ib期数据
英文标题:89MO - Phase I/Ib data of SMP-656: A novel eribulin-based HER2 ADC in solid tumor
讲者:刘晓军教授(中国上海)
研究背景
SMP-656是一种新型艾立布林载荷的HER2抗体偶联药物 (ADC) 。本研究报道在经重度预治疗(包括既往HER2抗体药物偶联物治疗失败)人群中开展的I/Ib期临床试验数据(安全性、药代动力学及疗效数据)。
研究方法
入组标准为难治性或不耐受标准治疗的HER2表达或HER2突变的局部晚期或转移性实体瘤患者。SMP-656给药剂量从0.5、1.0、1.5、2.0至2.5 mg/kg,每三周一次。主要终点为安全性、剂量限制性毒性和推荐II期剂量,次要终点为疗效和药代动力学。
研究结果
截至2025年7月23日,共入组30例患者。平均年龄50.9±9.67岁,28例为女性。肿瘤类型包括:乳腺癌(25例)、非小细胞肺癌(2例)、胃癌(1例)、结直肠癌(1例)和子宫内膜癌(1例)。
安全性特征:30例患者中29例(96.7%)发生至少一次治疗期间不良事件(TEAE),7例患者(23.3%)发生3级及以上TEAE。无因不良事件导致治疗中止的情况。未出现间质性肺病。未发现需特别关注的不良事件(包括肝毒性和血液学毒性)。
药代动力学:在0.5至2.5 mg/kg剂量范围内,SMP-656的Cmax呈剂量依赖性增加(9.676至53.826 μg/mL),变异系数(CV)介于15.2%至33.1%之间,表明受试者间药代动力学变异度为低至中度。半衰期从0.5 mg/kg组的49.160小时延长至2.5 mg/kg组的147.013小时,提示高剂量下系统清除率降低。对于载荷艾立布林,Cmax保持较低水平(0.5 mg/kg时0.0008111 μg/mL至2.5 mg/kg时0.0025423 μg/mL),呈剂量依赖性增长。未观察到载荷艾立布林的临床相关蓄积(蓄积指数Rac<1)。连接子稳定性得到确认。
疗效:共28例患者完成评估。在未接受ADC治疗的HER2阳性乳腺癌患者中,客观缓解率(ORR)达100%。在既往接受ADC治疗的患者中:对于曾接受一种TOP1抑制剂载荷ADC治疗的乳腺癌患者,在推荐II期剂量及更高剂量下ORR为100%;对于曾接受多种ADC(包括TOP1抑制剂ADC和微管蛋白抑制剂ADC)治疗的乳腺癌患者,ORR为20%、疾病控制率(DCR)为100%。在经ADC治疗的HER2高表达和低表达乳腺癌患者中均观察到显著疗效。
结论
SMP-656在经ADC治疗的人群中展现出令人鼓舞的抗肿瘤活性。将推进II/III期研究。
中文标题:87MO - 卡匹色替 (C) + 紫杉醇 (P) 作为转移性三阴性乳腺癌的一线治疗:CAPItello-290 III期试验扩展中国队列
英文标题:87MO - Capivasertib (C) + paclitaxel (P) as first-line treatment of metastatic triple-negative breast cancer: The CAPItello-290 phase III trial extended China cohort
讲者:夏雯教授(中国广州)
研究背景
全球性CAPItello-290Ⅲ期试验评估了C + P对比安慰剂(pbo)+ P作为转移性三阴性乳腺癌(mTNBC)一线治疗的疗效和安全性。总生存期(OS)未达到预设的统计学显著性阈值,但在数值上,无进展生存期(PFS)显示C + P优于pbo + P。本文呈现了在中国招募的患者亚组的中期结果,该队列在全球研究结束后仍在继续招募。
研究方法
中国患者入组标准与全球研究一致。患者按1:1比例随机分配至C + P组或pbo + P组。采用燃石医学OncoScreen Plus检测对肿瘤组织进行中心实验室分子检测,分析PIK3CA/AKT1/PTEN基因变异。双重主要终点为总体中国人群的OS及携带PIK3CA/AKT1/PTEN基因变异患者的OS。
研究结果
2021年8月至2023年4月期间,共128例中国患者被随机分组。基线时,64.1%的患者存在内脏转移,62.5%既往接受过(新)辅助紫杉烷类化疗,40.6%的患者携带PIK3CA/AKT1/PTEN肿瘤基因变异。与全球研究结果一致,未观察到具有临床意义的OS获益。中期分析显示,在携带PIK3CA/AKT1/PTEN基因变异肿瘤的患者中,C+ P组的PFS在数值上优于pbo + P组。
C+P治疗组中与PI3K/AKT通路抑制相关的任何级别最常见不良事件(AEs)为腹泻(64.6% vs pbo + P组 11.1%)、高血糖(61.5% vs pbo + P组 20.6%)和皮疹(43.1% vs pbo + P组 12.7%)。因AEs导致C或pbo停药的发生率在C + P组为7.7%,pbo + P组为3.2%。
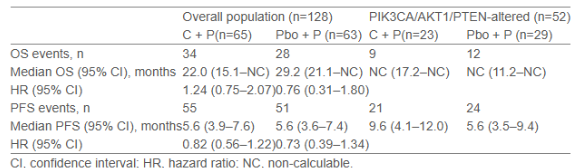
结论
在携带PIK3CA/AKT1/PTEN基因变异肿瘤的患者中,OS和PFS在数值上显示C+P优于pbo+P,但该解读受限于样本量小和置信区间宽。未发现C+P新的安全性问题。
中文标题:65MO - HLX11对比欧盟来源帕妥珠单抗新辅助治疗HER2阳性、HR阴性早期或局部晚期乳腺癌:一项双盲、随机III期等效性研究
英文标题:65MO - Neoadjuvant HLX11 versus European Union (EU)-sourced pertuzumab in human epidermal growth factor receptor 2 (HER2)-positive, hormone receptor (HR)-negative early or locally advanced, breast cancer (BC): A double-blind, randomised phase III equivalence study
讲者:杨雅平教授(中国广州)
研究背景
生物类似药可提高生物制剂疗法的可及性。曲妥珠单抗联合帕妥珠单抗的双重HER2阻断一直是HER2阳性乳腺癌的标准治疗方案。本研究是一项III期等效性试验,在乳腺癌新辅助治疗中比较拟研帕妥珠单抗生物类似药HLX11与欧盟来源帕妥珠单抗的疗效和安全性。
研究方法
合格患者为HER2阳性、HR阴性早期或局部晚期乳腺癌,原发肿瘤直径>2 cm,且无肿瘤治疗史。入组患者按1:1随机分配,接受4个周期静脉注射(IV)HLX11(HLX11组)或参照帕妥珠单抗(EU-帕妥珠单抗组)联合曲妥珠单抗和多西他赛,每3周(Q3W)一次。随后,达到总病理学完全缓解(tpCR)的患者接受4个周期辅助化疗。之后,HLX11组患者继续接受13个周期HLX11联合曲妥珠单抗IV Q3W治疗,而参照组患者按1:1随机分配接受HLX11或帕妥珠单抗联合曲妥珠单抗IV Q3W治疗。
主要终点为经盲态独立中心审查(BICR)评估的tpCR率。次要终点包括其他疗效终点、安全性、药代动力学(PK)和免疫原性。
2022年4月26日至2024年1月30日期间,共908例患者入组(每组各454例)。BICR评估的tpCR率在HLX11组和EU-帕妥珠单抗组分别为46.3%和45.8%。相对风险(RR)为1.01(90%置信区间[CI]:0.90至1.14),风险差(RD)为0.47%(95% CI:-5.99%至6.92%),两者均落在预设等效界值内(RR:0.79至1.26;RD:-13%至13%),因此证明等效性。两组次要终点也表现出相似性。
本研究显示HLX11与EU-帕妥珠单抗的安全性特征相当。从EU-帕妥珠单抗单次转换为HLX11治疗未影响疗效、安全性、免疫原性或PK特征。
结论
HLX11与欧盟来源帕妥珠单抗在疗效、安全性、免疫原性和PK方面均表现出等效性和可比性,支持HLX11作为潜在的帕妥珠单抗生物类似药的选择。
中文标题:3MO - 新辅助治疗后达到腋窝病理完全缓解(ypN0)的乳腺癌患者腋窝管理策略
英文标题:3MO - Axillary management strategies in breast cancer patients with ypN0 after neoadjuvant therapy
讲者:商庆尧教授 (中国北京)
研究背景
对于新辅助治疗(NAT)后达到腋窝病理完全缓解(ypN0)的乳腺癌患者,最佳腋窝管理策略仍存在争议,尤其对于初始临床淋巴结分期为cN2–3的患者。尽管前哨淋巴结活检(SLNB)的应用日益广泛,但在真实世界人群中,与腋窝淋巴结清扫术(ALND)相比,SLNB对生存的影响以及辅助腋窝放疗的必要性仍不明确。
研究方法
利用美国国家癌症数据库(2018–2022年),我们筛选出临床分期为I–III期、初始临床淋巴结分期为cN1–3、接受新辅助治疗(NAT)后达到腋窝病理完全缓解(ypN0)的浸润性乳腺癌女性患者。根据腋窝手术类型(SLNB或ALND)将患者分组,并采用倾向评分加权法调整基线不平衡因素。通过Kaplan-Meier曲线和Cox回归比较总生存期(OS)。根据临床淋巴结分期(cN1–cN3)进行亚组分析,并评估辅助腋窝放疗的影响。
研究结果
在9,652例患者中,66.7%接受SLNB,33.3%接受ALND。在整个队列中,无论是加权前还是加权后,仅接受SLNB的患者总生存期(OS)均优于接受ALND的患者(加权后HR 1.36,95% CI 1.08–1.71,P=0.01)。SLNB的生存优势在cN1患者中最显著(加权后HR 2.05,95% CI 1.62–2.59,P<0.001),而在cN2(加权后HR 1.16,95% CI 0.66–2.06,P=0.61)或cN3(加权后HR 1.03,95% CI 0.63–1.69,P=0.91)患者中,SLNB与ALND的OS无显著差异。腋窝放疗在两个手术组中均未显著影响OS。
结论
尽管SLNB已成为cN1患者新辅助治疗(NAT)后达到腋窝病理完全缓解(ypN0)的标准处理方式,我们的研究进一步表明,即使是初始淋巴结负荷较高(cN2-cN3)但达到腋窝完全缓解的患者,也可安全地避免ALND而选择SLNB。腋窝放疗在此类患者中未显示生存获益,这支持了在适当选择的患者中进一步降阶梯治疗的潜力。
排版编辑:肿瘤资讯-zxy











 苏公网安备32059002004080号
苏公网安备32059002004080号


