神经营养酪氨酸受体激酶(NTRK)基因融合是多种成人和儿童实体瘤的关键致癌驱动因素。作为全球首个专门为TRK融合癌患者设计并获批的靶向药物,高选择性TRK抑制剂拉罗替尼已在泛癌种治疗中显示出快速、高效且持久的缓解。然而,对于那些获得最佳完全缓解(CR)或病理学完全缓解(pCR)的患者,其长期的生存获益、治疗模式及安全性如何,是临床医生极为关注的问题。
在2025年欧洲肿瘤内科学会(ESMO)年会上,一项关于拉罗替尼的更新数据发布,分析了在三项关键性临床试验中达到CR/pCR的TRK融合癌患者的长期疗效和安全性。这项研究不仅证实了深度缓解带来的卓越生存获益,也为探索“等待-观察”等新型治疗策略提供了初步线索。为深度解读该研究的临床意义,【肿瘤资讯】特邀首都医科大学三博脑科医院张俊平教授和中山大学肿瘤防治中心张玉教授进行专业点评。
首都医科大学三博脑科医院副院长
神经肿瘤化疗中心主任
肿瘤学博士
神经肿瘤化疗博士后
哈佛大学Dana-Farber肿瘤中心神经肿瘤化疗访问学者
获2022第八届北京优秀医师奖
北京抗癌协会神经肿瘤专委会青年委员会 主任委员
中国抗癌协会神经肿瘤专业委员会 副主任委员
中国医师协会胶质瘤专业委员会 委员
中山大学肿瘤防治中心病理科 儿童肿瘤病理亚专科负责人
美国南加州大学洛杉矶儿童医院访问学者
广东省抗癌协会肿瘤病理专业青年委员会常务委员
广东省抗癌协会小儿肿瘤专业委员会常务委员
广东省抗癌协会肿瘤病理专业委员会委员
广东省医学会病理学分会青年委员会委员
广东省医师协会甲状腺专业医师分会常务委员
广州市医学会甲状腺疾病委员会委员
研究速递
研究名称
拉罗替尼对获得完全缓解(CR)或病理学完全缓解(pCR)的TRK融合癌患者的疗效和安全性分析。
研究背景
NTRK基因融合在某些罕见癌症(如婴儿纤维肉瘤、分泌性癌)中发生率高达90%,在一些常见肿瘤(如非小细胞肺癌)中发生率较低。拉罗替尼作为同类首创、高选择性、可穿透中枢神经系统的TRK抑制剂,已获批用于治疗NTRK基因融合的实体瘤患者。既往数据显示了其在总体人群中的稳健疗效,但专门针对达到CR/pCR这一“最佳疗效”亚组的长期数据尚待阐明。本分析旨在深入评估这一获益群体的长期结局,并报告其疗效和安全性数据。
研究方法
本研究是一项汇总分析,数据来源于三项拉罗替尼的临床试验:NCT02637687 [SCOUT]、NCT02576431 [NAVIGATE] 和NCT02122913的TRK融合癌症患者。研究纳入了经独立审查委员会根据RECIST v1.1标准评估达到CR或pCR的NTRK基因融合癌患者。成人患者接受每天两次100 mg拉罗替尼治疗,大多数儿童患者则接受每天两次100 mg/m²的剂量。本次分析的数据截止日期为2024年7月20日。
研究结果
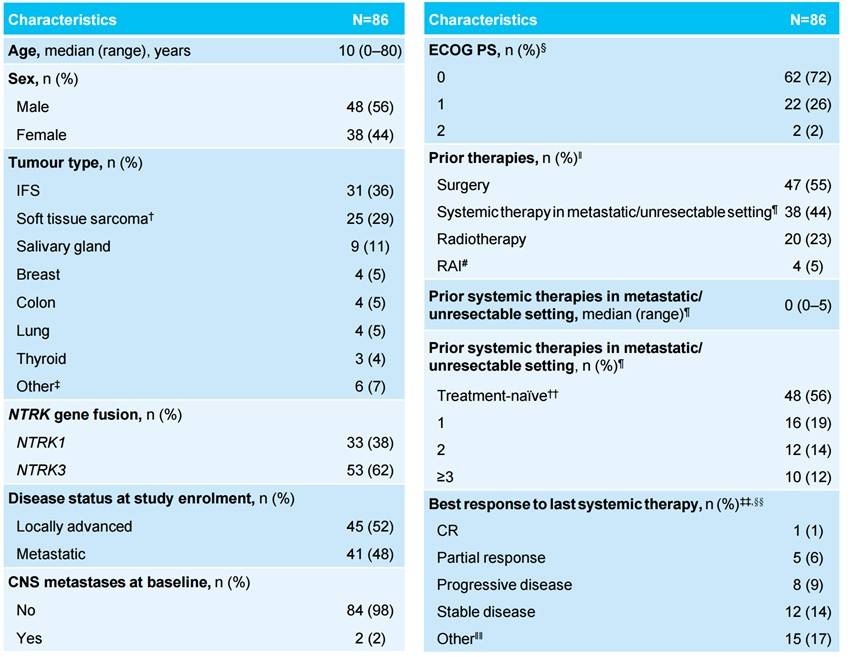
⊙ 患者基线特征
在数据截止时,304名基线时具有可测量疾病的患者中,28%(33名成人和53名儿童患者)对拉罗替尼单独治疗或后续手术获得完全缓解(表 1);其中20名(23%)患者达到pCR。共有13种不同肿瘤类型;最常见的是婴儿纤维肉瘤(n=31 [36%])、其他软组织肉瘤(n=25 [29%])和唾液腺癌(n=9 [11%])。
通过NGS在65(76%)患者中发现了NTRK基因融合,通过FISH在11名(13%)患者中发现了NTRK基因融合,通过PCR在10名(12%)患者中发现了NTRK基因融合。有14种独特的基因融合,其中ETV6::NTRK3是最常见的(n=47 [55%])。
在转移性/不可切除的情况下,48名(56%)患者为初始全身治疗,22名(26%)患者既往接受过≥ 2种治疗。
表1. 患者基线特征
⊙ 疗效数据
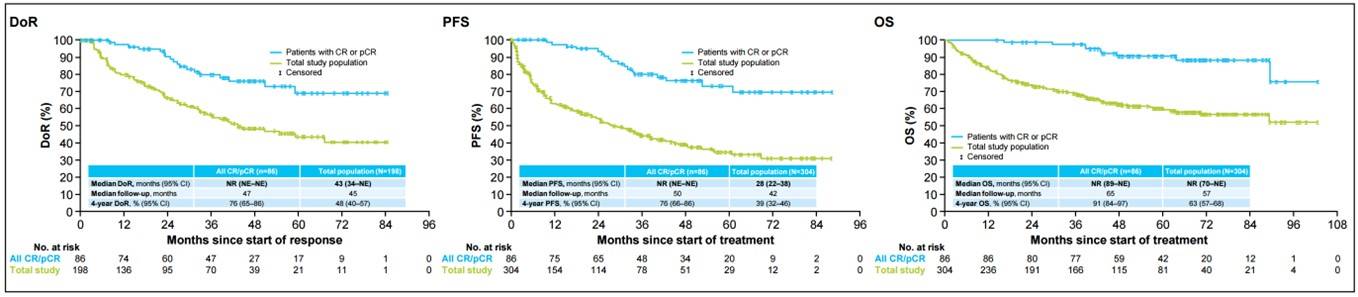
在总人群中,如既往报告,总缓解率(ORR)为 65%。对于获得CR/pCR的患者,拉罗替尼展现了极为出色且持久的疗效。中位缓解持续时间(DoR)未达到,4年DoR率高达76%,显著优于总体研究人群的48%。中位无进展生存期(PFS)未达到,4年PFS率为76%,高于总体人群的39%。中位总生存期(OS)未达到,4年OS率更是达到91%,而总体人群为63%。达到CR/pCR的中位时间仅为1.8个月。在数据截止时,仍有58%的患者在试验中继续接受治疗或处于“等待-观察”状态。
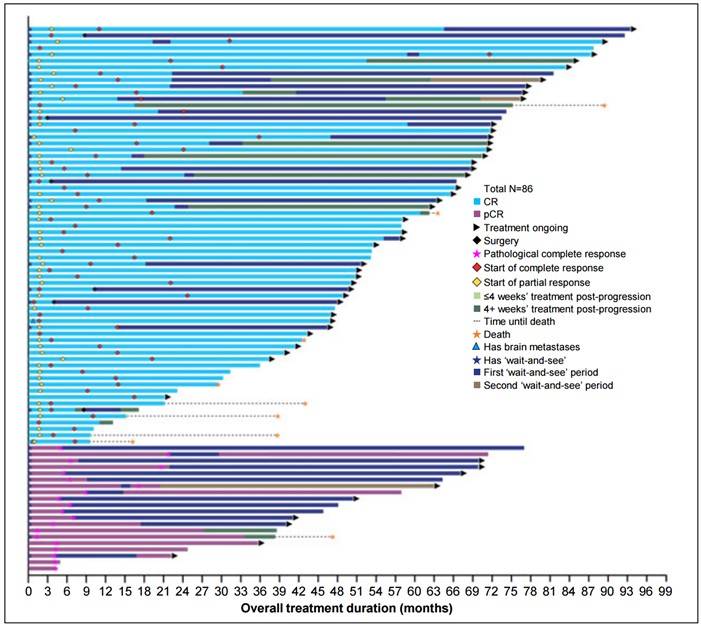
⊙ “等待-观察”分析
在SCOUT研究中,54名达到CR/pCR的患者里,有41名(76%)在无疾病进展的情况下停止使用拉罗替尼,进入“等待-观察”期。截至数据截止时,18名(44%)患者仍在“等待—观察”状态。
第一个“等待-观察”期的中位持续时间长达34个月。在23名退出“等待-观察”期的患者中,14名出现病情进展(9名患者为CR,5名患者为 pCR),恢复拉罗替尼治疗后,研究者评估的缓解包括6例CR、3例部分缓解(PR)、3例疾病稳定(SD)、1例无法评估和1例未定义。另外9名结束“等待—观察”期的患者在试验中病情得到缓解,并且在数据截止时仍然存活。
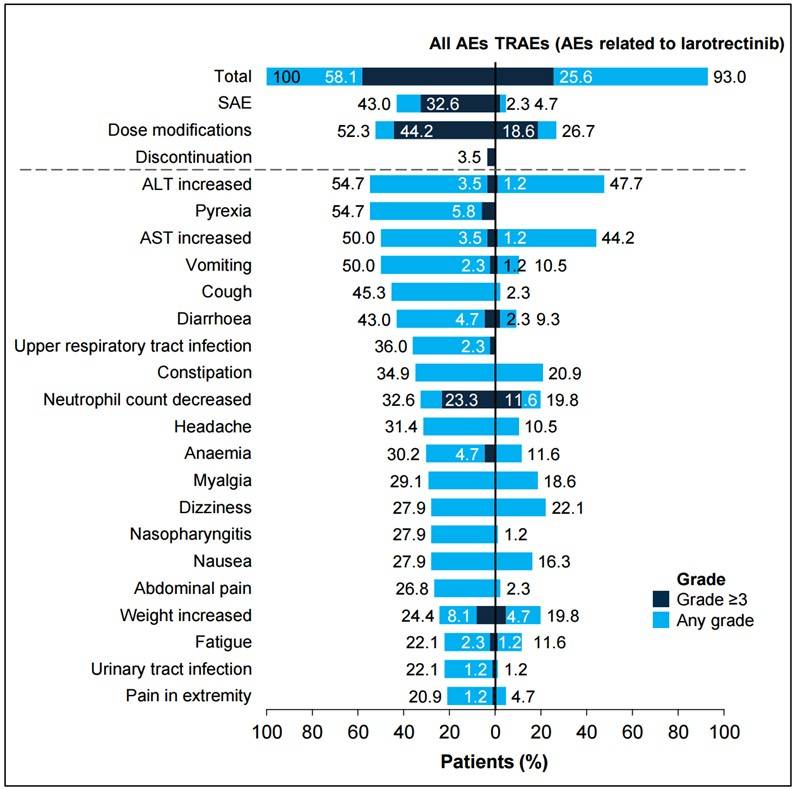
⊙ 安全性数据
在获得CR/pCR的86名患者中,拉罗替尼的安全性特征与总体研究人群一致,且耐受性良好。
治疗相关不良事件(TRAE)主要为1/2级。22名(26%)患者出现了3/4级TRAE,最常见的是中性粒细胞计数减少(10例)和体重增加(4例)。没有患者因TRAE而停止用药或死亡。
研究结论
拉罗替尼在TRK融合癌症患者中继续表现出持久反应、延长生存期和良好的安全性。“等待—观察”结果提示,对于部分儿童患者,停用拉罗替尼可能是可行的。然而,仍需更多有关最佳治疗时长的信息。在这3项研究中,28%的TRK融合癌症患者达到了CR或pCR,凸显了早期分子检测和靶向治疗的重要性。这支持更广泛地采用NGS检测,包括NTRK基因融合来识别可能受益于TRK抑制剂治疗的患者。

专家点评
张俊平教授:这次ESMO公布的数据令人振奋,它将我们的目光从泛癌种的总体缓解率,进一步聚焦到了获得“最佳疗效”的那部分患者身上,为临床实践提供了极为宝贵的参照。对于临床医生而言,我们不仅关心肿瘤是否缩小,更关心缓解能持续多久,患者能生存多久。这项研究给出了强有力的答案:对于那些通过拉罗替尼治疗达到完全缓解的患者,其4年总生存率超过90%。尤其是在那些传统治疗手段有限、预后不佳的肿瘤类型中,这意味着我们将有机会帮助患者实现真正的长期生存。
特别值得关注的是“等待-观察”策略的探索。在临床工作中,尤其是在儿童患者的治疗中,长期用药带来的潜在毒性和生活质量影响始终是我们顾虑的焦点。这项研究显示,近一半进入“等待-观察”期的患者能够长期维持无治疗缓解状态,即使出现进展,重新使用拉罗替尼依然有效。未来,我们或许可以根据患者的缓解深度和分子特征,探索更为智能的治疗方案,在确保疗效的同时,最大限度地提升患者的生活质量。这项研究成果无疑将进一步巩固NTRK融合检测在相关肿瘤诊疗路径中的核心地位,推动精准治疗理念的深化。
张玉教授:这项临床研究的巨大成功,其源头在于精准的病理诊断。每一个从拉罗替尼治疗中获得深度缓解和长期生存的患者,都是精准诊断的直接受益者。作为病理科医生,我们深刻地认识到,我们的角色已经从传统的形态学诊断,转变为整合形态学、免疫组化和分子检测的“精准病理诊断”。这项研究中76%的患者通过NGS发现了NTRK基因融合,但FISH和PCR也可发现少数病例,这提示了NTRK融合伴侣和断裂位点的多样性与复杂性。
这种分子异质性对检测方法提出了极高的要求。传统的免疫组化(IHC)可作为初步筛查,但存在一定的假阳性和假阴性率,且无法区分NTRK1/2/3亚型。FISH检测则可能因探针设计限制而漏掉非经典融合伴侣。即使是NGS的DNA检测,也可能因NTRK1/2/3基因组的内含子区域太大而漏掉部分融合类型,因此,基于RNA测序的二代测序(NGS)技术或可作为检测NTRK融合的金标准。RNA-NGS可以直接检测到融合转录本,不受融合伴侣和基因组断点位置的影响,具有最高的灵敏度和准确性。临床数据显示,近三成患者能达到完全缓解,这意味着如果不能在诊断初期就通过最可靠的手段识别出这些患者,患者就可能错失获得最佳治疗效果、甚至长期生存的机会。因此,我们在常规诊断流程中,就将覆盖NTRK1/2/3全基因的RNA-based NGS检测纳入常规路径,这是实现精准治疗、让更多患者获益的必要前提。
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


