乳腺癌作为危害女性健康的一种常见恶性肿瘤,其发病率在全球女性恶性肿瘤中位居首位,已成为一项亟待应对的公共卫生挑战。在这其中,约70%的乳腺癌患者被确诊为激素受体阳性(HR+)且人表皮生长因子受体2阴性(HER2-)[1]。乳腺癌是最常见骨转移的实体瘤之一,约65%~75%晚期乳腺癌会出现骨转移[2]。骨转移常引起高钙血症、病理性骨折、功能障碍等一系列骨相关事件(SREs),严重影响生活质量,严重者甚至导致死亡。细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂的出现,为HR+/HER2-晚期乳腺癌患者的临床治疗带来了革命性的转变,然而,面对HR+乳腺癌伴骨转移的治疗,如何更好地破局?
在此,【肿瘤资讯】特别邀请潍坊市人民医院于国秀医师报告一例53岁HR+/HER2-晚期乳腺癌骨转移女性患者病例,患者曾于五年余前确诊为右乳浸润性癌(pT2N1M0 IIB期),术后进行辅助放化疗及内分泌单药治疗后发生骨转移,并邀请到潍坊市人民医院王文辉教授基于该病例的诊治过程进行深度点评。
潍坊市人民医院乳腺病科 潍坊名医
中国抗癌协会肿瘤支持内科专业委员会第一届副主任委员
中国健康促进基金会乳腺疾病专家委员会委员
山东省老年医学会乳腺综合治疗委员会副主任委员
山东生物医学工程学会治疗不良反应多学科协作专委会副主委
山东医院协会肿瘤多学科整合诊疗专委会副主任委员
山东省抗癌协会肿瘤靶向治疗分会常委
潍坊市医学会乳腺甲状腺专业委员副主任委员
潍坊市医学会乳腺疾病多学科联合委员会副主任委员
潍坊市医师协会心身医学专委会副主任委员
潍坊市抗癌协会乳腺甲状腺专业委员副主任委员
潍坊市人民医院乳腺病科
山东省老年学与老年医学学会乳腺专业委员会委员
山东省中西医结合学会乳腺病专业委员会委员
潍坊市预防医学会乳腺甲状腺疾病防治专业委员会委员
潍坊市中西医结合学会精准医学专业委员会委员
潍坊市预防医学会甲状腺乳腺疾病多学科联合防治青年专业委员会委员
病例介绍
基本情况
患者女,53岁
主诉:右侧乳腺癌术5年余,腰椎转移术后10月余
现病史:
患者2019年12月在我院全麻下行右乳单纯切除+同侧腋窝前哨淋巴结活检术,术后常规病理示:(右)乳腺浸润性癌,结合免疫组化符合实性神经内分泌癌,伴灶性坏死,体积3cm×2cm×1cm,脉管内见癌栓,侵犯神经,乳头及肿物表面皮肤未受累及,近胸面切缘净,淋巴结内见癌转移(腋窝1/15,送2、3水平0/3),周围乳腺未见特殊改变。 免疫组化:ER(2+,95%)、PR(2+,20%)、C-erbB-2(2+)、P53(个别+)、CK5/6(-)、Syn(+)、CgA(-)、Ki-67指数(35%)。FISH(无扩增)。
术后诊断(2019年12月):右侧乳腺癌术后(pT2N1M0 IIB期 L-B1型)。
术后辅助化疗:表柔比星+环磷酰胺→多西他赛8周期至2020年5月19日。
术后放疗:右侧锁骨上下区+右侧胸壁放疗50Gy/25f 至2020年9月9日。
术后内分泌治疗:口服他莫西芬至2024年3月14日
期间定期复查,病情稳定。
2024年3月14日 腰背部疼痛不适入住于我院脊柱外科。
既往史:乙肝病史,规律行抗病毒治疗。
个人史:绝经年龄40岁(应用OFS后人工绝经)
查体:右乳缺如,右胸壁可见长约20cm手术瘢痕,局部未及结节;左乳无乳头凹陷及皮肤橘皮样改变,皮肤无红肿;双侧腋窝、双侧锁骨上未及异常。
胸腰椎生理曲度存在,腰椎棘突、棘间明显压痛、叩击痛,腰椎活动明显受限。
影像学检查:
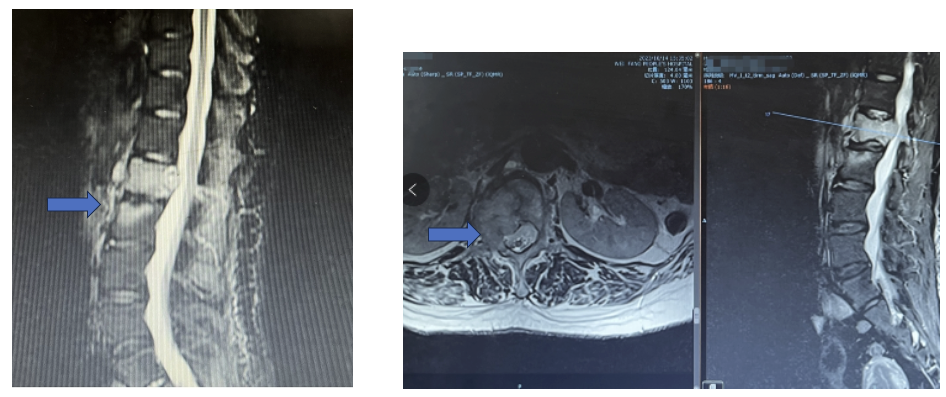
胸腰椎MR示: L1椎体及附件、L2椎体、L3棘突信号异常,考虑转移瘤可能性大。
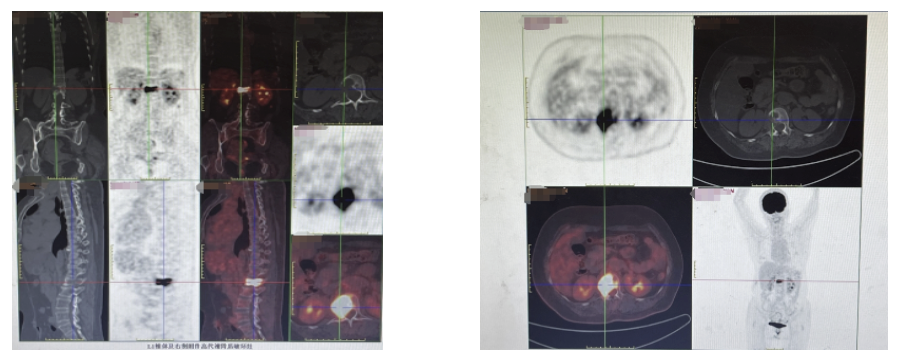
PET-CT示:L1骨质破坏伴代谢增高,考虑为转移所致可能性大。
骨手术:
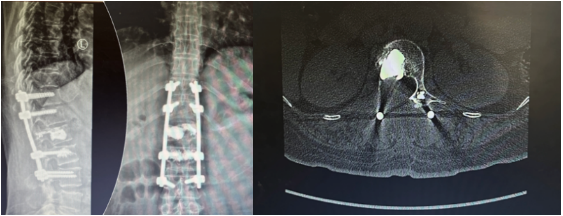
2024年3月19日在气管插管全麻下行腰椎转移瘤切除、椎管减压、骨水泥灌注、椎弓根钉内固定术,术后病理:骨组织脱钙后常规制:(腰椎椎体肿瘤)恶性肿瘤,结合病史及免疫组化符合乳腺癌转移,免疫组化结果:GATA3(+), ER(2+, 60%), PR(2+, 15%), C-erbB-2(2+), Syn(+), CgA(-), EMA(少许+), Ki-67(20%+)。 FISH阴性。(腰椎棘突)送检骨、软骨及骨髓组织,未见确切肿瘤累及。
诊断与治疗
诊断:
1. 骨转移(cIV期 L-B1型)
2. 腰椎转移瘤切除术后
3. 右乳癌术后(L-B1型)
治疗:
术后自2024年3月30日起给予来曲唑+瑞波西利+地舒单抗抗骨转移治疗。
2024年4月29日-2024年6月3日完成腰椎放疗25次。
治疗疗效评价
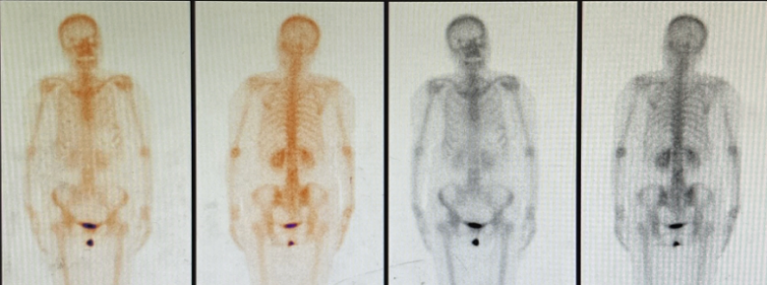
2024年12月19日复查骨ECT示:腰椎放射性分布欠均匀,见放射性分布稀疏区,以L1、2椎体为著,其余诸骨放射性分布大致均匀对称,腰椎放射性分布欠均匀,多考虑术后改变。
疗效评估:PR
病例点评
该病例为53岁HR+/HER2-晚期乳腺癌骨转移(cIV期 L-B1型)女性患者,患者曾于五年余前确诊为右乳浸润性癌(pT2N1M0 IIB期),术后进行辅助放化疗及内分泌单药治疗(他莫西芬),后于近期出现骨转移(cIV期),疾病进入晚期阶段,寻求治疗。
HR+/HER2-作为最常见的乳腺癌亚型,占所有乳腺癌的70%,其中初诊时为早期乳腺癌的患者比例高达95.2%[1]。经辅助内分泌单药治疗后仍有约 30% 的早期乳腺癌患者面临局部区域或远处的复发风险[3],且复发风险累积可长达20年[4]。在复发转移中,骨骼是乳腺癌最常见的远处转移部位,约占所有转移性乳腺癌患者的60%~75%[2]。研究发现,乳腺癌初诊至骨转移平均时长5年[5],且HR+乳腺癌更易发生骨转移[4],均符合本病例特征。
乳腺癌骨转移是乳腺癌发展的特殊阶段,总体而言,乳腺癌骨转移的治疗应以抗肿瘤联合骨改良药物为基础,结合患者具体情况制定局部治疗策略。在局部治疗上,该患者接受了腰椎转移瘤切除与腰椎放疗。对于系统性治疗,CDK4/6抑制剂联合内分泌治疗为HR+/HER2-晚期乳腺癌一线治疗标准方案,受到包括美国国立综合癌症网络(NCCN)指南、中国临床肿瘤学会乳腺癌(CSCO BC)诊疗指南(2025版)等多项国内外指南一致推荐[6-7]。然而,在众多CDK4/6抑制剂中,瑞波西利是截至目前唯一一款在HR+/HER2-晚期乳腺癌(涵盖绝经前及绝经后人群)一线治疗背景中同步证实无进展生存期(PFS)与总生存期(OS)双重获益的药物[8,9],且无论针对绝经前还是绝经后人群,研究均提示在治疗后8周后,相比单纯内分泌治疗,瑞波西利组疼痛明显改善[8,9]。专门针对绝经后乳腺癌患者群体展开探索的MONALEESA-2研究提示瑞波西利疗效数据亮眼,与安慰剂联合来曲唑治疗相比,瑞波西利联合来曲唑治疗在绝经后女性中能够实现超过五年(63.9个月)的中位OS,生存获益超过12个月(HR=0.76;p=0.004)[8],死亡风险降低24%(HR=0.76,P=0.008);且更为重要的是,瑞波西利联合治疗组中骨转移患者的OS获益与总体人群一致:针对骨转移患者群体,MONALEESA-2研究亚组分析显示,瑞波西利联合来曲唑治疗组的中位OS达到72.6个月,(HR=0.78,95%CI 0.50-1.21)[10],提示瑞波西利联合内分泌治疗方案对骨转移患者具有显著生存优势。
除了疗效获益,晚期肿瘤治疗评估范式正经历深刻演变,评估体系已从单一的疗效终点,转向以患者为中心的综合价值考量,强调在延长生存的同时,必须维护患者的生活质量。在这一背景下,欧洲肿瘤内科学会(ESMO)推出的临床获益量表(Magnitude of Clinical Benefit Scale, MCBS)作为国际认可的、用以量化评估抗肿瘤新药临床价值的关键工具为临床用药选择提供了重要参考。瑞波西利凭借其显著的PFS与OS双重获益,以及生活质量的提升,成为目前唯一获得ESMO-MCBS相较同类最高评分的CDK4/6抑制剂[11-13],彰显了其较为全面的治疗优势。
回到本病例,乳腺癌进入晚期骨转移阶段后,在一线系统性治疗上除了骨保护药物地舒单抗应用,同时予以瑞波西利联合来曲唑一线治疗,最终实现了快速缩瘤的满意效果,令人欣慰。期待本次病例分享为临床提供启示与借鉴。
*截止目前:2025年11月10日。
[1] 国家肿瘤质控中心乳腺癌专家委员会,等.HR+/HER-2-早期乳腺癌复发风险与临床管理专家共识(2025版).中华肿瘤杂志,2025,47(7):599—616.
[2] 中国抗癌协会骨肿瘤和骨转移瘤专业委员会. 乳腺癌骨转移临床诊疗专家共识[J]. 中国肿瘤临床, 2022, 49(13): 660-669. DOI: 10.12354/j.issn.1000-8179.2022.20211783.
[3]Sheffield KM, et al. Future Oncol 2022;18(21):2667-2682.
[4]Pan H, et al.N Engl J Med. 2017;377(19):1836-1846.
[5] Margaret L Hankins, et al. J Bone Oncol . 2021 May 3:29:100363.
[6] CSCO BC诊疗指南(2025年版).
[7] NCCN Guidelines Breast Cancer.
[8]Dickler, Maura N et al. Journal of clinical oncology : official journal of the American Society of Clinical Oncology vol. 34,22 (2016): 2602-9.
[9]Finn Rs, et al.ASCO 2022.LBA1003.
[10] O’Shaughnessy J, et al. SABCS 2021. Oral GS2-01.
[11] https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-for-solid-tumours/esmo-mcbs-scorecards?scorecard=9.[MONALEESA-2]
[12] https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-for-solid-tumours/esmo-mcbs-scorecards?scorecard=159.[monarch 3]
[13] https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-for-solid-tumours/esmo-mcbs-scorecards?scorecard=7.[PALOMA-2]
[14] US Food and Drug Administration. Clinical trial endpoints for the approval of cancer drugs and biologics. Available at: https://www.fda.gov/media/71195/download. Accessed December.
[15] Matthew P, Masakazu T, Jens H, et al. 2023 SABCS. GS01-12.
[16] Hortobagyi GN, et al. N Engl J Med. 2022;386(10):942-950.
[17] Richard S. Finn, et al.N Engl J Med 2016;375:1925-1936.
[18] Yen-Shen Lu, et al. 2022 Mar 1;28(5):851-859.
[19] Bishal Gyawali, et al. Nat Rev Clin Oncol. 2022 Oct;19(10):613-614.
[20] Oosting SF, et al. Ann Oncol. 2023 Apr;34(4):431-439.
[21] https:// www.esmo.org/guidelines/ esmo-mcbs/ esmo-mcbs-for-solid-tumours/ esmo - mcbs-scorecards/scorecard-338-1. [NATALEE][22] https://www.esmo.org/guidelines/esmo-mcbs/esmo-mcbs-for-solid-tumours/esmo-mcbs-scorecards?scorecard=371 [monarch E].
排版编辑:肿瘤资讯-CYX












 苏公网安备32059002004080号
苏公网安备32059002004080号


