在中国非小细胞肺癌(NSCLC)患者中,MET外显子14(METex14)跳跃突变比例为0.9%-2.0%[1],METex14跳跃突变的肿瘤细胞具有高侵袭性特征,往往在抗肿瘤治疗过程中出现耐药性并且患者预后不良。高选择性MET-TKI已成为METex14跳跃突变晚期NSCLC患者的首选治疗方案,以卡马替尼为代表的众多MET-TKI药物相继研发成功并广泛应用于临床实践,为患者带来了新的治疗希望。
“愈见达案”专栏致力于呈现METex14跳跃突变NSCLC患者接受靶向治疗的历程,融合权威专家的临床经验,为广大临床医生的临床诊疗提供参考,助力患者获得更精准、更有效的治疗方案。本期“愈见达案”将分享一例METex14跳跃突变期肺腺癌患者,采用卡马替尼作为一线治疗后有效控制肺部病灶并实现部分缓解(PR)的诊疗经验。该例病例由河北大学附属医院李小芳医生提供,并邀请河北大学附属医院商琰红教授结合最新临床证据进行深入解读,以期为METex14跳跃突变NSCLC患者诊疗提供有益启示。
河北大学附属医院 肿瘤内科
河北省女医师协会专业委员会常委
北京鼎医公益基因会胸部肿瘤智能医疗专业委员会常委
中国医药教育协会肿瘤免疫治疗专业委员会委员
北京防治研究会肺癌分委会委员
北京癌症防治学会免疫治疗不良事件管理专业委员会委员
天津市医疗健康学会第一届肿瘤专业委员会委员
河北省抗癌协会肿瘤内科专业委员会青年委员会 委员
河北省抗癌写会第一界黑色素瘤专业委员会委员
河北大学附属医院肿瘤学系主任 肿瘤内科肺癌病区主任
中国医药教育学会(CMEA)第五届理事
中国抗癌协会化疗专业委员会 委员
中国抗癌协会肺部肿瘤整合康复专委会 委员
中国抗癌协会胸膜间皮瘤专业委员会 委员
中国女医师协会第二届药学专业委员会 委员
中国医药教育协会肺癌专委会 常务委员
中国人体健康科技促进会肿瘤个体化精准医疗专业委员会 副主任委员
北京鼎医公益基金会胸部肿瘤智能医疗专业委员会 副主任委员
北京科创医学发展基金会肺癌专业委员会 常务委员
北京肿瘤防治研究会肺癌分委会 常务委员
河北省临床肿瘤学会第二届理事
河北省抗癌协会靶向治疗专业委员会 副主任委员
河北省女医师协会肺癌专业委员会 副主任委员
河北省临床肿瘤学会肺癌专家委员会第一届委员会 副主任委员
保定市医学会肿瘤学分会主委
治疗历程回顾
基本情况
基本信息:男性,70岁。
现病史:因“右侧肢体活动障碍7天,发现肺占位2天”于2024年12月26日入院。
既往史:吸烟40年,每日20支
体格检查:右侧鼻唇沟变浅,示齿口角左偏,伸舌右偏;右侧下肢肌力下3级,左侧下肢肌力5级。ECOG评分:2分。
肿瘤指标:CA125 75U/mL↑(0-35U/mL),NSE 21ng/mL↑(0-16.3ng/ml)。
辅助检查:
● 2024年12月23日头颅MRI平扫+增强:左侧额叶占位,考虑转移,不排除脑胶质瘤(最大直径71mm)。
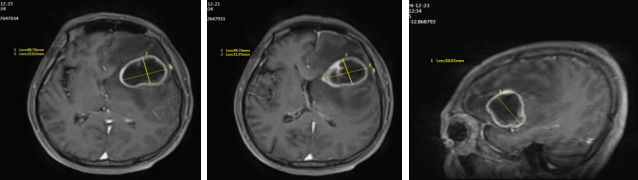 头颅MRI增强(2024年12月23日)
头颅MRI增强(2024年12月23日)
● 2024年12月26日颈胸腹盆CT增强:左肺上叶占位性病变(74mm),考虑癌,侵犯胸壁,伴左肺门淋巴结转移。
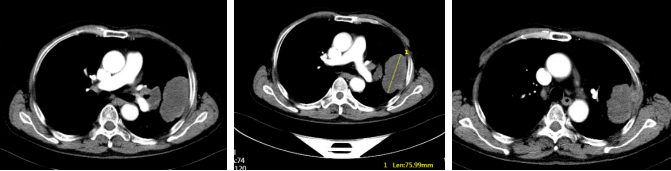 胸部腹部增强CT(2024年12月26日)
胸部腹部增强CT(2024年12月26日)
● 2024年12月28日全身骨显像:未见明确骨转移。
● 2025年1月3日经皮肺穿刺活检:(左肺上叶穿刺活检)非小细胞癌,结合免疫组化符合肺腺癌。免疫组化:CK7(+),NapsinA(+),P40(-),TTF-1(+)。
● 2025年1月16日左肺组织基因检测(NGS 520基因):METex14跳跃突变(丰度84.89%),MET拷贝数扩增(CN:6.3),TP53错义突变(丰度47.2%),TMB 3.99Mb ,MSS型,PD-L1阳性(22C3 TPS 90%)。
● 2025年1月16日头颅MRI增强:左侧额叶占位,考虑转移,较前明显增大,中线移位。
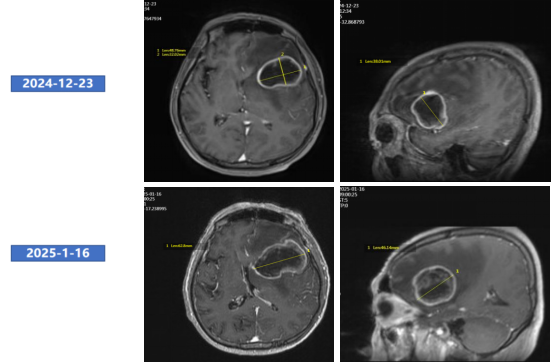 头颅增强MRI
头颅增强MRI
临床诊断:左肺上叶周围型肺腺癌 cT4N1M1b IVB期,左肺门淋巴结转移,颅内转移(单发),METex14跳跃突变PD-L1 90%。
治疗经过
一线治疗:2025年1月21日开始卡马替尼400mg口服,每日两次。
不良反应:
皮疹1级
肝损1级:ALT 85U/L,AST 41U/L;处理:口服保肝降酶药物后恢复正常。
疗效评估(肺):
● 2025年3月19日颈胸腹部CT增强:左肺上叶病灶及左肺门淋巴结较前明显缩小。总体评效:PR(缩小38%)。
● 2025年3月20日肿瘤标志物:CEA、CA125、NSE 降至正常。
● 2025年6月19日颈胸腹增强CT增强:左肺上叶病灶及左肺门淋巴结较前缩小。总体评效:持续PR(缩小49%)。
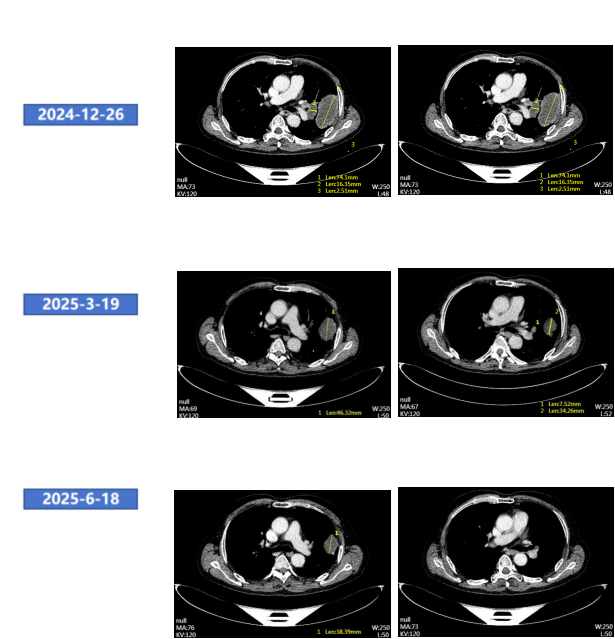 胸部腹部增强CT
胸部腹部增强CT
疗效评估(颅内):
● 2025年3月20日头颅MRI增强:左侧额叶占位及周围水肿范围较2025年1月16日明显缩小。总体评效:PR(缩小53%)。
● 2025年6月19日复查头颅MRI增强:左侧额叶占位及周围水肿范围较2025年3月20日缩小。总体评效:PR(缩小70%)。
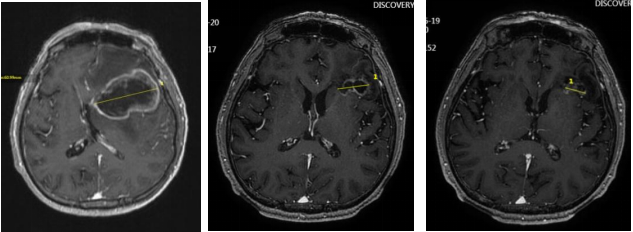 头颅增强MRI(左:2025年1月16日;中:2025年3月20日;右:2025年6月19日)
头颅增强MRI(左:2025年1月16日;中:2025年3月20日;右:2025年6月19日)
● 症状缓解情况:口服靶向药物7天头颅症状明显好转(意识障碍转为意识恢复),1月后意识完全正常,活动自如;PS评分恢复至1分。
● 目前继续原方案治疗,患者耐受性较好,无明显头晕、头痛等不适。
病例解析
关于MET-14跳突
肺癌是我国发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌(NSCLC)约占85%。晚期NSCLC的治疗已进入分子靶向时代,MET基因是关键驱动基因之一。c-MET是由MET基因编码的受体酪氨酸激酶,其配体为肝细胞生长因子(HGF)。正常情况下,HGF/c-MET信号通路参与调控细胞生长、存活与迁移。当MET发生异常时,该通路持续激活,导致细胞恶性增殖与转移,促进肿瘤发生发展。MET异常主要包括以下四类:1. 基因扩增:MET拷贝数增加,导致蛋白过表达,包括原发MET扩增和继发MET扩增,继发MET扩增常见于三代EGFR TKI耐药后。2. 外显子14跳跃突变(METex14):该突变导致c-MET蛋白降解障碍,信号通路持续激活,在NSCLC中约占3–4%。3. 蛋白过表达:在非鳞NSCLC中约半数患者存在不同程度的c-MET蛋白过表达。但是过表达与肿瘤致病相关性有待进一步研究。4. 基因融合:尽管罕见,MET基因融合可形成持续激活的嵌合蛋白,在胶质母细胞瘤等肿瘤中起驱动作用[1]。
MET异常的不同形式中,METex14跳跃突变致病性最强。METex14跳跃突变是指14号外显子两侧选择性剪接位点发生突变,导致14号外显子在转录水平丢失。该突变直接导致MET蛋白JM结构域缺失,进而引发MET蛋白无法与泛素化蛋白结合,影响MET蛋白的降解,形成持续性的信号传导,促进了肿瘤细胞的增殖、迁移和侵袭。在NSCLC人群中,中国人群的METex14跳跃突变比例为0.9%-2.0%。按照不同肺癌分型分析,METex14跳跃突变在肺腺癌患者中的发生率较高,约为3%,在肺鳞癌患者中发生率为1%-2%。在肺肉瘤样癌患者群体中,有13%-22%会出现METex14跳跃突变。携带METex14跳跃突变的NSCLC患者同时伴有EGFR突变的比例为0.3%-10.0%,同时伴有EGFR基因扩增的比例为6.4%-28.5%。METex14跳跃突变一般多发生于老年患者,患者中位年龄为72.5岁。
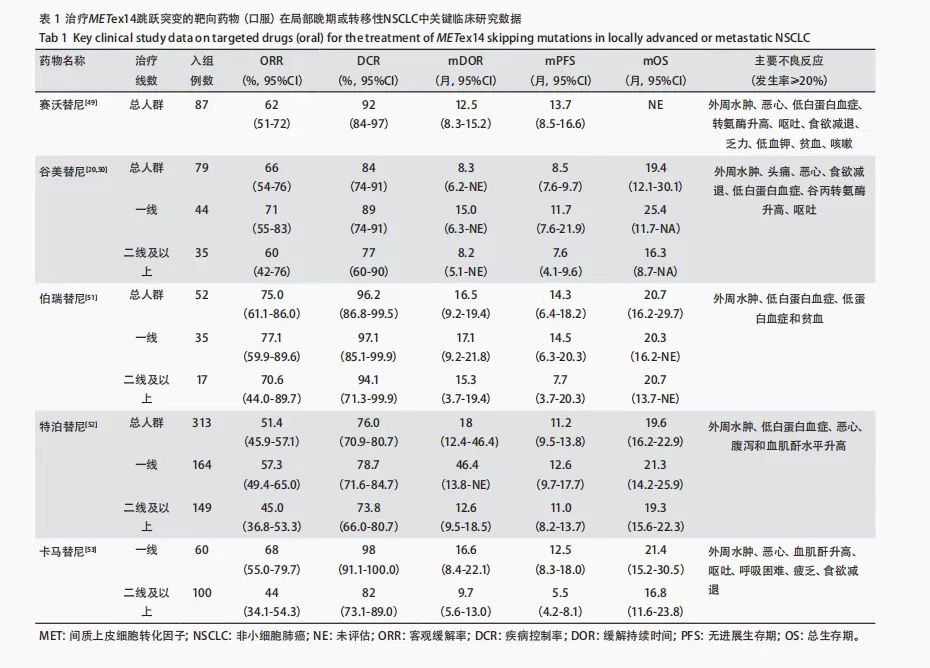
对于METex14跳突的局部晚期或转移性NSCLC指南推荐靶向治疗[1]。靶向药物主要有:赛沃替尼(Savolitinib):II期研究显示,在中国METex14+ NSCLC患者中ORR达49.2%,中位DoR为8.3个月,中位PFS为6.8个月,尤其在肺肉瘤样癌(PSC)中也显示出40%的ORR。安全性方面,46%患者发生≥3级TRAE,常见为肝酶升高和外周水肿。谷美替尼(Glumetinib):GLORY研究显示,在METex14+ NSCLC中ORR为66%(初治患者71%),中位DoR为8.3个月,对脑转移患者有效。卡马替尼(Capmatinib):GEOMETRY mono-1研究中,初治和经治METex14+患者的ORR分别为68%和41%,中位DoR为12.6和9.7个月,对脑转移亦具疗效。特泊替尼(Tepotinib):VISION研究显示,ORR为51.4%,初治患者中位DoR达46.4个月,颅内ORR为66.7%。INSIGHT 2研究证实其联合奥希替尼在MET扩增耐药患者中ORR为50%,中位PFS为5.6个月。伯瑞替尼(Vebreltinib):KUNPENG研究中ORR达75%,中位DoR为15.9个月,中位PFS为14.1个月,安全性良好。化疗对于不适用靶向治疗或靶向耐药的患者,含铂双药化疗(如培美曲塞+铂类)仍是基础选择。免疫治疗PD-1/PD-L1抑制剂在部分c-MET异常患者中可能有效,通常作为后线治疗选择。
该患者初诊时即存在颅内转移,且伴有明显颅高压症状,经过卡马替尼一线治疗1周后,颅高压症状迅速缓解,1月后症状消失。2月后复查影像肺内原发灶和颅内转移灶PR。这与GEOMETRY mono-1研究的亚组分析[2]结果一致,该研究显示卡马替尼对合并脑转移的METex14跳突NSCLC患者同样有效,且无论是否接受过局部放疗,均表现出优异的颅内病灶缓解率。
该患者同时存在MET扩增
该患者同时存在MET基因扩增,多项研究的汇总数据显示,原发性MET基因扩增在NSCLC患者中的发生率约为2.0%至5.8%之间[3,4]。相比之下,继发性MET基因扩增更为常见,在既往接受过EGFR-TKI治疗并产生耐药的EGFR突变型NSCLC患者中,其发生率在2.9%至66.7%之间[4-8],是EGFR-TKI耐药的关键机制之一。
在疾病特征方面,现有证据一致表明,MET基因扩增的发生与患者的年龄、性别以及NSCLC的组织学亚型(如腺癌、鳞癌或其他类型)之间没有发现显著的统计学关联[9,10]。关于吸烟史与MET基因扩增的关系,多数研究未发现明确的关联。然而,在一项针对EGFR-TKI治疗后进展的患者的研究中,吸烟史被发现与继发性MET基因扩增的更高发生概率相关(p=0.011)[9],显示了该领域研究结果的不一致性。此外,一个值得关注的发现是,MET基因扩增的存在与程序性死亡配体1(PD-L1)的较高表达水平存在一定的正相关性[11,12],这可能对免疫治疗策略的选择具有潜在的指导意义。从临床预后角度看,越来越多的证据表明,MET扩增与较差的治疗结局密切相关。一项研究发现,伴有MET基因扩增的早期(I-III期)NSCLC患者,其发生远处转移的时间显著缩短(11.6个月 vs. 43.8个月,p=0.004),多变量分析确认MET基因扩增是早期远处转移的强相关预测因子(风险比HR: 4.86)[13]。此外,在转移性肺腺癌的肿瘤样本中,MET基因扩增的检出率显著高于原发肿瘤,尤其是在脑转移病灶中[14,15],提示MET基因扩增可能在肿瘤的转移过程中扮演了重要角色。
对于原发性MET扩增靶向治疗,MET-TKI有一些小样本研究数据。卡马替尼GEOMETRY mono - 1研究中,纳入了不同MET状态的患者,其中对于MET高扩增(定义为基因拷贝数≥10或FISH阳性)且既往未接受过治疗的NSCLC患者,卡马替尼治疗的客观缓解率(ORR)可达40% - 60% ,中位无进展生存期(mPFS)为 5 - 9个月 。对于经治患者,ORR也能达到30% - 50%,mPFS约为4 - 7个月。特泊替尼的VISION研究MET扩增队列中,特泊替尼展现出一定的抗肿瘤活性。对于MET高扩增(基因拷贝数≥5)的患者,ORR约为30% - 40% ,mPFS在4 - 8个月左右。赛沃替尼一项中国开展的Ⅱ期研究中,纳入了MET外显子14跳跃突变或MET扩增的晚期NSCLC患者,对于MET扩增患者,赛沃替尼治疗也显示出一定疗效,ORR可达20% - 40%,mPFS为3 - 7个月 。谷美替尼在一项开放标签Ib/Ⅱ期研究中,针对原发MET扩增的局部晚期/转移性非小细胞肺癌(NSCLC)患者,单药治疗的客观缓解率(ORR)约为40%-50%,中位无进展生存期(PFS)约5-7个月。在伯瑞替尼(Bozitinib)早期临床研究(Ⅰ/Ⅱ期)及亚组分析中,单药治疗的ORR约为45%-55% ,mPFS约为6-8个月。 但是以上均是临床亚组或小样本数据,指南扔推荐以铂类为基础的联合治疗。
该患者同时存在MET-14跳突和原发MET扩增,根据指南选用了MET-TKI--卡马替尼,原因是考虑到卡马替对于原发MET-14跳突和MET扩增均有效,目前临床疗效显著。
该患者同时存在PD-L1高表达
该例患者同时伴有PD-L1高表达(22C3 TPS 90%),PD-L1高表达是否影响MET-TKI疗效?有研究显示EGFR阳性晚期NSCLC伴有PD-L1高表达对EGFR-TKI疗效差。有文献显示在临床中心142例EGFR阳性晚期NSCLC患者进行回顾性分析,按PD-L1表达水平分为≥50%、1%~50%及<1%三组,比较其接受EGFR-TKI治疗的中位无进展生存期(mPFS)差异。结果显示,高表达组mPFS显著短于低表达及阴性组,提示PD-L1异常表达与耐药发生密切相关。通过相关机制研究发现:PD-L1高表达在EGFR敏感突变NSCLC中通过PI3K/Akt/mTOR、MEK/ERK及IL-6/JAK/STAT3等信号通路,上调PD-L1表达;DNA去甲基化及组蛋白修饰改变亦参与调控;肿瘤相关巨噬细胞分泌IL-10、TGF-β可进一步促进免疫逃逸。所以PD-L1高表达可通过多重分子机制及免疫微环境重塑显著影响EGFR敏感突变NSCLC患者EGFR-TKI疗效,并在原发及获得性耐药中发挥重要作用。
那么对于MET基因改变的患者合并PD-L1的高表达是否影响MET-TKI疗效呢?多项研究证实,在NSCLC中,存在MET基因改变的肿瘤患者常常伴随着PD-L1的高表达[16],具体机制需要进一步研究。但在METex14突变的NSCLC患者中,即使PD-L1高表达,他们接受免疫检查点抑制剂(ICIs)单药治疗的疗效也较为有限[17]。既往研究显示,PD-1/PD-L1抑制剂单药治疗METex14突变患者的ORR仅约10%-20%,mPFS多不足6个月,远低于MET TKI;机制上,METex14突变导致的肿瘤生长主要依赖MET信号通路激活,属于“明确驱动型”肿瘤,而非以免疫逃逸为主导,因此免疫治疗单药难以有效阻断核心致癌通路。因此,对于携带MET基因改变的患者,首选的治疗策略是针对MET靶点的TKI治疗,其疗效主要依赖于对MET信号通路的有效阻断。该患者同时存在MET-14跳和MET扩增,可能是因为二者均有驱动性,且双驱动可能是导致PD-L1高表达的根本原因,而卡马正好可以双压制。但PD-L1高表达是TKI负性预测因素,患者能否从TKI长期获益需动态观察。
综上所述,MET-TKI仍然是MET-14跳突局部晚期或转移性非小细胞肺癌标准治疗;对于原发MET扩增,虽有小样本研究数据提示MET-TKI治疗有效,但目前指南仍推荐是以铂类为基础的联合治疗。该患者MET-14跳突伴MET扩增可能是导致卡马替尼快速获益的协同因素。但PD-L1高表达也可能代表了更强的免疫逃逸,代表了更差的TKI获益,故仍需关注该患者长期获益情况。
[1] 陈军,韩宝惠,胡毅等.MET异常NSCLC诊疗专家共识(2025 版).中国肺癌杂志2025年2月第28卷第2期.
[2] Wolf, J., et al., Capmatinib in MET exon 14-mutated non-small-cell lung cancer: final results from the open-label, phase 2 GEOMETRY mono-1 trial. The Lancet Oncology, 2024. 25(10): p. 1357-1370.
[3] Yin W, Cheng 1, Tang Z, et al. MET amplification (MET/CEP7 ratio ≥1.8) is an independent poor prognostic marker in patients with treatment-naive non-small-cell lung cancer. Clin Lung Cancer (2021) 22(4):512-28.
[4] Yin W, Liu W, Guo M, et al. Acquired MET amplification in non-small cell lung cancer is highly associated with the exposure of EGFR inhibitors and may not affect patients outcome. Exp Mol Pathol (2021) 118:104572.
[5] Le X, Puri S, Negrao MV, et al. Landscape of EGFR-dependent and independent resistance mechanisms to osimertinib and continuation therapy beyond progression in EGFR-mutant NSCLC. Clin Cancer Res (2018) 24(24):6195-203.
[6] Ramalingam SS, Yang JCH, Lee CK, et al. Osimertinib as first-line treatment of EGFR mutation-positive advanced non-small-cell lung cancer. J Clin Oncol (2018) 36(9):841-9.
[7] Schoenfeld AJ, Chan JM, Kubota D, et al. Tumor analyses reveal squamous transformation and off-target alterations as early resistance mechanisms to first-line osimertinib in EGFR-mutant lung cancer. Clin Cancer Res (2020) 26(11):2654-63.
[8] Patil T, Mushtaq R, Marsh S, et al. Clinicopathologic characteristics, treatment outcomes, and acquired resistance patterns of atypical EGFR mutations and HER2 alterations in stage IV non-small-cell lung cancer. Clin Lung Cancer (2020) 21(3):e191-204.
[9] Ahn B-C, Lee JH, Kim MH, et al. Distinct characteristics and clinical outcomes to predict the emergence of met amplification in patients with non-small cell lung cancer who developed resistance after treatment with epidermal growth factor receptor tyrosine kinase inhibitors. Cancers (2021) 13(12):3096.
[10] Baldacci S, Mazieres J, Tomasini P, et al. Outcome of EGFR-mutated NSCLC patients with MET-driven resistance to EGFR tyrosine kinase inhibitors. Oncotarget (2017) 8(62):105103-14.
[11] Albitar M, Sudarsanam S, Ma W, et al. Correlation of MET gene amplification and TP53 mutation with PD-L1 expression in non-small cell lung cancer. Oncotarget (2018) 9(17):13682-93.
[12] Domènech M, Muñoz Marmol AM, Mate JL, et al. Correlation between PD-L1 expression and MET gene amplification in patients with advanced non-small cell lung cancer and no other actionable oncogenic driver. Oncotarget (2021) 12(18):1802-10.
[13] Fang L, Chen H, Tang Z, et al. MET amplification assessed using optimized FISH reporting criteria predicts early distant metastasis in patients with nonsmall cell lung cancer. Oncotarget (2018) 9(16):12959-70.
[14] Burns TF, Dacic S, Velez MA, et al. MET alterations are enriched in lung adenocarcinoma brain metastases and define a distinct molecular and transcriptomic subtype. Cancer Res (2021) 81(13_Supplement):2218.
[15] Huang RSP, Harries L, Decker B, et al. Clinicopathologic and genomic landscape of non-small cell lung cancer brain metastases. Oncologist (2022) 27(10):839-48.
[16] Lee JK, Madison R, Classon A, et al. Characterization of Non-Small-Cell Lung Cancers With MET Exon 14 Skipping Alterations Detected in Tissue or Liquid: Clinicogenomics and Real-World Treatment Patterns. JCO Precis Oncol. 2021 Aug 25;5:PO.21.00122.
[17] Sabari JK, Leonardi GC, Shu CA, et al. PD-L1 expression, tumor mutational burden, and response to immunotherapy in patients with MET exon 14 altered lung cancers. Ann Oncol. 2018 Oct 1;29(10):2085-2091.
排版编辑:CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


