对于使用免疫治疗的肺癌患者,骨转移可导致包含原发灶的骨外全身病灶免疫治疗效果大幅下滑[1],还可能引发病理性骨折、脊髓压迫等骨相关事件(SREs),影响患者生存质量[2]。近期研究显示,联合地舒单抗在降低骨转移患者的SRE发生风险的同时,能够改善骨转移患者全身病灶免疫治疗的疗效,提升缓解、延长生存[1] 。本期,我们邀请来自复旦大学附属肿瘤医院杨曦医生分享了一例晚期肺癌伴多发骨转移、髂骨巨大骨转移患者长期应用免疫治疗联合地舒单抗治疗,最终达到完全缓解(CR)、PFS达2年的规范化诊疗案例。【肿瘤资讯】对此进行整理,并特邀复旦大学附属肿瘤医院朱正飞教授进行点评,与大家共同学习。
科主任助理,副主任医师
上海市抗癌协会放射治疗专业委员会青年委员
复旦大学附属肿瘤医院放射治疗中心副主任,主任医师
复旦大学胸部肿瘤研究所副所长
上海市医师协会肿瘤放疗科医师分会副会长
中国抗癌协会非小细胞肺癌专业委员会常委
中国临床肿瘤学会小细胞肺癌专委会常委
中国抗癌协会肿瘤放射治疗专业委员会委员
中国临床肿瘤学会非小细胞肺癌专委会委员
中国医药教育学会肿瘤放疗专委会副主任委员
中国初级卫生保健基金会肺部肿瘤慢性病专委会副主任委员
入选上海市浦江人才计划,上海市卫健委“医苑新星”杰出青年医学人才计划
获上海市抗癌科技奖一等奖(第一完成人)
MD. Anderson肿瘤中心访问学者
病例介绍
基本情况
基本信息:患者男,55岁。
主诉:因出现骨骼不适4月余,外院就诊疑似肺癌骨转移,于2023年5月入我院就诊。
现病史:外院胸部CT示右侧髂骨质破坏,邻近骶骨右侧骨质毛糙,左侧坐骨、髋臼及右侧耻骨密度不均。左侧髋臼周围软组织影,右肺上叶占位,肝内多发异常密度影;ECT示全身多发骨转移,左侧前肋(约第一肋骨)、腰椎、右侧骶髂关节、右侧耻骨、左侧髋关节为著;MRI示L1段转移伴病理性骨折,右侧髂骨局部骨质破坏。为寻求进一步诊治,患者入院就诊。
既往史:无特殊。
个人史:吸烟史30年余*1包/天;社交性饮酒。
辅助检查
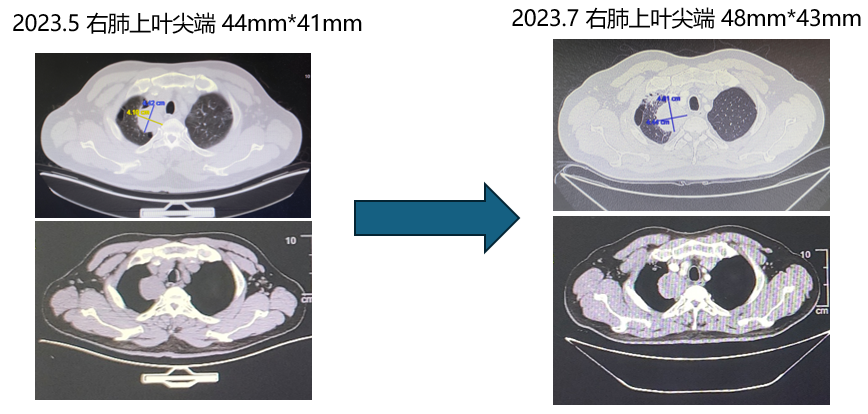
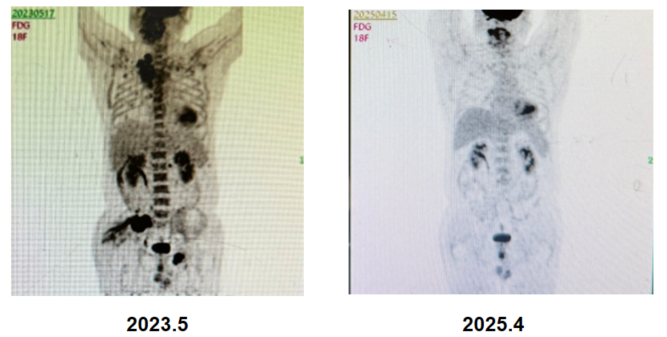
胸部CT+PET/CT(2023年5月17日):右肺尖叶占位,范围约4.4*4.1cm,FDG高代谢,恶性肿瘤可能大;伴周围炎;全身多发骨转移,右侧淋巴结转移,纵隔、腹膜后、两侧髂血管旁、左侧臀肌间隙淋巴结转移可能。鼻咽部炎症可能;左上肺少许纤维灶;两上肺肺气肿;食管下段炎症可能;肝囊肿。
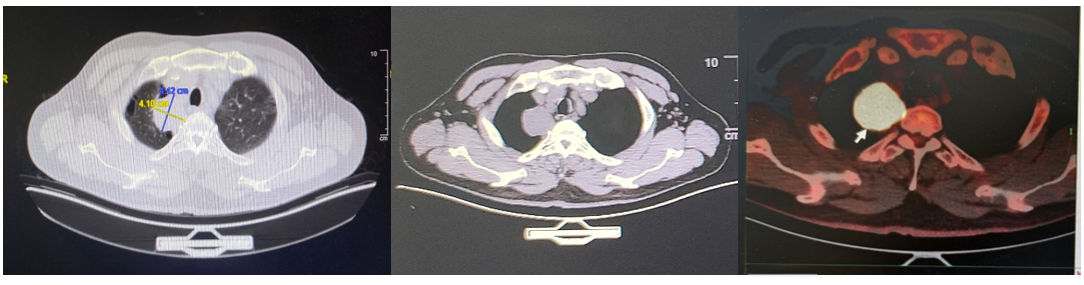
PET/CT(2023年5月17日):骨盆多处骨质破坏,右侧髂骨为甚(骨病灶尺寸:6 cm* 4.5cm),周围伴软组织肿块,放射性浓聚。此外,骨骼多处放射性摄取增高。ECT示全身多发骨转移,左侧前肋(约第一肋骨)、腰椎、右侧骶髂关节、右侧耻骨、左侧髋关节为著。
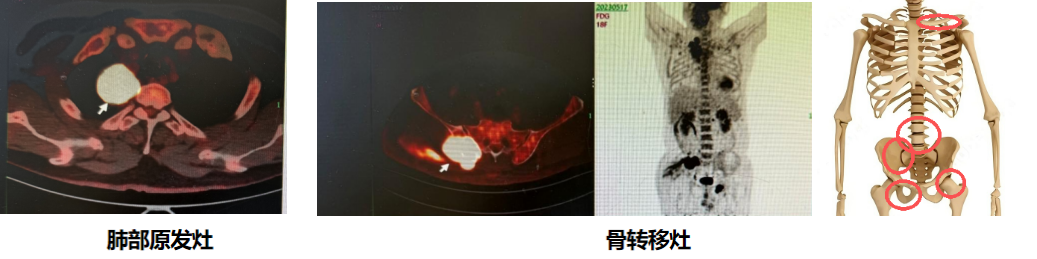
图2. 原发灶与骨转移灶对比
(骨转移灶图左,中为PET/CT,右为骨转移病灶示意图)
病理检查(2023年5月17日):(右肺)恶性肿瘤。免疫组化示上皮样分化,倾向于腺癌,CK7++,CK++,CK19+。PD-L1阳性,肿瘤比例评分(TPS)(PD-L1+肿瘤细胞):1%-49%。
临床诊断
(右肺上叶)肺腺癌,T2N3M1 IV期,伴多发骨转移及淋巴结转移,ECOG评分为1分。
治疗经过
1) 多学科团队(MDT)讨论:患者为晚期肺腺癌,无驱动基因突变,PD-L1 1-49%,后续标准治疗方案应为免疫联合化疗。除原发灶外,患者存在多发骨转移、髂骨转移较大,且已出现行动受限与骨并发症迹象,国内外指南建议这类患者在骨保护药物治疗的基础上可联合局部放疗,有助于缓解症状、降低病理性骨折的风险。
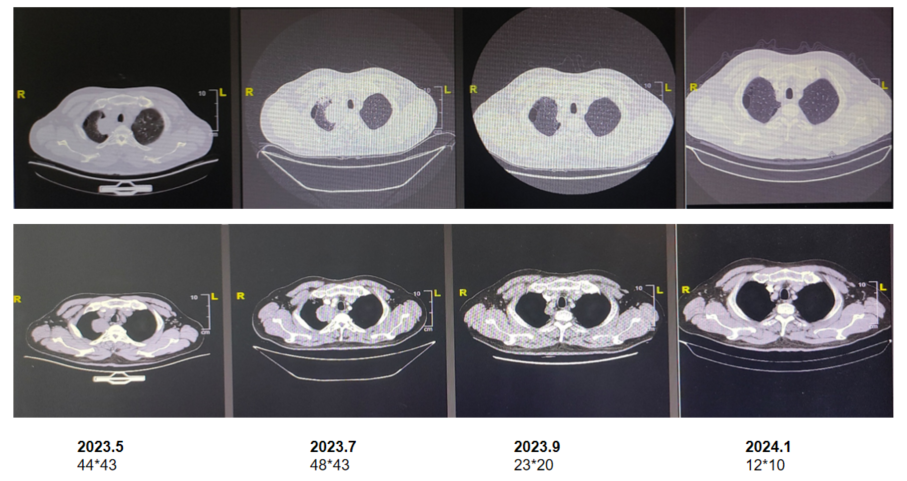
2) 放疗:患者于2023年5月22日开始行骨转移放疗,髂骨病灶得到快速控制,患者行动受限、疾病症状快速得到改善。
3) 免疫治疗:髂骨局部问题得到快速控制后,于5月29日开始按计划行PD-1抑制剂联合化疗治疗,免疫联合化疗3周期后(2023年7月)CT示右肺上叶恶性肿瘤,周围多发炎症;双肺散在微小结节;右侧锁骨上、两肺门及纵隔多发小淋巴结;左第一前肋骨转移可能骨盆多处骨转移可能。随访CT显示患者肺部病灶大小较老片相仿,疗效评估:疾病稳定(SD)。患者疾病症状、指标改善,患者自觉较此前体力有明显改观,结合患者实际情况,综合考虑肺部影像学变化是免疫治疗初期炎症细胞浸润和肿瘤组织坏死水肿导致的肿块一时性增大,故继续维持原方案治疗。
4)骨保护药物治疗:2023年7月下旬完成初期免疫联合化疗后,开始行PD-1抑制剂联合培美曲塞维持治疗,同时联合地舒单抗规律骨保护治疗。
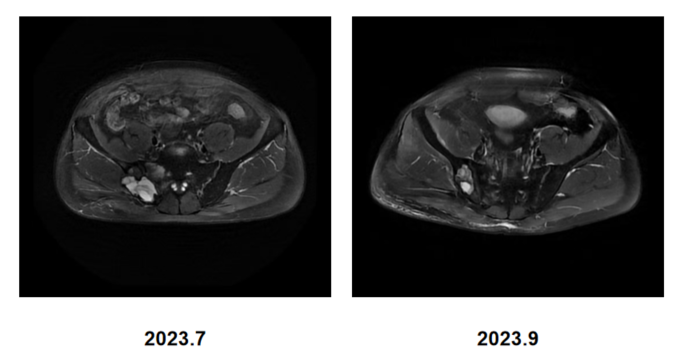
5)后续维持治疗与随访:2023年9月,MRI示骨盆仍有多处骨转移,右侧骶骨范围缩小,余同前。原本问题较为严重的髂骨病灶在放疗、免疫联合化疗、骨保护治疗的综合治疗下取得了良好的治疗效果,病灶大幅退缩,患者行动能力得到恢复;CT示右肺上叶肿瘤较前退缩,周围多发炎症较前减轻。右锁骨上淋巴结较前缩小。余双肺多发小结节,较前减少。两肺门及纵隔小淋巴结较前缩小。
2023年11月30日,CT示原右肺上叶纵隔旁肿块此次呈片状改变,右锁骨上淋巴结较前略缩小。部分椎体及肋骨局灶致密同前。
2024年3月29日,CT示右肺上叶纵隔旁片状影较前略减小,右锁骨上、两肺门及纵隔小淋巴结同前相仿,双肺肺大疱,两肺多发微小结节,部分椎体及肋骨局灶致密同前相仿。
2024年10月10日,CT示右肺MT复查,右肺上叶纵隔少许条状索影同前相仿,右锁骨上、两肺门及纵隔小淋巴结同前相仿,双肺肺大疱同前;部分椎体及助骨局灶致密同前相仿。
2025年4月15日,CT及PET/CT显示原发灶及全身多发转移淋巴结基本消退,全身多处骨转移灶亦明显好转,局部成骨性骨质改变,未见FDG代谢增高,提示骨修复。疗效评估:完全缓解(CR)。
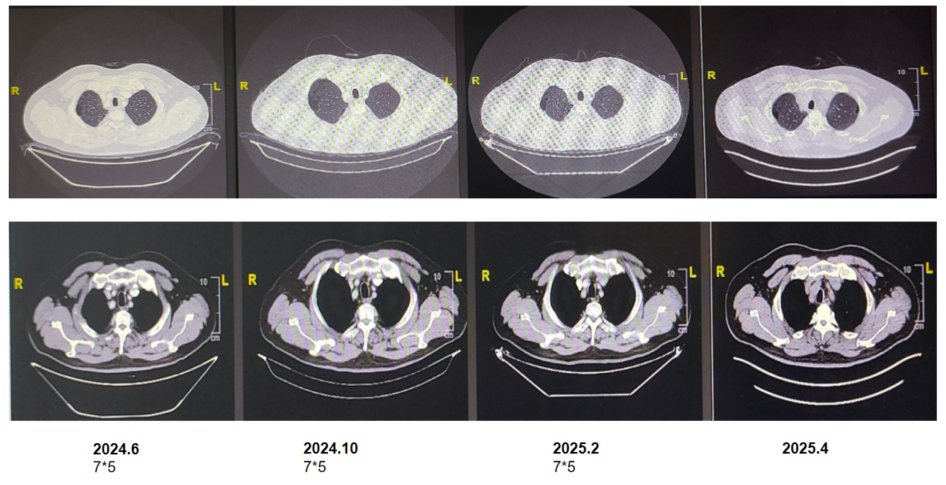
结合III期临床研究的循证数据、患者治疗效果及患者自身治疗意愿,在免疫治疗+地舒单抗维持治疗~2年,达到CR且病情持续稳定后,综合考虑各方面因素,患者考虑暂停免疫治疗,末次免疫治疗时间为2025年6月3日,患者目前仍在随访中,持续CR。
五、病例小结
该例55岁男性患者初诊为右肺癌伴骨多发转移及淋巴结转移。患者在骨放疗后接受4疗程含铂双药化疗+PD-1抑制剂治疗,疗效评估为SD。后行PD-1抑制剂联合化疗、骨保护药物地舒单抗治疗维持治疗,持续治疗近2年。目前,患者右肺原发灶及全身多发转移淋巴结基本消退,全身多处骨转移灶亦明显好转,局部成骨性骨质改变,疗效评估为CR。
专家点评
朱正飞教授指出,骨转移是肺癌常见远端转移,约40%晚期肺癌患者会在病程中发生骨转移[3],本例患者在诊断时已出现椎体、骨盆、肢端多发骨转移,椎体压缩性骨折、髂骨巨大转移,髂骨病灶甚至超过了原发灶,病情较为严重。既往研究显示,这类骨转移患者通常即将面临SRE风险,同时也是免疫治疗的“难治人群”,OS常常差于非骨转移患者[4]。但该患者最终在我们多学科团队个体化全程管理方案下,实现超2年的PFS,多发、巨大的骨转移灶与原发灶全部消退,最终达到CR的良好疗效,从SRE即将发生的免疫难治人群到最终实现CR,我们如何为患者“量体裁衣”,结合这位患者的诊疗,我们将思考过程与大家分享。
回顾诊疗全程,患者初到院时病情较为复杂,根据我们的经验,该患者很可能即将发生SRE且属于免疫难治人群,但患者治疗意愿强,愿意积极配合我们。结合患者实际情况,我们判断首要问题是原发灶与骨转移的疾病控制,患者髂骨转移巨大,已有进一步恶化迹象,我们第一时间对患者的髂骨转移进行放疗。在放疗后基于此前的检查结果开始行免疫联合含铂双药化疗,后续同步开始地舒单抗骨保护治疗。在免疫治疗期间,首次疗效评估为SD,我们结合患者临床实际治疗反应,认为免疫治疗已经起效、应继续坚持治疗,CT影像上的病灶“增大”可能是免疫细胞浸润、肿瘤炎症的表现。患者在进一步免疫联合化疗以及地舒单抗治疗后疾病开始达到缓解,证明我们此前判断的准确性。在疾病缓解后,我们仍按照指南与相关循证医学证据持续使用免疫联合地舒单抗维持治疗约2年,最终患者达到了CR的良好效果,这是患者自身坚持治疗与我们多学科规范化、个体化诊疗共同带来的好结果。
除了持续的多学科规范化管理外,尽管患者骨转移症状缓解,我们仍在骨放疗后第一时间联合地舒单抗进行骨保护治疗。结合最新的机制探索,我们规范化的骨保护治疗方案可能也助力这位“免疫难治”患者最终达到CR:
临床通常将骨痛等“症状”视为骨转移的“主要矛盾”,而骨放疗不仅控制骨转移症状,还能杀伤肿瘤,有望与免疫治疗协同带来生存获益。因此,尽管指南建议骨转移患者无论是否有症状,都应持续接受骨保护药物治疗,但很多患者在骨放疗缓解症状后仅继续接受原发灶治疗,不再进行骨保护治疗。对于这例患者,我们在放疗缓解症状后,仍持续、规范的使用地舒单抗,这主要是基于我们的临床经验。在此前我们开展的一项多中心、前瞻性观察性研究显示:骨放疗、尤其是被动的姑息性骨放疗未能改善接受免疫治疗肺癌患者的总生存,放疗与免疫治疗的协同作用在骨转移人群似乎“失效了”,这提示我们骨转移对免疫治疗的影响比我们预想的更复杂[5]。既然骨放疗并不能解决所有“骨转移的问题”,骨保护药物在放疗后的干预也就“势在必行”。
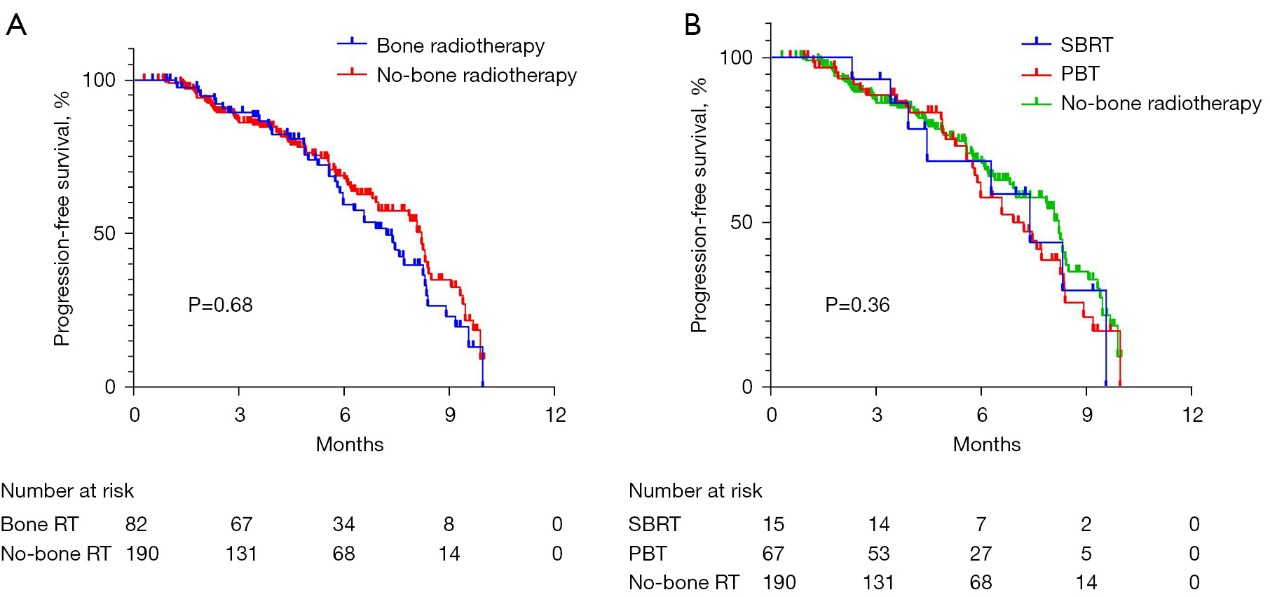
近期一系列基础研究成果可能揭示了这一现象背后的机制:
1)与低剂量放疗抑制破骨细胞活跃不同,肿瘤治疗应用的高剂量放疗可促进骨转移灶破骨细胞活跃,可导致包含骨桥蛋白(OPN)的破骨细胞相关蛋白在放疗后的大量分泌[6]。
2)一项发表于Cancer Cell 的转化医学成果则表明[7]:骨转移是“全身问题”,削弱全身免疫治疗疗效。而OPN是骨转移诱导骨外病灶形成“冷肿瘤”、导致骨转移患者全身免疫治疗效果不佳的关键,这一机制被称为“RANKL-OPN全身免疫抑制链”。
3)多项回顾性分析支持通过使用地舒单抗可抑制“RANKL-OPN全身免疫抑制链”,为需要使用免疫治疗且存在骨转移的肺癌患者实现“逆转抑制、协同增效”的“全身获益”,带来更深缓解、更长生存[7,9,10]。
骨转移症状缓解后持续骨保护治疗的必要性、骨放疗与免疫协同获益在骨转移人群受限背后的机制都逐渐清晰:骨转移灶只要存在,无论是否有症状,都会持续带来OPN释放、骨放疗也可能导致OPN释放,而OPN是骨转移灶诱导全身免疫抑制,削弱全身免疫治疗疗效的核心。从机制出发,对于使用免疫治疗且需要接受骨放疗的患者,只要骨病灶仍存在,放疗后第一时间联合地舒单抗,阻断骨转移“RANKL-OPN免疫抑制链”,有望全面逆转骨转移导致的全身病灶免疫抑制,恢复免疫治疗的疗效,助力实现骨放疗与免疫治疗协同获益的最大化。
综上,多学科模式对于存在骨转移的肺癌患者来说有重要意义,肿瘤内科,放疗科、骨科、核医学科等科室均可为骨转移患者适配解决方案,如何在规范化诊疗的框架下为患者提供最优的个体化治疗方案是重中之重。回到上文的案例,患者通过包含放疗、免疫治疗、化疗、骨保护治疗的综合治疗,最终从即将发生SRE、免疫难治患者到实现免疫治疗最终CR的好结局,都离不开多学科的通力合作。而以地舒单抗为代表的骨保护药物是骨转移治疗的基石之一,指南与相关共识均建议确诊骨转移后应立刻开始骨保护治疗,不以症状作为是否使用骨保护药物的依据。近期机制探索进一步提示,地舒单抗是骨转移患者全身不可或缺的一部分,尤其是对于那些计划接受免疫治疗的患者,确诊骨转移后立刻启动地舒单抗治疗、阻断“RANKL-OPN免疫抑制链”有望带来“缓解与生存”的“全身获益”,实现逆转抑制、协同增效。
1. Nakahara Y, Hosomi Y, Shibuya M, et al. Multicenter study of zoledronic acid administration in non-small-cell lung cancer patients with bone metastasis: Thoracic oncology research group (TORG) 1017. Mol Clin Oncol, 2019, 11(4): 349-353.
2. Lopez-Olivo MA, Shah NA, Pratt G, et al. Bisphosphonates in the treatment of patients with lung cancer and metastatic bone disease: A systematic review and meta-analysis. Support Care Cancer, 2012,20(11): 2985-2998.
3. Macedo F, Ladeira K, Pinho F, Saraiva N, Bonito N, Pinto L, Goncalves F. Bone Metastases: An Overview. Oncol Rev. 2017 May 9;11(1):321.
4. Manglaviti S, Bini M, et al. High bone tumor burden to identify advanced non-small cell lung cancer patients with survival benefit upon bone targeted agents and immune checkpoint inhibitors. Lung Cancer. 2023 Dec;186:107417.
5. Dong H, Lan A, Gao J, et al. Prognostic significance of bone metastasis and clinical value of bone radiotherapy in metastatic non-small cell lung cancer receiving PD-1/PD-L1 inhibitors: results from a multicenter, prospective, observational study. Transl Lung Cancer Res. 2024 Oct 31;13(10):2603-2616.
6. Donaubauer AJ, Deloch L, Becker I, et al. The Influence of Radiation on Bone and Bone Cells-Differential Effects on Osteoclasts and Osteoblasts. Int J Mol Sci. 2020 Sep 2;21(17):6377.
7. Cheng JN, Jin Z, Su C, et al. Bone metastases diminish extraosseous response to checkpoint blockade immunotherapy through osteopontin-producing osteoclasts. Cancer Cell. 2025 Jun 9;43(6):1093-1107.e9.
8. Henry D, Vadhan-Raj S, Hirsh V, et al. Denosumab versus zoledronic acid for treatment of bone metastases in patients with advanced cancer: an integrated analysis of 3 pivotal, double-blind, randomised phase 3 trials. Support Care Cancer, 2014, 22(3): 679-687.
9. Cao, Y., Afzal, M.Z., and Shirai, K. (2021). Does denosumab offer survival benefits? -Our experience with denosumab in metastatic non-small cell lung cancer patients treated with immune-checkpoint inhibitors. J. Thorac. Dis. 13, 4668–4677.
10. Liede, A., Hernandez, R.K., Wade, S.W., et al. (2018). An observational study of concomitant immunotherapies and denosumab in patients with advanced melanoma or lung cancer. OncoImmunology 7, e1480301.
排版编辑:肿瘤资讯-IRIS











 苏公网安备32059002004080号
苏公网安备32059002004080号


