2025年9月21日,由北京科创医学发展基金会主办的【肿瘤规范化诊疗项目——2025“颈彩纷呈”头颈肿瘤专家学术沙龙】第七期MDT中心交流会在四川成都成功举办。本次会议邀请国内三大顶尖医疗中心——四川大学华西口腔医院+四川大学华西医院、上海交通大学医学院附属第九人民医院、哈尔滨医科大学附属肿瘤医院的MDT团队参加,聚焦头颈肿瘤复杂病例MDT诊疗的深度研讨,旨在共同推动我国头颈肿瘤MDT模式的规范化与高质量发展。


会议伊始,大会主席李龙江教授、何悦教授以及郝春成教授共同发表致辞。头颈肿瘤的治疗集外科、内科与放射治疗于一体,即便多学科协作已趋于常态化,但每次深入探讨都能激发新的治疗思路,对提升临床疗效至关重要。同时,在新型药物与新型诊疗技术不断涌现的背景下,MDT理应被赋予更多内涵,不仅要服务于患者治疗,还要成为推动临床科研的关键平台。本次会议旨在学习国内顶尖MDT中心的宝贵经验,以更好地服务于临床实践。三位主席共同预祝本次学术会议取得圆满成功。

四川大学华西口腔医院+四川大学华西医院MDT团队


病例分享:一例同步放化疗联合TPEx方案挽救性治疗复发上颌窦鳞癌的病例分享 向中正 教授

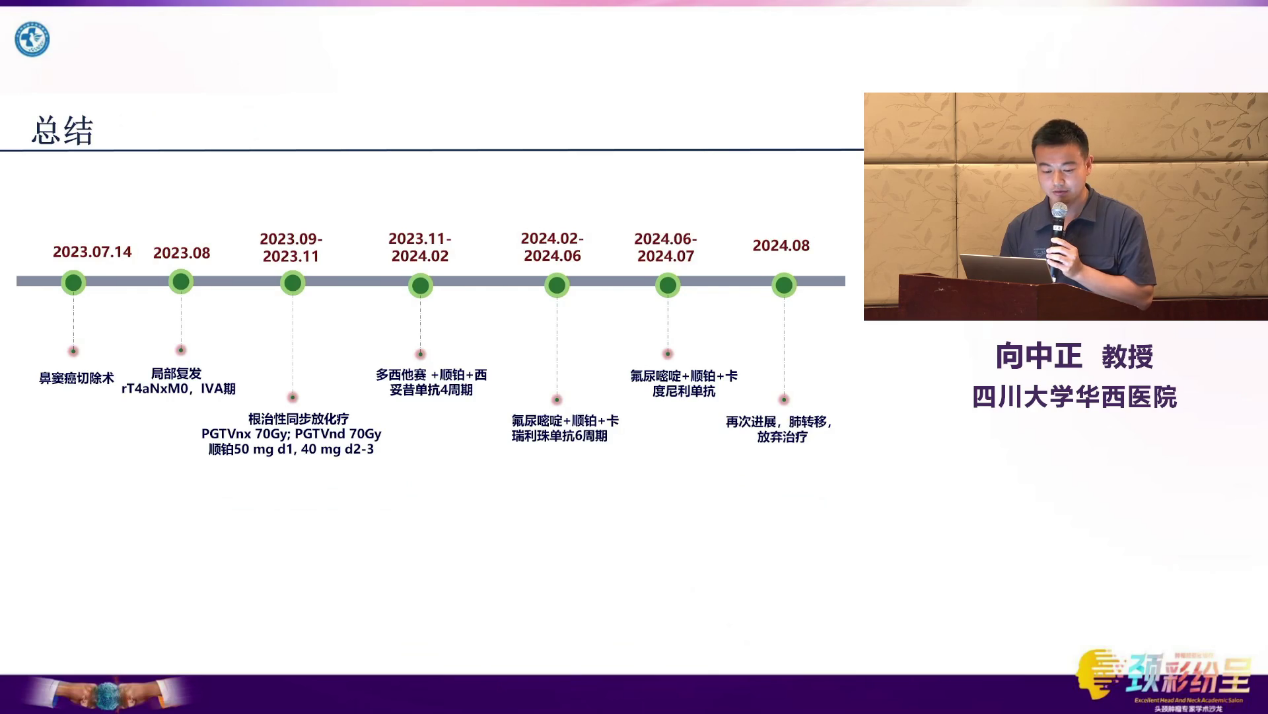
患者,51岁,男性,9年前因“右侧上颌窦内翻性乳头状瘤”行手术治疗。
2023-7-14,患者因“右侧面部肿胀疼痛”在外院接受右侧鼻腔鼻窦肿瘤切除术,术后病理证实为右侧上颌窦鳞状细胞癌,部分区域伴内翻性乳头状瘤。
2023-8-27,患者因“鼻塞及疼痛”至四川大学华西医院就诊。入院查体及颌面部增强MRI提示,右侧上颌窦区见巨大增强软组织肿块,向前侵犯皮肤,向上累及筛窦及眶后部,向下侵犯牙龈。全身检查未见远处转移。入院诊断为右侧上颌窦鳞状细胞癌术后局部复发(rT4aNxM0,ⅣA期),伴高血压3级。
MDT讨论认为,患者短期内复发,病灶范围广泛,累及多个重要结构,再次手术难度极大且创伤巨大,故优先推荐非手术综合治疗。
2023-9至2023-11,患者接受根治性同步放化疗(放疗联合顺铂化疗)。2023-11-18复查MRI,结果示局部病灶较前显著缩小,疗效评价为部分缓解(PR),但仍有明显强化灶残留。
针对残留病灶,MDT团队考虑患者残留病灶范围仍较大,右侧上牙龈退缩不显著,仍无法彻底根治性切除,建议继续进行全身药物治疗。
基因检测结果示:EGFR扩增/突变,MSS,PD-L1(TPS 1%, CPS 3),同时伴有CCND1扩增。经MDT团队分析,EGFR的改变可能预示着对免疫检查点抑制剂疗效不佳,甚至存在超进展风险,决定暂不使用免疫治疗,最终选择靶向治疗进行挽救。
2023-11至2024-2,患者接受4个周期的TPEx方案(紫杉醇+顺铂+西妥昔单抗)治疗。2周期后复查MRI提示病灶几乎达完全缓解(CR)。然而,4周期治疗后复查影像学,右侧面颊部病灶继续增大,疗效评价为疾病进展(PD)。
鉴于病情再次进展,MDT决策转向免疫联合化疗,选择卡瑞利珠单抗联合PF化疗方案(氟尿嘧啶+顺铂)。2024-2至2024-6,患者接受6周期治疗,但疗效不佳,右侧面颊部病灶持续增大,且复查中发现左肺上叶出现新发转移灶,总体疗效评价为PD。
团队更换为卡度尼利单抗联合PF方案,但在完成两个疗程后,患者病情急剧恶化,面颊部病灶及肺部病灶均迅速增大,呈现典型的超进展状态。经与患者及家属充分沟通,患者决定放弃后续治疗。

大咖论道-病例讨论:
上海交通大学医学院附属第九人民医院:
该病例在放疗前或可考虑诱导化疗以最大化缩小肿瘤,而前期放疗可能对局部免疫微环境产生双重影响(激活或抑制),这可能是后续免疫治疗出现超进展的潜在因素。基因检测提示患者存在EGFR扩增状态,因此中期治疗选择基于西妥昔单抗的TPEx方案,这突显了分子标志物在指导难治性病例治疗中的核心价值。然而,传统RECIST标准在评估头颈肿瘤疗效时存在局限性,尤其是在评价骨质侵犯、鉴别假性进展以及量化肿瘤密度改变等方面。
哈尔滨医科大学附属肿瘤医院:
假如患者在首次手术后能够及时接受MDT评估并进行术后辅助放疗,或许可以避免短期内的复发,从而改变病程。对于后续治疗,当患者出现寡转移时,可以积极采用局部消融手段,如立体定向局部放疗(SBRT)控制转移灶。在全身治疗方面,当标准方案失败后,或可考虑抗血管生成靶向药物作为新的治疗选择,为患者争取更多生机。
四川大学华西口腔医院+四川大学华西医院:
该患者病程展现了肿瘤的高度异质性与治疗的复杂性,无论是从术后极短期内复发,到对放化疗部分有效,再到对靶向治疗初期敏感后迅速耐药,最终在免疫治疗中出现超进展,每一步都充满不确定性。因此,对于携带EGFR改变等特定分子标志物的患者,免疫治疗的决策需格外审慎。当前治疗手段存在局限,期待更有效的创新疗法以突破晚期患者的治疗瓶颈。

上海交通大学医学院附属第九人民医院MDT团队


病例分享一:一例局部晚期舌鳞癌的新辅助免疫联合化疗病例 朱琦 教授

患者,63岁,男性,因“右舌部肿物3月余”入院。专科检查及影像学评估提示为右舌占位(大小约3.7×2厘米),伴双侧颈部淋巴结肿大,部分淋巴结呈现包膜外侵犯(ENE)征象。
活检病理示高分化鳞状细胞癌,免疫组化示PD-L1 CPS高达25。诊断为右舌鳞状细胞癌,临床分期为T2N3bM0(IVB期)。
经MDT讨论,临床团队决定采用新辅助治疗策略。2024-11至2025-1,患者接受2周期TTP方案(PD-1抑制剂联合白蛋白紫杉醇、顺铂)治疗。治疗结束后评估,原发灶及颈部淋巴结均获得显著缩小,影像学评价达PR。
2025-1至2025-2,患者接受右侧舌肿物扩大切除术+前臂皮瓣转移修复术+双侧颈淋巴清扫术。术后病理结果示,原发灶区域仅见少量残留癌细胞,达到主要病理缓解(MPR),双侧颈部清扫出的所有淋巴结均未查见肿瘤细胞,实现病理学完全缓解(pCR)。
基于病理反应及患者对生活质量的要求,经MDT讨论后,患者术后使用特瑞普利单抗免疫单药维持治疗。截至2025年6月,患者仍处于持续缓解状态。
病例分享二:一例肿瘤浸润淋巴细胞(TIL)疗法挽救难治性口腔癌病例 朱琦 教授

患者,61岁,男性,主诉“口底渐进性肿物8月”。患者有长期吸烟及槟榔咀嚼史,且曾于2016年因喉癌接受过喉镜下声带肿物切除术,及术后放疗(25Gy)。
专科检查发现口底巨大外生性肿物(约3.3厘米),已侵犯颌骨,并伴双侧颈部固定淋巴结。活检病理为中分化鳞状细胞癌,PD-L1 CPS 0。诊断为口底鳞状细胞癌,临床分期T4aN2cM0(IVA期)。
MDT讨论认为,挽救性手术需行扩大的颌骨切除,创伤巨大且术后恢复风险高,且患者对手术抵触。2024-4至2024-8,患者接受3周期TPEx方案全身药物治疗。治疗结束后,影像学复查评估为PD,肿瘤进一步增大。
在标准治疗失败后,经患者同意,患者参加TIL疗法临床研究。治疗后复查PET-CT,结果显示患者口底及颈部病灶完全消失,达到完全代谢缓解(CMR)。局部活检亦证实,原肿瘤区域已无癌细胞残留,存在大量免疫效应细胞浸润。

大咖论道-病例讨论:
哈尔滨医科大学附属肿瘤医院:
病例一的诊疗过程表明,对于新辅助治疗疗效显著的患者,依据疗效选择术后免疫维持是一种合理的个体化策略。然而,对于新辅助治疗后病理反应极佳的患者,术后放疗是否可以降级或豁免这一关键问题,应基于更高级别的循证医学证据行“减法”策略。TIL细胞疗法在病例二上的成功应用则体现了顶尖医疗中心的科研转化实力,而在TIL治疗取得成功后,后续可考虑采用PD-1或PD-L1抑制剂进行维持治疗,以巩固疗效,实现长期疾病控制。
四川大学华西口腔医院+四川大学华西医院:
病例一中的新辅助免疫联合化疗已成为改善局晚期头颈肿瘤预后的重要方式,而病例二中的TIL疗法等细胞治疗则为晚期难治性患者带来新的希望。MDT的价值不仅在于制定初始方案,更在于贯穿全程的动态管理和决策调整。临床中常遇到原发灶与转移灶对治疗反应不一的情况,此时需要内、外科医生密切沟通,及时调整策略,避免错失最佳治疗窗口。
上海交通大学医学院附属第九人民医院:
尽管免疫联合化疗在病例一中取得了优异的病理缓解,但能否为所有患者所优选仍需探索。如何界定最佳治疗周期、如何在新辅助疗效优异的情况下安全实施降级手术,以提升患者生活质量,是亟待通过临床研究回答的问题。TIL疗法虽在病例二的成功应用中展现了广阔前景,但其最佳应用场景(一线或后线)、如何进一步优化疗效、以及治疗后如何有效巩固以实现长期控制等关键问题,都是未来研究的重点方向。
哈尔滨医科大学附属肿瘤医院MDT团队


病例分享:一例治疗后进展的下咽癌病例分享 钟振滨 教授

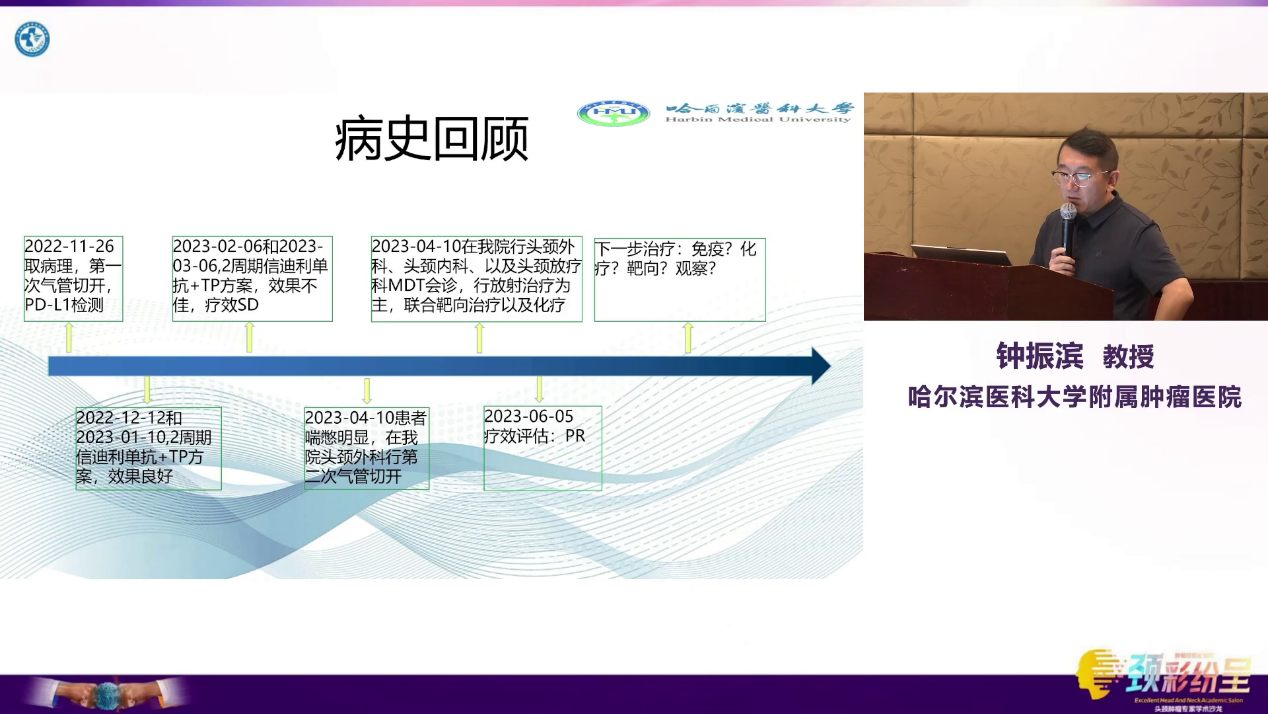
患者,67岁,男性,因“下咽癌化免治疗4周期后,气管切开1天”主诉入院。患者有长期吸烟饮酒史。2022-10,因发现右颈部肿物就诊于外院,经活检确诊为“下咽鳞状细胞癌”,颈部淋巴结穿刺证实转移。临床分期为T4aN3M0(IVB期),PD-L1 CPS 2。
2022-12至2023-3,患者在外院接受4周期新辅助治疗(信迪利单抗联合TP方案),治疗初期疗效尚可,2周期后评估为PR。
在完成4周期治疗后,2023-4-10复查MRI提示PD,肿瘤较前增大,并迅速出现了严重的吸气性呼吸困难和三凹征,形成急性喉梗阻。患者紧急转入哈尔滨医科大学附属肿瘤医院,MDT讨论后立即行紧急气管切开术,解除生命危险。术后检查示肿瘤已侵犯椎前间隙,分期进展为T4bN3M0(IVB期),失去手术机会。
2023-4-10,患者接受根治性调强放疗(同步推量,PGTV总剂量达6996cGy/33F),同步联合每周一次的顺铂化疗和西妥昔单抗靶向治疗。治疗结束后复查,影像学显示下咽原发灶和颈部转移淋巴结均获得显著消退,疗效评价为PR。

大咖论道-病例讨论:
四川大学华西口腔医院+四川大学华西医院:
下咽癌是头颈肿瘤中预后较差的类型,治疗决策尤其需要谨慎。本例患者在新辅助治疗2周期后评估为PR,这本应是MDT重新评估、考虑转为手术或根治性放疗等局部治疗的最佳时机。然而,继续原方案治疗导致疾病进展并错失根治窗口,这凸显了MDT是贯穿治疗全程的实时、动态决策过程,只有这样才能真正根据患者的治疗反应,及时调整策略,抓住稍纵即逝的治疗机会。
上海交通大学医学院附属第九人民医院:
该病例新辅助治疗的最终失败,可能与肿瘤内在的耐药机制有关,如特定的基因突变(如CDKN2A等)可能导致其对初始有效的治疗方案迅速产生抗性。对于本次病情危重、进展迅速的病例,后续的挽救治疗方案采用在放疗基础上联合西妥昔单抗的决策,符合指南推荐,并成功实现PR,展现出良好疗效。在常规病例中,应慎重权衡联合治疗带来的疗效增益与风险,以实现个体化治疗的最佳平衡。
哈尔滨医科大学附属肿瘤医院:
该病例提出了一个针对临床核心困境的思考,即对于接受新辅助治疗的患者,如何判断最佳的疗效评估节点和转换局部治疗的时机。同时,该病例也提示在非MDT全程管理体系下的治疗决策可能存在的僵化和延迟。因此,建立动态、高频的MDT机制十分必要,以确保在治疗的关键节点上,能够迅速整合多学科意见,做出最有利于患者的决策。
大会总结

会议尾声,李龙江教授、何悦教授、郝春成教授对本次大会进行总结。在头颈肿瘤治疗中,MDT已成为标准模式。尽管新辅助治疗等全身手段进步显著,但在头颈肿瘤治疗中,以先进修复重建技术为基础的手术治疗依然是核心,而放射治疗在确保局部控制率、处理临床病灶方面的作用同样不可替代。本次会议中,三个MDT团队分享的精彩案例与前沿进展,必将有力推动我国头颈肿瘤MDT诊疗模式的深化与发展,为提升患者生存质量与预后带来新的启示。

排版编辑:肿瘤资讯-TJ











 苏公网安备32059002004080号
苏公网安备32059002004080号


